AL型淀粉样变性的治疗
2012-11-26陈文萃综述王庆文审校
陈文萃 综述 王庆文 审校
免疫球蛋白轻链淀粉样变性(immunoglobulin light chain amyloidosis,AL)即AL型淀粉样变性,为最常见的原发性系统性淀粉样变性,年发病率约为8.9/百万人[1]。目前认为AL型淀粉样变性的发病主要与异常增生的浆细胞或B细胞克隆产生异常免疫球蛋白轻链——淀粉样物质前体,异常聚集形成淀粉样纤维沉积在组织器官,通过物理及机械作用引起组织器官结构损害及功能障碍。此外,轻链本身也具有细胞毒作用,能直接导致心肌细胞等损害[2]。AL型淀粉样变性可累及多个组织器官,临床表现亦不相同。70%AL型淀粉样变性累及肾脏,临床表现为肾病综合征或急性肾损伤等;而心脏受累则表现为心肌肥厚,心电图低电压趋势等,最终引起器官功能障碍,导致死亡。实验室检查可能出现血、尿轻链的升高,免疫固定电泳显示单克隆免疫球蛋白轻链阳性,但组织活检是确诊AL型淀粉样变性的金标准,其特异性表现为刚果红染色阳性并且在偏振光下观察呈苹果绿。理想治疗方案应从减少轻链生成、阻止淀粉样纤维的聚集及促进组织中沉积的淀粉样物质的吸收等方面着手。AL型淀粉样变性预后差,其自然病程为1~2年,累及心脏者其中位生存期仅6月。近年来,新的化疗方案及干细胞移植大幅提高了AL型淀粉样变性治疗的有效率、血液学缓解及器官反应率,提高了患者的整体生存期及生活治疗。本文就近年来AL型淀粉样变性的化疗及干细胞移植治疗的进展作一综述。
化 疗
适合干细胞移植患者的诱导治疗 移植前诱导治疗的主要目的是降低轻链负荷,从而在大剂量马法兰(HDM)化疗前稳定器官功能。同时,能否耐受化疗也预示着患者对HDM的承受能力。但化疗药物的毒性可能加重器官功能障碍,从而导致干细胞移植不能如期进行,因此目前对干细胞移植前是否先行诱导治疗尚无定论。
Sanchorawala等[3]将 100例新诊断的 AL型淀粉样变性患者随机分为两组,第一组直接行大剂量马法兰联合干细胞移植(HDM/SCT)治疗,第二组口服两个疗程的马法兰+泼尼松(MP)后再行HDM/SCT治疗。平均随访45月,结果显示两组之间的总体生存率、血液学反应率及器官改善情况无明显区别。且第二组有部分患者因诱导治疗过程中出现疾病进展而无法行HDM/SCT治疗,心脏受累患者更为明显。而长春新碱+表柔比星 +地塞米松(VAD)方案虽不影响干细胞的动员及采集,但Perz等[4]研究结果提示HDM/SCT前予VAD方案化疗并不能提高移植后的血液学缓解率,且心脏毒性较大,不建议AL型淀粉样变性患者使用。大剂量地塞米松(Dex)3个疗程诱导后行干细胞移植,能提高移植后的完全缓解率,但治疗相关死亡率(TRM)也高达10%。
理想的移植前诱导治疗应该起效迅速且不良反应小,同时避免使用烷基化药物。硼替佐米联合地塞米松(BD)治疗AL型淀粉样变性,血液学及器官反应率高,且起效快,不良反应相对轻微,是比较有前景移植前诱导化疗方案。目前关于BD方案及大剂量Dex作为移植前诱导疗效对比的随机临床试验已经在荷兰、比利时及德国等开展。
不适合干细胞移植患者的化疗 不适合行干细胞移植治疗的患者可予含烷化剂的方案治疗。既往常用的方案主要为MP或马法兰+地塞米松(MD)方案。MP方案虽然能提高AL型淀粉样变性患者生存率,但血液学反应率较低且时间较长,中位反应时间为7月;而MD方案的血液学反应率相对较高(62%~67%),其中完全缓解(CR)率为25%~33%,35%~ 48% 的患者获得器官反应[5,6]。心脏受累患者比例较高组,其总体反应率也较低[7,8]。近年来,沙利度胺、雷那度胺及硼替佐米等新药在临床研究中显示出更高的疗效及安全性。
沙利度胺 沙利度胺单药治疗的耐受性差,疗效不理想,不良反应主要有乏力、嗜睡、液体潴留、便秘、体位性低血压、外周神经病变及肾功能损害等[9]。而联合地塞米松或马法兰、环磷酰胺等药物可有较好的疗效。沙利度胺+环磷酰胺+地塞米松(CTD)治疗75例晚期AL型淀粉样变性患者(其中31例为初治),74%患者获得血液学反应,其中21%为CR,获得CR及部分缓解(PR)患者的3年总体生存率(OS)分别为100%及82%。TRM为4%,8%患者因为治疗相关不良反应退出治疗[10]。沙利度胺+马法兰+地塞米松(MTD)方案治疗22例心脏受累严重而不能行干细胞移植的患者,8例患者获得血液学反应,4例患者心脏收缩功能改善,提示心脏收缩功能储备较好的患者使用MTD方案治疗是可行且有效的[11]。
雷那度胺 一项雷那度胺松治疗23例AL型淀粉样变性的患者(其中10例为初治)的研究显示10例患者病情得到改善,并且雷那度胺联合地塞米松用药的疗效显著高于单用雷那度胺治疗[12]。雷那度胺+马法兰+地塞米松(LMP)治疗26例初治患者,血液学反应发生率为58%,其中CR为23%,且雷那度胺剂量为15mg/d组的CR率达到42%。50%患者获得器官反应,而且器官反应与血液学是否缓解密切相关[13]。接受雷那度胺+环磷酰胺+地塞米松(LCD)治疗4个疗程以上,血液学反应率为60%,总体反应率为87%。中位总体生存时间为16.1 月。
以硼替佐米为主的方案 硼替佐米为可逆性蛋白酶体抑制剂,可以选择性地与蛋白酶体活性位点的苏氨酸结合,可逆性抑制蛋白酶体26S亚单位的糜蛋白酶/胰蛋白酶活性,从而抑制蛋白质降解(主要为与泛素结合的蛋白质),影响细胞内多个信号通路,引起细胞死亡。浆细胞合成异常折叠的轻链后,胞内泛素蛋白酶体系统超负荷,对蛋白酶体抑制剂尤为敏感[14]。BD方案治疗AL型淀粉样变性,血液学及器官反应率高,且反应时间短。对于初治或其他治疗方案治疗后复发的患者仍有较好的疗效(表1)[15-19]。BD方案治疗18例初治AL型淀粉样变性患者,其CR率达47%,获得血液学反应的中位时间仅为52d[20]。26例患者(18例为初治)经 BD方案治疗总体反应率54%,31%达CR,中位无疾病进展生存期及总体生存期分别为5月及18.7月(CR患者尚未达观察终点,未纳入统计),中位反应时间为7.5周,无3级以上不良反应发生[15]。
此外,李娟等[16]以BD治疗5例经肾活检确诊为AL型淀粉样变性的患者,2例在确诊后14月死亡,1例病情稳定,2例获得血液学反应,并且脏器功能得到改善。BD方案起效快,血液学反应时间平均为1.5个疗程,而器官反应为2个疗程。主要不良反应为乏力、腹泻或便秘、水肿加重等,无治疗相关死亡。而翟勇平等[17]BD方案治疗11例AL型淀粉样变性(7例为初治),中位治疗时间为3个疗程,33%的患者获得至少一个以上器官反应,中位反应时间为2月,主要不良反应为血小板减少、周围神经病变及带状疱疹等,但3级以上不良反应发生率较低。

表1 硼替佐米单用或联合用药方案治疗AL型淀粉样变性的疗效
造血干细胞移植治疗
自体外周血干细胞移植治疗 迄今为止,HDM/SCT仍是AL型淀粉样变性最有效的治疗方案。尽管造血干细胞治疗不能治愈AL型淀粉样变性,但与化疗相比:(1)完全缓解率高,而是否获得完全缓解,是决定患者长期预后的主要因素之一;(2)复发率低,维持疾病稳定时间长;(3)干细胞移植后患者生活质量提高,并且可以获得长期存活。资料显示干细胞移植治疗AL型淀粉样变性患者的5年生存率达60%[18],而移植后获得CR的患者,10年存活率达50%以上。
国际血液与骨髓移植研究中心分析了来自各个中心的77例行干细胞移植的AL型淀粉样变性患者,移植后1年及3年的存活率分别为66%及56%。但TRM却高达18%,高于一些单中心研究的结果,这可能与选择合适的患者有关[19]。近5年的研究结果显示,选择合适的移植患者,可使TRM降至5%左右。而另一项研究观察了28例初治的患者,11例行干细胞移植治疗,7例行化疗,余8例在治疗前死亡,3年总体生存率分别为64%及28%[21]。Sanchorawala等[22]对 53例AL型淀粉样变性患者行干细胞移植,移植后6个月的血液学完全缓解率(HCR)为55%,而TRM为8%。Cibeira等[23]则对比了421例干细胞移植患者的长期预后,81例患者在移植后1年死亡,其余的340例患者43%获得CR,其中位无事件生存期、总体生存期及器官反应率分别为8.3年、13.2年及78%,而未获得CR患者分别为 2年、5.9年及 52% 。而Madan等[24]研究认为,心脏受累患者减低马法兰剂量的干细胞移植亦可行,其中位总体生存期为54月,血液学缓解率为66%,心脏反应率为44%,但TRM也高达16%。黄湘华等[25]报道了13例AL型淀粉样变性患者行HDM/SCT治疗,随访4~10月,血液学反应率为61.5%,其中5例达CR(38.5%),器官反应率为53.8%。
移植后未获得完全缓解的患者是否行序贯移植的问题目前尚无定论。Sanchorawala等[22]对在行首次HDM/SCT后6个月未获得HCR的17例患者行二次移植,6例(31%)获得 HCR,1例在移植后100d内死亡,TRM为6%。
同种异体干细胞移植及器官移植 一些脏器功能储备较好的年轻患者(<60岁),在HDM/HCT后复发,也可考虑行同种异体造血干细胞移植。Guillaume等[26]最早于1997年报道了一例AL淀粉样变性女性患者经异基因骨髓移植后病情改善。2006年欧洲血液及骨髓移植小组报道了19例同种异体干细胞移植的AL型淀粉样变性患者,其中15例为同种异基因,4例为同系同基因异体移植,平均随访19月,移植后1年的OS及无疾病进展生存率(progression-free survival,PFS)分别为60%及53%,10例获得血液学反应,其中8例获得完全缓解。7例患者获得了长期生存,其中5例患者出现移植物抗宿主病,提示移植物抗浆细胞增生在其中起到了重要的作用。但在减低预处理强度后,TRM仍高达40%,主要死于为心力衰竭及重度感染[27]。
而对于一些因器官受累严重,而不能首选干细胞移植的患者,器官移植联合干细胞移植或化疗也有一定的疗效。12例心脏受累严重,而其他脏器受累不明显的AL型淀粉样变性患者,实行心脏移植联合HDM/SCT或化疗。4例在心脏移植后获得CR。其余8例患者中,5例行HDM/SCT治疗,1例MP方案化疗,2例不能耐受后续治疗,1年生存率为83%,与普通心脏移植患者相近[28]。Dey等[29]对8例因心脏受累严重而不能行干细胞移植AL型淀粉样变性患者行心脏移植联合HDM/SCT治疗,5例在干细胞移植后获得HCR,1例获得血液学部分缓解。心脏移植后平均随访56月,5例患者获得长期存活且无复发。与非淀粉样变性心脏移植患者相比,其7年存活率分别为60%及64%,且在移植后心脏中未见淀粉样物质的沉积。这提示心脏-自体干细胞序贯移植具有可行性。而Herrmann等[30]报道了19例行肾移植的淀粉样变性患者,8例行肾移植-自体干细胞移植、6例行自体干细胞移植-肾移植、5例肾移植联合非清髓治疗,中位随访时间41.4月,79%的患者存活。第1组有5例患者因移植排斥死亡,第2组及第3组各有1例复发。移植术后中位生存期与总体生存期无差别,3组之间的存活率亦无区别。
复发难治性AL型淀粉样变性的治疗
在干细胞移植或其他方案治疗疾病仍进展或复发的患者,需考虑更换治疗方案。而近年来沙利度胺、雷那度胺、硼替佐米等新药多作为二线及三线治疗方案,对于一部分复发难治性AL型淀粉样变性,仍能获得血液学及器官反应,但其长期疗效有待进一步观察。
沙利度胺+地塞米松(TD)31例复发难治性AL型淀粉样变性患者采用沙利度胺+地塞米松方案进行治疗,48%患者获得血液学反应,其中19%获得CR,26%患者获得器官反应,中位反应时间为3.6月[31]。而16 例 HDM/SCT 治疗后未获得血液学反应的患者,经TD方案治疗9个疗程后,13例获得了血液学反应,2年生存率为84%[32]。
雷那度胺+地塞米松(LD) 目前主要用于其他药物治疗无效或治疗后复发的难治性AL型淀粉样变性的治疗,现有相关报道均为小样本研究。雷那度胺联合或不联合地塞米松治疗的血液学反应率为41%~47%,获得血液学反应的中位时间为6个疗程左右。雷那度胺联合地塞米松治疗34例AL淀粉样变性(19例曾行HDM/SCT治疗,7例曾沙利度胺化疗)患者,24例完成了3个疗程的治疗,总体的血液学反应率达 67%,其中 7例(29%)获得 HCR[33]。
Pomalidomide也为沙利度胺的衍生物,目前研究发现其对多发性骨髓瘤、骨髓纤维化及胰腺癌等有改善作用,而用于治疗AL型淀粉样变性较少。25例既往行HDM/SCT、雷那度胺或沙利度胺治疗的AL患者服用Pomalidomide及地塞米松治疗,随访12月,总体的血液学反应率为47%,给研究其应用于治疗AL型淀粉样变性提供了良好的基础。
硼替佐米 HDM/SCT移植后复发的患者经硼替佐米治疗后血轻链降至正常,并且受累组织器官得到改善[34]。Kastritis等[35]初期研究结果显示,18例患者(11例为复发)经BD方案治疗后,血液学反应率及CR率分别为94%及44%。Wechalekar等[36]报道了20例复发难治性AL型淀粉样变性,经硼替佐米治疗1~6个疗程(9例联用地塞米松),HCR为 15%,PR率达 65%。2010年,Kastritis等[15]分析了94例 AL型淀粉样变性患者(其中65%为复发难治,且合并心脏受累)经BD方案(硼替佐米 1.3mg/m2+ 地塞米松 40mg,1d、4d、8d、11d)化疗后,71%获得了血液学反应,其中CR率为25%。29%的患者获得心脏反应,1年生存率达76%。而Reece等[37]对比硼替佐米两种治疗方案对复发难治性AL型淀粉样变性的疗效(硼替佐米1.6mg/m2,1d、8d、15d、22d,35d 为一个疗程或 1.3mg/m2,1d、4d、8d、11d,21d 为一个疗程)血液学反应率分别为68.8%及66.7%(CR率分别为37.5%及24.2%),1年生存率分别为93.8%及84%,3级以上不良反应发生率分别为79%及50%,因此而退出/减量两组分别为38%/53%及28%/22%,提示两种治疗方案均有较好的疗效及耐受性。
支持治疗
支持治疗是改善患者症状,提高生活质量的重要手段。低血压患者可考虑使用米多君升压治疗,但往往效果不明显。而利尿剂则是双刃剑,在减轻水肿,改善心脏前负荷的同时,可能引起血管内容量减少,而引起低血压。而一部分顽固性水肿患者,利尿效果差。Hoyer等[38]应用贝伐单抗治疗1例顽固性水肿及胸腔积液的AL型淀粉样变性患者,取得了较好的效果。
影响预后的因素
AL型淀粉样变性患者的预后与年龄、体力状态、心脏受累的程度、游离轻链的水平、血尿酸及受累器官数目及浆细胞负荷等密切相关。其中心脏受累严重程度是决定患者预后的最关键因素,心室壁增厚、舒张功能异常、射血分数下降及心肌劳损等均提示预后不良[39]。心脏分子标记物肌钙蛋白I或T(TnI或TnT)及脑钠肽(BNP)或N端前脑钠肽(NT-proBNP)是评价心功能的重要指标,是决定AL型淀粉样变性患者的预后的独立危险因素。根据TnT及BNP是否高于正常,将新诊断的AL型淀粉样变性患者分为3期,心脏分期为3期的患者的生存率明显低于前二者[40]。随访的868例淀粉样变性患者中,75%死于心脏淀粉样变性[41]。
此外,梅奥中心回顾性分析229例适合干细胞移植的AL型淀粉样变性患者,平均随访52月,中位生存期为42月,而AL型淀粉变性总体中位生存期仅为18月,因此适合干细胞移植,也提示预后较好[42]。
治疗方案的选择
AL型淀粉样变性多见于40岁以上的中老年人,起病时病情轻重程度不一,因此治疗方案的选择应高度个体化。需综合考虑患者的年龄、器官功能状态,尤其是心、肺、肝、肾脏等重要脏器功能,及治疗的不良反应及毒性,制定合适的治疗方案,而对于有条件行干细胞移植治疗的患者,应首选干细胞移植治疗(图1)。
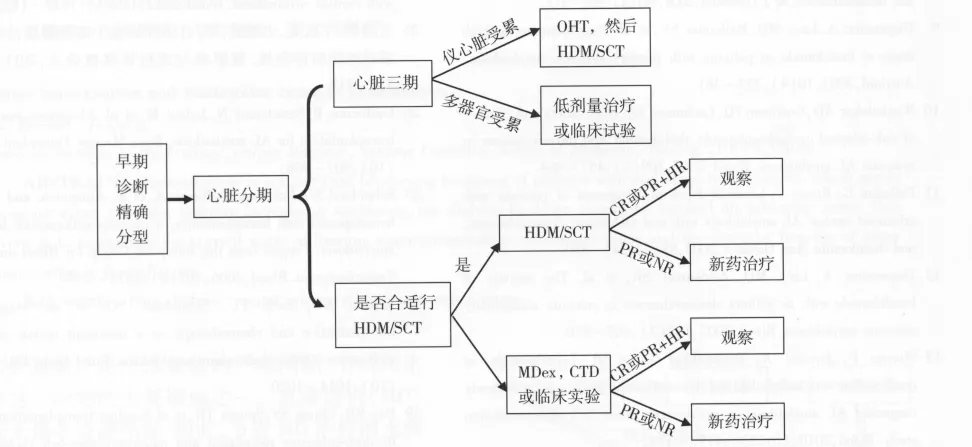
图1 AL型淀粉样变性患者治疗方案的选择[41]
小结:近年来,AL型淀粉样变性在化疗及干细胞移植治疗方面取得较大进展。除传统的马法兰、地塞米松等方案外,沙利度胺、雷那度胺及硼替佐米等新型化疗药物也取得了令人振奋的效果,对初治或复发难治的患者均有一定的疗效。随着干细胞移植的开展及选择适合的移植患者,在提高了生存率的同时也大大降低治疗相关死亡的发生。自体外周血干细胞移植能提高患者总体生存率及生活质量,对于有条件的患者应作为首选治疗。综合考虑各种因素,选择合适的高度个体化的治疗方案,但早期诊断仍是治疗的关键。
1 Kyle RA,Linos A,Beard CM,et al.Incidence and natural history of primary systemic amyloidosis in Olmsted County,Minnesota,1950 through 1989.Blood,1992,79(7):1817-1822.
2 Shi J,Guan J,Jiang B,et al.Amyloidogenic light chains induce cardiomyocyte contractile dysfunction and apoptosis via a noncanonical p38alpha MAPK pathway.Proc Natl Acad Sci U SA,2010,107(9):4188-4193.
3 Sanchorawala V,Wright DG,Seldin DC,et al.High-dose intravenous melphalan and autologous stem cell transplantation as initial therapy or following two cycles of oral chemotherapy for the treatment of AL amyloidosis:results of a prospective randomized trial.Bone Marrow Transplant,2004,33(4):381-388.
4 Perz JB,Schonland SO,Hundemer M,et al.High-dose melphalan with autologous stem cell transplantation after VAD induction chemotherapy for treatment of amyloid light chain amyloidosis:a single centre prospective phase Ⅱ study.Br JHaematol,2004,127(5):543-551.
5 Palladini G,Perfetti V,Obici L,et al.Association of melphalan and high-dose dexamethasone is effective and well tolerated in patients with AL(primary)amyloidosis who are ineligible for stem cell transplantation.Blood,2004,103(8):2936-2938.
6 Bellavia D,Pellikka PA,Al-Zahrani GB,et al.Independent predictors of survival in primary systemic(Al)amyloidosis,including cardiac biomarkers and left ventricular strain imaging:an observational cohort study.J Am Soc Echocardiogr,2010,23(6):643-652.
7 Dietrich S,Schönland SO,Benner A,et al.Treatment with intravenous melphalan and dexamethasone is not able to overcome the poor prognosis of patients with newly diagnosed systemic light chain amyloidosis and severe cardiac involvement.Blood,2010,116(4):522-528.
8 Lebovic D,Hoffman J,Levine BM,et al.Predictors of survival in patients with systemic light-chain amyloidosis and cardiac involvement initially ineligible for stem cell transplantation and treated with oral melphalan and dexamethasone.Br JHaematol,2008,143(3):369-373.
9 Dispenzieri A,Lacy MQ,Rajkumar SV,et al.Poor tolerance to high doses of thalidomide in patients with primary systemic amyloidosis.Amyloid,2003,10(4):257-261.
10 Wechalekar AD,Goodman HJ,Lachmann HJ,et al.Safety and efficacy of risk-adapted cyclophosphamide,thalidomide,and dexamethasone in systemic AL amyloidosis.Blood,2007,109(2):457-464.
11 Palladini G,Russo P,Lavatelli F,et al.Treatment of patients with advanced cardiac AL amyloidosis with oral melphalan,dexamethasone,and thalidomide.Ann Hematol,2009,88(4):347-350.
12 Dispenzieri A,Lacy MQ,Zeldenrust SR,et al.The activity of lenalidomide with or without dexamethasone in patients withprimary systemic amyloidosis.Blood,2007,109(2):465-470.
13 Moreau P,Jaccard A,Benboubker L,et al.Lenalidomide in combination with melphalan and dexamethasone in patients with newly diagnosed AL amyloidosis:a multicenter phase 1/2 dose-escalation study.Blood,2010,116(23):4777-4782.
14 Sitia R,Palladini G,Merlini G.Bortezomib in the treatment of AL amyloidosis:targeted therapy.Haematologica,2007,92(10):1302-1307.
15 Lamm W,Willenbacher W,Lang A,et al.Efficacy of the combination of bortezomib and dexamethasone in systemic AL amyloidosis.Ann Hematol,2011,90(2):201-206.
16 李 娟,赵 莹,曾丽金,等.硼替佐米联合地塞米松治疗原发性系统性淀粉样变疗效及安全性.中华内科杂志,2009,48(9):741-744.
17 翟勇平,宋 萍,唐玉梅,等.硼替佐米联合地塞米松治疗原发性系统性淀粉样变性.中华血液学杂志,2010,31(5):319-322.
18 Rajkumar SV,Gertz MA.Advances in the treatment of amyloidosis.N Engl J Med,2007,356(23):2413-2415.
19 Vesole DH,Pérez WS,Akasheh M,et al.High-dose therapy and autologous hematopoietic stem cell transplantation forpatients with primary systemic amyloidosis:a Center for International Blood and Marrow Transplant Research Study.Mayo Clin Proc,2006,81(7):880-888.
20 Kastritis E,Wechalekar AD,Dimopoulos MA,et al.Bortezomib with or without dexamethasone in primary systemic (light chain)amyloidosis.J Clin Oncol,2010,28(6):1031-1037.
21 Smirnova AG,Smirnov AV,Zander A,et al.Autologous peripheral blood hematopoietic cell transplantation in the treatment of AL-amyloidosis.Ter Arkh,2010,82(10):61-64.
22 Sanchorawala V,Wright DG,Quillen K,et al.Tandem cycles of highdose melphalan and autologous stem cell transplantation increases the response rate in AL amyloidosis.Bone Marrow Transplant,2007,40(6):557-562.
23 Cibeira MT,Sanchorawala V,Seldin DC,et al.Outcome of AL amyloidosis after high-dose melphalan and autologous stem celltransplantation:long-term results in a series of 421 patients.Blood,2011,118(16):4346-52.
24 Madan S,Kumar SK,Dispenzieri A,et al.High-dose melphalan and peripheral blood stem cell transplantation forlight-chain amyloidosis with cardiac involvement.Blood,2012,119(5):1117-1122.
25 黄湘华,王庆文,史明君,等.自体外周血干细胞移植治疗原发性系统性淀粉样变性.肾脏病与透析肾移植杂志,2011,20(4):312-318.
26 Guillaume B,Straetmans N,Jadoul M,et al.Allogeneic bone marrow transplantation for AL amyloidosis.Bone Marrow Transplant,1997,20(10):907-908.
27 Schönland SO,Lokhorst H,Buzyn A,et al.Allogeneic and syngeneic hematopoietic cell transplantation in patients withamyloid light-chain amyloidosis:a report from the European Group for Blood and Marrow Transplantation.Blood,2006,107(6):2578-2584.
28 Kristen AV,Sack FU,Schonland SO,et al.Staged heart transplantation and chemotherapy as a treatment option in patients with severe cardiac light-chain amyloidosis.Eur JHeart Fail,2009,11(10):1014-1020.
29 Dey BR,Chung SS,Spitzer TR,et al.Cardiac transplantation followed by dose-intensive melphalan and autologousstem-cell transplantation for light chain amyloidosis and heart failure.Transplantation,2010,90(8):905-911.
30 Herrmann SM,Gertz MA,Stegall MD,et al.Long-term outcomes of patients with light chain amyloidosis(AL)after renaltransplantation with or without stem cell transplantation.Nephrol Dial Transplant,2011,26(6):2032-2036.
31 Palladini G,Perfetti V,Perlini S,et al.The combination of thalidomide and intermediate-dose dexamethasone is an effective but toxic treatment for patients with primary amyloidosis(AL).Blood,2005,105(7):2949-2951.
32 Cohen AD,Zhou P,Chou J,et al.Risk-adapted autologous stem cell transplantation with adjuvant dexamethasone+/- thalidomide for systemic light-chain amyloidosis:results of a phase II trial.Br J Haematol,2007,139(2):224-233.
33 Sanchorawala V,Wright DG,Rosenzweig M,et al.Lenalidomide and dexamethasone in the treatment of AL amyloidosis:results of aphase 2 trial.Blood,2007,109(2):492-496.
34 Brunvand MW,Bitter M.Amyloidosis relapsing after autologous stem cell transplantation treated withbortezomib:normalization of detectable serum-free light chains and reversal oftissue damage with improved suitability for transplant.Haematologica,2010,95(3):519-521.
35 Kastritis E,Anagnostopoulos A,Roussou M,et al.Treatment of light chain(AL)amyloidosis with the combination of bortezomib and dexamethasone.Haematologica,2007,92(10):1351-1358.
36 Wechalekar AD,Lachmann HJ,Offer M,et al.Efficacy of bortezomib in systemic AL amyloidosis with relapsed/refractory clonal disease.Haematologica,2008,93(2):295-298.
37 Reece DE,Hegenbart U,Sanchorawala V,et al.Efficacy and safety of once-weekly and twice-weekly bortezomib in patients with relapsed systemic AL amyloidosis:results of a phase 1/2 study.Blood,2011,118(4):865-873.
38 Hoyer RJ,Leung N,Witzig TE,et al.Treatment of diuretic refractory pleural effusions with bevacizumab in fourpatients with primary systemic amyloidosis.Am J Hematol,2007,82(5):409-413.
39 Falk RH.Diagnosis and management of the cardiac amyloidoses.Circulation,2005,112(13):2047-2060.
40 Dispenzieri A,Gertz MA,Kyle RA,et al.Serum cardiac troponins and N-terminal pro-brain natriuretic peptide:a staging system for primary systemic amyloidosis.J Clin Oncol,2004,22(18):3751-3757.
41 Merlini G,Seldin DC,Gertz MA.Amyloidosis:pathogenesis and new therapeutic options.JClin Oncol,2011,29(14):1924-1933.
42 Dispenzieri A,Lacy MQ,Kyle RA,et al.Eligibility for hematopoietic stem-cell transplantation for primary systemicamyloidosis is a favorable prognostic factor for survival.JClin Oncol,2001,19(14):3350-3356.
