尿激酶型纤溶酶原激活物及其Ⅰ型抑制剂mRNA在实验性肌炎肌肉组织中的表达和意义
2012-05-04段枫
段 枫
多发性肌炎(polymyositis,PM)是一组以肌肉炎性改变为特征、常伴有肌纤维坏死变性的肌病。目前普遍认为,PM是遗传易感个体由于环境因素触发引起的免疫介导过程,其发病机制尚未明了。纤溶系统是非常重要的细胞外基质降解酶,通过降解细胞外基质成分(extracellul-ar matrix,ECM),在许多生理和病理过程中发挥重要作用,包括免疫和炎性反应。特别是uPA系统,参与了巨噬细胞的增殖、黏附和迁移,被认为在炎性反应过程中发挥了重要的作用。目前尚无uPA系统在PM、EAM发病机制中的作用方面的研究。本实验应用RT–PCR技术研究uPA、PAI-1基因mRNA在EAM和正常豚鼠肌肉组织中的表达,旨在探讨纤溶酶原激活系统在EAM发病中的作用,为其治疗提供线索。
1 材料与方法
1.1 试剂 兔肌球蛋白5 mg/0.5 ml、完全弗氏佐剂(美国sigma公司)、百日咳毒素(北京天坛生物制品所)、Trizol试剂盒(美国GibcoBRL公司)、反转录试剂盒(美国Promega公司)。
1.2 实验动物和分组 25只健康雌性英国短毛豚鼠(符合二级动物标准),重250~300 g,由解放军军医进修学院实验动物中心提供。随机分为:(1)正常组10只,不进行任何处理;(2)EAM组15只,按以下程序进行EAM动物模型诱导。两组观察到第4周末后,处死动物,取血及肌肉标本,做进一步研究。
1.3 EAM 动物模型诱导 取0.5 ml,10 μg/ml的兔肌球蛋白与等量福氏完全佐剂(CFA)混合制成1 ml抗原乳剂,分别于第0、7、14、21天背部皮下注射1次,同时于第0、7天给予百日咳毒素2 μg腹腔注射。EAM动物模型成功标准:根据临床评分、血肌酶变化及肌肉病理综合判断模型是否成功,模型成功的动物进行肌肉uPA和PAI-1基因mRNA表达的研究。
1.4 评价指标 每次免疫注射后观察豚鼠体重、免疫注射局部皮肤、步态、毛色、活跃度。根据动物体重、姿势、呼吸及活动情况,以Lennon LA法评分。标准:0分,无明显的肌无力表现;1分,无力咬啮或鸣叫;2分,休息时隆起体位,头下垂,前肢屈曲,行走震颤;3分,严重肌无力,不鸣叫,体重减轻,甚至肌肉萎缩,呼吸困难,濒于死亡。症状居中者分别评分为0.5、1.5、2.5 分。
1.5 标本制备 (1)动物免疫成功后第4周末水合氯醛麻醉动物后,活体取股四头肌,分成两部分,一部分样本离体30 min内置于液氮冷冻,随后转移入-80℃冰箱中保存,备做rt-PCR,另一部分新鲜肌肉标本经异戊烷-液氮速冻,行5 μm冷冻切片,HE染色,光镜下观察;(2)心脏取血,测定血肌酶(CK)。
1.6 uPA、PAI-1基因mRNA表达的测定
1.6.1 总RNA的提取和定量 取冻存的标本各100 mg,分别加入1 ml Trizol溶液,提取总RNA,通过测定A260值和A280值分别计算RNA的浓度和纯度,1180<A260/A280<2100。
1.6.2 反转录反应体系(20 μl) 水 5 μl,加入总RNA 1 μg,混匀,在PCR 仪上保温,70 ℃ 10 min,4 ℃ 5 min,依次加入M-MLV 5 缓冲液4 μl,dNTP混合物10 mM,2 μl,重组RNA 酶抑制药0.5 μl,M-MLV 反转录酶200 U,随机引物0.5 μg,加水至终体积20 μl并混匀,在PCR仪上保温,25℃ 10 min,37 ℃ 120 min,99 ℃ 5 min,4 ℃ 5 min,cDNA 模板-20℃保存备用。
PCR反应体系10PCR 缓冲液10 μl,dNTP10 mM 2 μl,cDNA 模板4 μl,上游引物1 μg,下游引物1 μg,TaqDNA 聚合酶2.5 u,加水至终体积100 μl,混匀。反应条件:uPA预变性94℃,5 min,变性94 ℃,0.5 min,退火53 ℃,0.5 ~1 min,延伸72 ℃ ,1 min,循环数27,终末延伸72℃,7 min。PAI-1:预变性94 ℃ 5 min,变性94 ℃,0.5 min,退火52℃,0.5 ~1 min,延伸72 ℃1 min,循环数28,终末延伸72℃,7min。各引物根据Genebank合成。
uPA上游引物5'CCTACAATGCTCACAGATCCGATGC3',下游引物 5'TCCACTGCCCCAGCTCACAA3',PAI-1上游引物 5'AGCCCTCACTTGCCTCACCC3',下游引物 5'CACTGATATTGAATCCCATAGCATCTT3'。
1.6.3 PCR产物相对定量 PCR产物经琼脂糖凝胶电泳分离后,溴化乙啶染色,用凝胶扫描仪进行电泳条带强度分析。以GAPDH作为内参照,将uPA/GAPDH,PAI-1/GAPDH的值作为各自表达水平的参数,在扫描仪上如未发现明显条带,则不按上述方法计算,作为阴性表达,参数计为0。
1.6.4 结果判定 有阳性条带作为阳性表达,计算表达阳性率;表达强度以相对灰度值表示:目的基因相对表达水平=(目的基因灰度值-背景灰度值)/(看家基因灰度值一背景灰度值)。
1.7 统计学处理 所有数据使用SPSS11.0软件进行统计分析。本研究测定数值用±s表示,两样本均数比较用成组t检验。两变量间的相关分析用双尾Pearson相关检验。P<0.05为差异有统计学意义。
2 结 果
2.1 EAM组发病情况 EAM组15只豚鼠免疫注射后两周开始出现背部皮肤红肿、破溃,2只豚鼠(5,14)免疫各周活动正常,体重增长,血肌酶正常,肌肉HE染色未见异常;13只动物免疫2周后出现活动减少,体重下降,其中2只豚鼠(7,11)分别于免疫第3、4周死亡,死亡后肌肉病理证实存在肌肉变性坏死及淋巴细胞浸润,死亡原因考虑为肌炎导致的呼吸功能衰竭;其余11只豚鼠血肌酶明显增高,肌肉HE染色可见炎性改变;15只动物中有13只物模型成功,11只存活,模型成功率73.3%。正常组豚鼠各周活动正常,体重增长,血CPK值小于696.09 U/L。EAM组豚鼠的LennonLA评分变化及EAM组血清CK值见表1。EAM组的LennonLA评分与血CK显著正相关(表1)。血CK是反应EAM急性期疾病严重程度的客观指标。
2.2 肌肉病理形态 正常组及EAM组5、14号豚鼠肌肉HE染色(图1A),EAM组13只临床发病的豚鼠(2只死亡)肌肉HE染色结果显示,肌纤维大小不等、变性、坏死、萎缩,肌内衣、肌束衣和间质小血管周围见淋巴细胞浸润(图1B、C、D)。
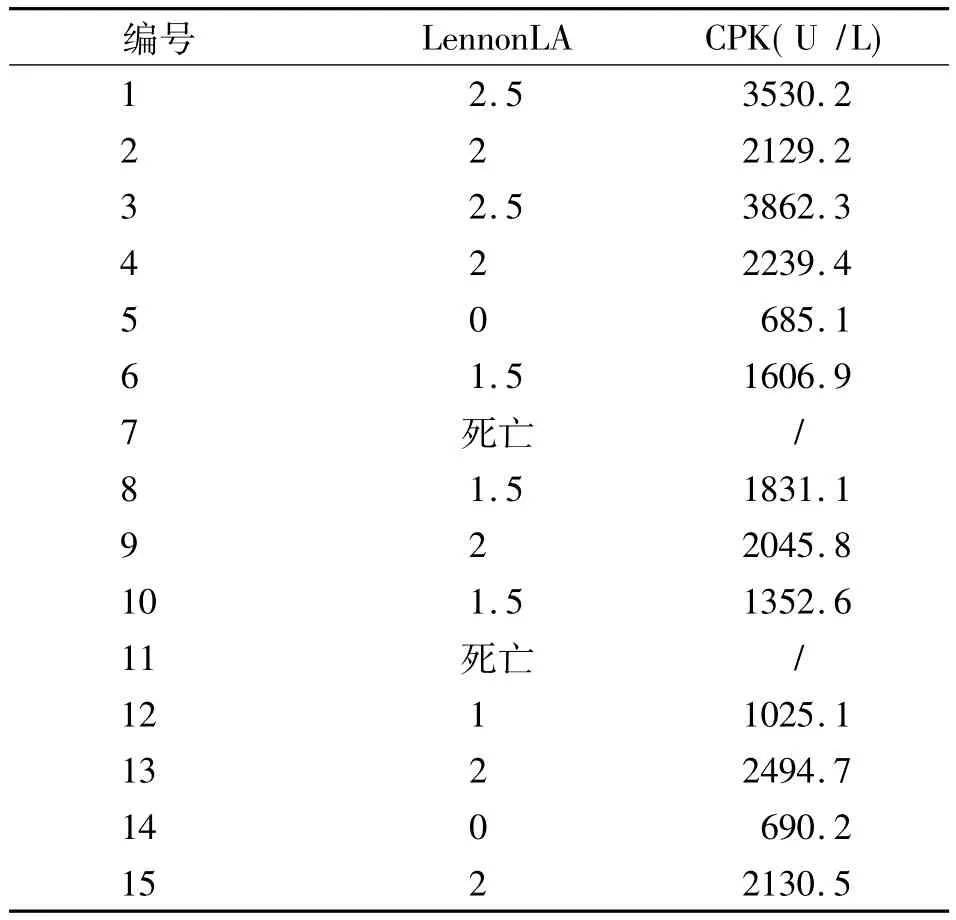
表1 EAM组L ennonLA评分及血CPK值
2.3 正常组和EAM肌肉上uPA、PAI-1基因mRNA的表达 本研究发现,正常组肌肉uPA 1.259±0.064、PAI-1基因mRNA表达水平1.13±0.080,EAM组肌肉uPA42.325±0.041、PAI-1基因mRNA表达水平2.055±0.037,EAM组肌肉uPA、PAI-1基因mRNA表达水平高于正常组(图2),差异有统计学意义(P<0.01)。同时为了进一步明确EAM发病机制中是否存在uPA/PAI-1失衡的问题,将正常组与EAM组uPA与PAI-1基因mRNA表达的比值(uPA/PAI-1)进行了统计分析,正常组uPA/PAI-1比值平均为1.10±0.023,EAM组uPA/PAI-1比值平均为1.114±0.017,两组之间无统计学差异(P>0.05)。
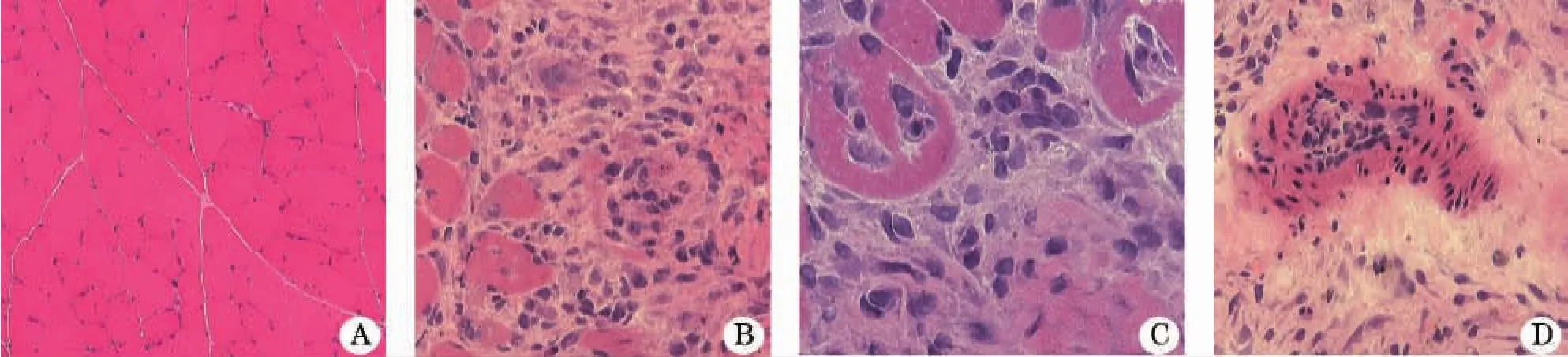
图1 正常组及EAM组豚鼠肌肉HE染色
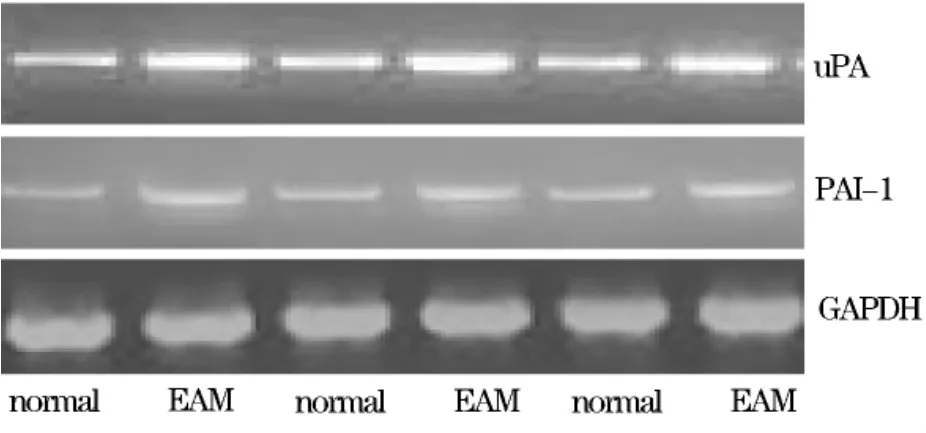
图2 正常组和EAM肌肉上uPA、PAI-1基因mRNA的表达
3 讨 论
uPA是一种丝氨酸蛋白酶,基因定位于10q24,分子量为54ku,以一种灭活的前体(pro-uPA)的形式分泌。在生理条件下,uPA主要来自于肾小管上皮细胞、免疫细胞、内皮细胞等,研究证实uPA也在多种哺乳动物的肌纤维上表达。uPA可以与细胞表面特异性的细胞膜受体(uPAR)结合[1],加速uPA前体在细胞表面转化成为激活的uPA,使纤溶酶原激活,uPA和纤溶酶还可以通过激活MMP或者通过直接蛋白水解作用,促进细胞外基质及基底膜中多种成分的降解参与炎性反应[1,2]。此外uPA和uPAR还参与了炎性细胞的分化增殖、迁移和黏附[3-5]。由此可见,uPA系统在炎性过程中发挥着重要的作用。有研究发现在肌肉损伤的模型中,uPA基因敲除小鼠肌肉损伤部位没有巨噬细胞的聚集[6,7]。uPA参与了巨噬细胞的趋化性。此外在肌肉损伤模型中还发现内源性产生的uPA可以增加单核细胞产生TNF-α[8],这说明吞噬细胞来源的蛋白酶是导致炎性前(致炎信号)产生的机制,uPA可能在肌肉炎性反应中发挥了同样的作用。本实验发现uPA基因mRNA在EAM组肌肉中的表达水平高于正常组,提示uPA参与了EAM的发病。EAM肌肉组织uPA转录水平的高表达,可能与入侵肌肉局部的炎性细胞,以及内源性单核巨噬细胞的产生有关。一方面uPA通过直接或间接的ECM降解作用,破坏血管基底膜,促进T细胞侵入肌组织,同时进一步降解基底膜,使肌纤维完整性遭到破坏,出现肌纤维坏死和吞噬现象。另外,uPA可能通过参与肌肉炎性部位巨噬细胞的趋化、炎性前信号的产生、炎性细胞的激活分化和增殖促进了EAM的发生。
纤溶酶原激活物抑制剂(PAI)是纤溶系统的重要组成成分,纤溶酶原活化系统(PAs)的主要的特异性抑制物。关于PAI在EAM中的作用可能具有双重性。一方面,PAI-1是uPA活性以及纤溶酶产生的主要调节剂,PAI-1与uPA以1∶1比例形成复合物灭活uPA的活性,从而对纤溶系统、及纤溶酶原激活剂参与的细胞外基质降解和信号传导起到重要调节作用,通过调节血管外蛋白水解抑制炎性过程。研究发现PAI-1基因敲出小鼠,肌肉损伤部位的巨噬细胞聚集增加[9],进一步证实了这一点。另一方面,PAI-1可以与血浆和细胞外基质的玻璃体结合蛋白、纤溶酶原激活剂及/受体(Upa/Upar)复合物结合,参与炎性细胞的黏附和脱离,从而促进炎性的发生[10]。PAI-1还能与炎性及细胞因子如肿瘤坏死因子-α、转化生长因子β、白细胞介素-1、白细胞介素-6等相互作用,使炎性因子渗出增加促进炎性的发生、发展[11]。本实验发现在EAM组肌肉中PAI-1基因mRNA的表达高于正常组,有统计学差异,提示PAI-1参与了EAM的发病机制。PAI-1在转录水平上的高表达,一方面可能是炎性过程中uPA表达增加后的一个自身调节,从而保证uPA系统的稳定,保证细胞内外环境的稳定;但更重要的是它可能促进了炎性的发生。笔者对正常组和EAM组之间uPA与PAI-1基因mRNA表达的参数比值进行了统计分析,两者没有差异。这说明uPA、PAI-1基因mRNA表达的增加在EAM组没有差异,这提示uPA/PAI-1系统的失衡并不是EAM发病的主要机制之一,如前所述,uPA/uPAR/PAI-1复合物的形成,参与炎性细胞的黏附和脱离,促进了炎性反应的发生,因此笔者推测在EAM发病机制中uPA/uPAR/PAI-1复合物的形成可能发挥了作用。
[1]Castellino F J,Ploplis V A.Structure and function of the plasminogen/plasmin system[J].Thromb Haemost,2005,93(4):647-654.
[2]张庆成,赵 杰,汪承炜,等.CD 40L、MMPs和 a-GMP-140在急性冠脉综合征致病中的作用[J].武警医学,2011,22(3):220-222.
[3]Luikart S M,Masri D,Wahl,et al.Urokinase is required for the formation of mactinin,an alpha-actinin fragment that promotes monocyte/macrophage maturation[J].Biochim Biophys Acta,2002,1591(1-3):99-107.
[4]Navaneetha K Rao,Guo Ping Shi,Harold A.Urokinase receptor is a multifunctional protein:influence of receptor occupancy on macrophage gene expression[J].J Clin Invest,1995,96(1):465-474.
[5]Paulis A,Montuori N,Prevete N,et al.Urokinase induces basophil chemotaxis through a urokinase receptor epitope that is an endogenous ligand for formyl peptide receptor-like 1 and-like 2[J].J Immunol,2004,173(9):5739-5748.
[6]Suelves M,Vidal B,Serrano A L,et al.uPA deficiency exacerbates muscular dystrophy in MDX mice[J].J Cell Biol,2007,178(6):1039-1051.
[7]Lluis F J,Roma M,Suelves,et al.Urokinase dependent plasminogen activation is required for efficient skeletal muscle regeneration in vivo[J].Blood,2001,97(6):1703-1711.
[8]Lòpez Alemany R,Suelve M,Muñoz Cánoves P.Plasmin gener-ation dependent on α-enolase-type plasminogen receptor is required for myogenesis[J].Thromb Haemost,2003,90(4):724-733.
[9]Koh T J,Bryer S C,Pucci A M,et al.Mice deficient in plasminogen activator inhibitor-1 have improved skeletal muscle regeneration[J].Am J Physiol Cell Physiol,2005,289(1):217– 223.
[10]Czekay R P,Loskutoff D J.Plasminogen activator inhibitors regulate cell adhesion through a uPAR-dependent mechanism[J].J Cell Physiol,2009,220(3):655-663.
[11]Zorio E,Gilabert-Estellés J,España F,et al.Fibrinolysis:the key to new pathogenetic mechanisms[J].Curr Med Chem,2008,15(9):923-929.
