心房颤动患者血浆骨保护素、核因子κB受体活化因子配体水平及临床意义
2012-04-26杨朋康西安市第一医院心内科西安710002
杨朋康 (西安市第一医院心内科, 西安 710002)
心房颤动(atrial fibrillation,AF)简称房颤,是临床上常见的心律失常,据统计,我国30岁以上人群房颤患病率为0.77%。迄今为止房颤的发病机制尚未完全清楚,近年来越来越多的实验和临床研究发现心房结构重塑、心肌细胞凋亡、炎症与房颤的发生和持续密切相关[1-3]。骨保护素(osteoprotegerin,OPG)/核因子-κB受体活化因子(receptor activator of nuclear factor kappa B,RANK)/RANK 配 体(RANK ligand,RANKL)途径在调节破骨细胞的分化及骨质改建过程中发挥重要作用[4]。最近研究发现OPG/RANKL具有调节炎症反应、细胞外基质重建及抗凋亡作用,与心力衰竭、动脉粥样硬化等多种心血管疾病有关[5-7]。为了进一步研究 OPG、RANKL在房颤中的作用,本研究检测不同类型房颤患者血浆中 OPG、RANKL水平,初步探讨 OPG、RANKL在房颤发生和持续中的作用。
1 资料与方法
1.1 研究对象 选取2010-06~2011-09在我院心内科住院根据病史、心电图确诊的房颤患者122例,根据2006年美国心脏病学会/美国心脏学会/欧洲心脏病学会(ACC/AHA/ESC)国际指南的分类标准,按照房颤持续时间不同将患者分为:阵发性房颤(发病时间小于7 d)40例、持续性房颤(发病时间小于6个月)39例、永久性房颤(持续时间大于6个月)43例。排除标准:急性冠脉综合征、其他类型心律失常、恶性肿瘤、免疫系统疾病、急慢性感染性疾病、肝肾功能不全、甲状腺功能异常、6个月内外伤及手术史、脑血管意外、孕妇及哺乳期、应用糖皮质激素、非甾体类药物等抗炎药物。同时选择同期住院40例窦性心律患者为对照组。房颤组及对照组在性别、年龄、基础疾病等因素相匹配。
1.2 标本收集及检测 无菌采集静脉血约3 ml,室温下1 500 r/min离心5 min,收集血浆后于-20℃保存待测。采用酶联免疫吸附法(ELISA)测定血浆中的OPG、RANKL的含量,实验操作严格按照试剂盒说明书进行。
1.3 统计学分析 利用SPSS16.0进行统计学处理,计数资料比较采用χ2检验,计量资料采用±s,两组比较采用t检验,多组比较采用单因素方差分析,当P值有统计学意义时再进行组间比较。P<0.05认为差异有统计学意义。
2 结果
2.1 一般情况 对照组和各组房颤患者在年龄、性别、冠心病、高血压、糖尿病及瓣膜病等因素的比较未见统计学差异(P>0.05,见表1)。
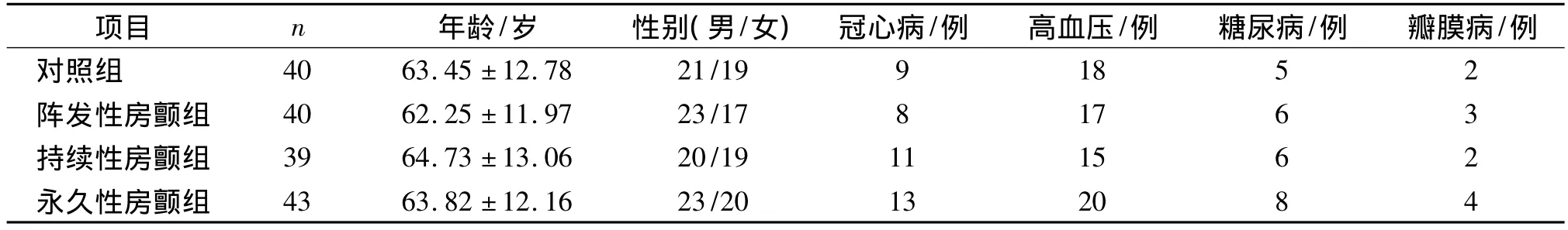
表1 各组患者一般临床资料的比较Tab 1 Clinical characteristics of patients in different groups
2.2 血浆OPG、RANKL水平的比较 实验结果发现阵发性房颤组、持续性房颤组、永久性房颤组患者血浆中OPG、RANKL水平明显高于对照组,差异有统计学意义(P<0.05),持续性房颤组、永久性房颤组患者与阵发性房颤组相比血浆中OPG、RANKL水平升高,差异有统计学意义(P<0.05),而持续性房颤组、永久性房颤组患者之间差异无统计学意义(P>0.05,见表2)。
表2 各组患者血浆中OPG、RANKL水平的比较(±s,pg/ml)Tab 2 Comparison of plasma levels of OPG and RANKL among different groups(±s,pg/ml)

表2 各组患者血浆中OPG、RANKL水平的比较(±s,pg/ml)Tab 2 Comparison of plasma levels of OPG and RANKL among different groups(±s,pg/ml)
与对照组相比,*P<0.05;与阵发性房颤组相比,#P<0.05
?
3 讨论
房颤是一种十分常见的心律失常,发作呈阵发性或持续性,慢性房颤患者栓塞发生率较高。房颤发病机制尚不完全清楚,目前认为房颤是多种因素共同作用的结果,存在触发和维持机制。近年来随着对发病机制研究不断深入,发现炎性反应在房颤的发生和维持中发挥重要作用,组织学及病例对照研究发现C反应蛋白(high sensitive C-reactive protein,hs-CRP)、白细胞介素 6(interleukin-6,IL-6)、肿瘤坏死因子 α(tumor necrosis factor α,TNF-α)等炎症因子在房颤中高表达[8-10]。炎性反应在房颤的具体机制尚未完全清楚,普遍认为心房电重构和结构重构是房颤发生和维持过程中的关键环节,国外学者研究认为炎症反应有助于房颤的电重构和结构重构,特别是在房颤的维持中发挥重要作用[11,12],此外Korantzopoulos等研究认为心房细胞及间质的炎性反应还可以直接引起触发活动,导致房颤的发生[13]。
OPG是肿瘤坏死因子受体超家族成员之一,OPG/RANKL/RANK系统在调节骨代谢中发挥重要作用。近年来发现OPG/RANKL/RANK可以调节血管细胞的存活、骨化及血管壁炎性反应,在糖尿病性大血管病变、主动脉瘤、心脏瓣膜病和动脉粥样硬化等心血管疾病中发挥重要作用[14],在ACS患者中,OPG是独立于传统危险标志物的预测长期死亡率和心力衰竭进程的强有力指标[15]。本实验结果发现阵发性房颤组、持续性房颤组、永久性房颤组患者血浆中OPG、RANKL水平均明显高于对照组(P<0.05),提示 OPG、RANKL参与了房颤的发生。我们还发现持续性房颤组、永久性房颤组患者与阵发性房颤组相比血浆中OPG、RANKL水平升高(P<0.05),提示 OPG、RANKL与房颤的持续相关。本实验结果与Cao等研究结果基本一致,该研究小组发现在房颤患者右心耳组织中OPG、RANKL蛋白和基因水平均升高[16,17]。综合目前关于房颤发病机制及OPG、RANKL的研究结果推测OPG、RANKL可能通过炎性反应导致心房电重构,诱发了房颤,同时炎症的持续存在还可以导致心房结构重构,使房颤得以维持。而本实验还发现OPG、RANKL在持续性房颤组、永久性房颤组患者之间差异无统计学意义,这可能是持续性房颤组、永久性房颤患者心房的电重构和结构重构程度差别不大有关。
综上所述,房颤患者血浆中OPG、RANKL水平增高,且持续性及永久性房颤患者比阵发性房颤患者的OPG、RANKL水平升高,OPG、RANKL可能通过炎性反应促进患者心房的电重构和结构重构,从而诱发和维持房颤,深入研究OPG、RANKL在房颤的具体作用机制对预防和治疗房颤具有一定的指导意义。
[1] Ko WC,Hong CY,Hou SM,et al.Elevated expression of connective tissue growth factor in human atrial fibrillation and angiotensin II-treated cardiomyocytes[J].Circ J,2011,75(7):1592 -1600.
[2] Aimé-Sempé C,Folliguet T,Rücker-Martin C,et al.Myocardial cell death in fibrillating and dilated human right atria[J].J Am Coll Cardiol,1999,34(5):1577 -1586.
[3] Hagiwara N.Inflammation and atrial fibrillation [J].Circ J,2010,74(2):246 -247.
[4] Silva I,Branco JC.RANK/RANKL/OPG:literature review [J].Acta Reumatol Port,2011,36(3):209 -218.
[5] 徐高阳,罗助荣.骨保护素系统与动脉粥样硬化的关系[J].中国动脉硬化杂志,2010,18(12):1004 -1008.
[6] Maruyama K,Takada Y,Ray N,et al.Receptor activator of NF-kappa B ligand and osteoprotegerin regulate proinflammatory cytokine production in mice[J].J Immunol,2006,177(6):3799 -3805.
[7] Venuraju SM,Yerramasu A,Corder R,et al.Osteoprotegerin as a predictor of coronary artery disease and cardiovascular mortality and morbidity[J].J Am Coll Cardiol,2010,55(19):2049 -2061.
[8] Conway DS,Buggins P,Hughes E,et al.Prognostic significance of raised plasma levels of interleukin-6 and C-reactive protein in atrial fibrillation[J].Am Heart J,2004,148(3):462 -466.
[9] Deng H,Xue YM,Zhan XZ,et al.Role of tumor necrosis factoralpha in the pathogenesis of atrial fibrillation[J].Chin Med J(Engl),2011,124(13):1976 -1982.
[10] 陈云霞,牛凡.家兔IL6与心房颤动的关系[J].山西医科大学学报,2007,38(6):491 -493.
[11] Toutouzas K,Synetos A,Drakopoulou M,et al.The role of inflammation in atrial fibrillation:a myth or a fact[J]?Am J Med Sci,2009,338(6):494 -499.
[12] Watanabe T,Takeishi Y,Hirono O,et al.C-reactive protein elevation predicts the occurrence of atrial structural remodeling in patients with paroxysmal atrial fibrillation [J].Heart Vessels,2005,20(2):45 -49.
[13] Korantzopoulos P,Kolettis T,Siogas K,et al.Atrial fibrillation and electrical remodeling:the potential role of inflammation and oxidative stress[J].Med Sci Monit,2003,9(9):RA225 -229.
[14] Kiechl S,Werner P,Knoflach M,et al.The osteoprotegerin/RANK/RANKL system:a bone key to vascular disease[J].Expert Rev Cardiovasc Ther,2006,4(6):801 -811.
[15] Omland T,Ueland T,Jansson AM,et al.Circulating osteoprotegerin levels and long-term prognosis in patients with acute coronary syndromes[J].J Am Coll Cardiol,2008,51(6):627 -633.
[16] Cao H,Wang J,Xi L,et al.Dysregulated atrial gene expression of osteoprotegerin/receptor activator of nuclear factor-κB(RANK)/RANK ligand axis in the development and progression of atrial fibrillation[J].Circ J,2011,75(12):2781 -2788.
[17] Cao H,Li Q,Li M,et al.Osteoprotegerin/RANK/RANKL axis and atrial remodeling in mitral valvular patients with atrial fibrillation[J].Int J Cardiol,2011:Epub ahead of print.
