体外循环再灌注血培养诱导肾小管细胞凋亡及乌司他丁的保护作用研究
2012-04-26邓永花赖前成万居易伍长学
邓永花,赖前成,万居易,伍长学,王 波,廖 斌
乌司他丁是一种广谱酶抑制剂,能够抑制炎性递质释放及对缺血再灌注器官具有保护作用[1]。体外循环是目前心脏外科心内直视手术不可避免的复杂的病理生理过程,复杂的管道系统、体外循环转机时间、灌注流量和压力、灌流模式等多种因素可导致患者术后发生肾功能损伤[2]。目前较少直接观察乌司他丁对体外循环缺血再灌注血清对人肾小管细胞损伤作用的保护。为此,本研究初步观察了体外循环后血清直接对人近曲肾小管上皮细胞HK-2损伤的作用,旨在探讨乌司他丁对肾功能保护作用及机制。
1 材料与方法
1.1 材料与试剂 人HK-2引自ATCC(American Type Culture Collection);DMEM(GIBCO);胰酶 (OXODI);胎牛血清 (成都哈里公司);Annexin V-FITC细胞凋亡检测试剂盒(北京中杉金桥公司);SP9000免疫组化染色试剂盒 (北京中杉金桥公司);多聚赖氨酸,DAB显色试剂盒 (武汉博士德公司);乌司他丁 (广东天普生化医药股份有限公司生产);其余试剂均为市售分析纯。
1.2 方法
1.2.1 HK-2细胞株的复苏、培养、传代 从液氮罐中取出冻存的HK-2细胞投入37℃的温水中,摇动使其尽快解冻。吸出细胞悬液并滴加10倍体积的含10%胎牛血清的DMEM培养基,混匀,1 000 r/min离心5 min,弃上清液后再重复洗涤1次。用含10%胎牛血清的DMEM培养液将细胞悬液稀释混匀,接种于100 ml培养瓶中,37℃下5%二氧化碳 (CO2)细胞培养箱中静置12 h,换液除去未贴壁细胞后至细胞长满成片80%以上。用质量分数为0.25%的胰蛋白酶消化,传代。
1.2.2 正常人、体外循环再灌注血清的制备 随机采集6例健康志愿者的外周血5 ml,立即在4℃离心机1 500 r/min离心15 min收集上清,-20℃保存备用。随机选取我科体外循环手术主动脉阻断时间在60 min以上的心脏手术患者12例,于开放主动脉1 h后采集外周血5 ml,立即在4℃离心机1 500 r/min离心15 min收集上清,-20℃保存备用。
1.2.3 肾小管上皮细胞缺血再灌注模型的建立 (1)培养肾小管上皮细胞的缺血模拟:100%N2饱和无糖无机盐缓冲液40 min,吸弃6孔板及培养瓶内的细胞培养基,用无糖无机盐缓冲液冲洗,加入100%N2饱和无糖无机盐缓冲液,置95%N2+5%CO2环境培养2 h。(2)培养肾小管上皮细胞的再灌注模拟及分组:吸弃6孔板及培养瓶内无糖无机盐缓冲液冲液后,空白组不含血清;对照组以正常人血清代替再灌注血清;试验组加入含10%体外循环再灌注血清的DMEM低糖培养基,置95%O2+5%CO2环境培养4 h;乌司他丁组以改良的缺血再灌注方式处理肾小管上皮细胞的过程中,施加乌司他丁干预。处理后的6孔板内的肾小管上皮细胞用于免疫细胞化学法(ICC)检测。培养瓶内的肾小管上皮细胞消化离心洗涤后采用流式细胞仪测定细胞凋亡。
1.2.4 细胞凋亡检测分析 胰酶消化细胞,PBS清洗2次,加入适量的荧光标记的annexin V试剂和碘化丙啶 (PI),混匀后避光室温下孵育15 min,孵育后加入400μl染色缓冲液,立即上流式细胞仪分析并记录结果。
1.2.5 caspase-3蛋白表达检测 按试剂盒说明书操作采用过氧化物酶标记的链霉卵白 (Streptavidin/Peroxidase,SP)染色的免疫组化检测caspase-3蛋白表达。图像分析采用Image-Pro Plus 6.0图像分析系统统计积分分光光度值 (IOD)。
1.3 统计学方法 采用SPSS 13.0统计软件包进行统计分析,计量资料以()表示,多组间比较采用方差分析,组间两两比较采用q检验,以p<0.05为差异有统计学意义。
2 结果
2.1 细胞凋亡检测 流式细胞仪检测结果显示,体外循环血清处理后,4组肾小管上皮细胞HK-2凋亡率比较,差异有统计学意义 (p<0.05);其中试验组较空白组、对照组、乌司他丁组均明显升高,差异均有统计学意义 (q值分别为17.85、18.98和29.64,P=0.00);空白组与对照组比较差异无统计学意义 (q=0.34,P=0.39);乌司他丁组与空白组、对照组比较差异均无统计学意义 (q值分别为0.59和0.56,P值分别为0.31和0.36,见表1)。
2.2 caspase-3蛋白免疫细胞化学染色 4组caspase-3蛋白IOD值比较差异有统计学意义 (p<0.05);其中试验组较空白组、对照组、乌司他丁组均明显升高,差异有统计学意义(q值分别为32.44、31.72和27.68,P=0.00);空白组与对照组比较差异无统计学意义 (q=1.10,P=0.27);乌司他丁组与空白组、对照组比较差异均无统计学意义 (q值分别为1.50和1.60,P=0.22和0.25,见图1、表2)。
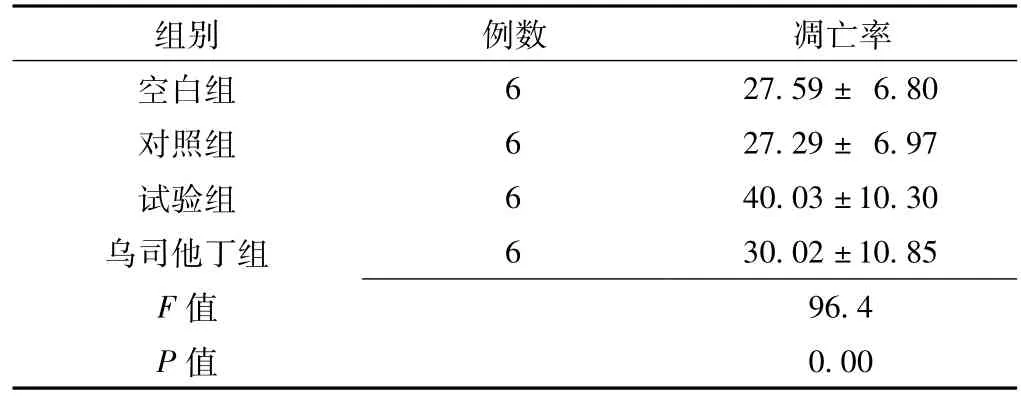
表1 4组肾小管上皮细胞HK-2凋亡率比较 (x ±s,%)Table 1 Comparison of apoptosis rate of HK-2 cells in four groups
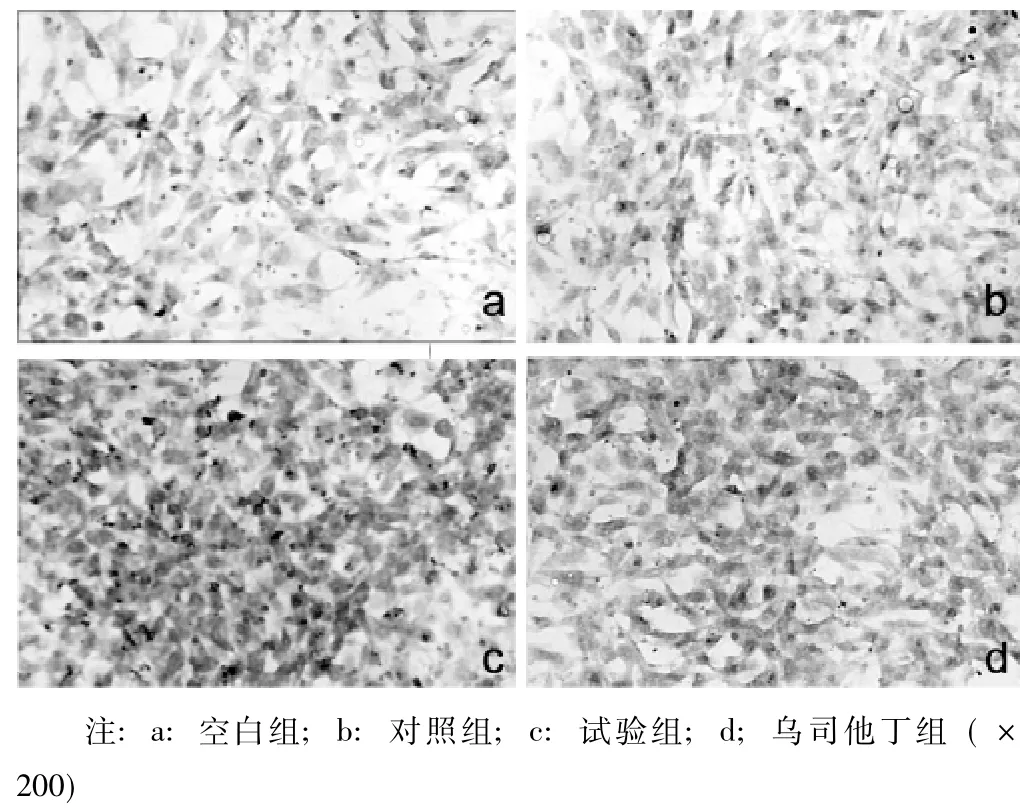
图1 caspase-3蛋白免疫细胞化学 (IHC)染色Figure 1 IHC staining of caspase-3 protein
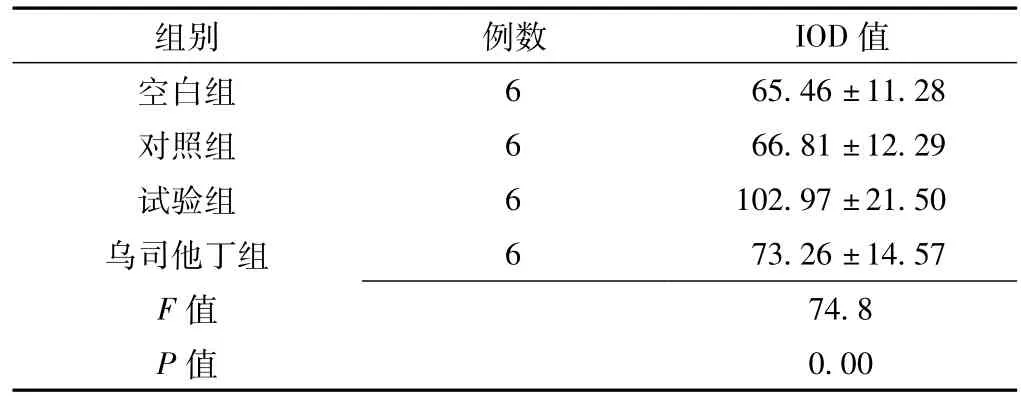
表2 4组caspase-3蛋白IOD值比较Table 2 Comparison of IOD in four groups
3 讨论
乌司他丁是从健康成年男性新鲜尿液中分离纯化出来的一种糖蛋白,属蛋白酶抑制剂,对胰蛋白酶、α-糜蛋白酶等丝氨酸蛋白酶及粒细胞弹性蛋白酶、透明质酸酶、巯基酶、纤溶酶等多种酶具有抑制作用[3],动物实验也证实其具有稳定溶酶体膜,抑制溶酶体酶的释放,抑制心肌抑制因子 (MDF)产生,清除氧自由基及抑制肿瘤坏死因子-α(TNF-α)等炎性递质释放的作用[4-5]。体外循环心脏手术后急性肾衰竭(AKI)的发生率为20% ~30%,其肾损害轻重不一[6]。动物实验证实体外循环并发AKI主要原因是导致肾小管损伤[7],其致病因素较复杂,包括缺血再灌注损伤及全身炎性递质,常是综合性因素所致[8]。
本研究体外培养HK-2细胞,用体外循环手术主动脉阻断时间在60 min以上的患者,于开放主动脉1 h后血清,真实全面地模拟手术后体内各个器官,多种因素参与的致病因子[9]。同时应用缺氧复氧模拟体内阻断时的缺血再灌注损伤。结果显示细胞凋亡率较对照组与空白组明显增加,而给予乌司他丁培养后凋亡率明显下降。
caspase-3是凋亡执行的重要效应分子,是凋亡发生的关键效应酶。其表达的增加、激活是凋亡信号转导路径中的关键环节,是凋亡启动过程中的早期事件,是参与调节和执行细胞凋亡最重要的蛋白酶之一[10-11]。乌司他丁组较试验组能明显降低caspase-3表达,提示其可能抑制细胞内依赖caspase的凋亡途径,从而保护肾小管细胞。但仍需进一步观察其对整体肾功能保护作用。
综上所述,心脏手术体外循环后血清通过多种因素导致细胞凋亡,而乌司他丁能广泛抑制多种炎性递质对HK-2细胞的损伤作用,其机制可能与抑制caspase-3表达减少细胞凋亡有关。
1 刘刚,王晶,赵研.乌司他丁对心肺复苏大鼠心功能及心肌组织CD11b、ICAM-1的影响 [J].海南医学院学报,2010,16(4):413-146.
2 Parolari A,Pesce LL,Pacini D,et al.Risk factors for perioperative acute kidney injury after adult cardiac surgery:role of perioperative management[J].Ann Thorac Surg,2012,93(2):584 -591.
3 Wang H,Sun X,Gao F,et al.Effect of ulinastatin on growth inhibition,apoptosis of breast carcinoma cells is related to a decrease in signal conduction of JNk-2 and NF-kappaB [J].J Exp Clin Cancer Res,2012,31(1):2.
4 Inoue K,Takano H.Urinary trypsin inhibitor as a therapeutic option for endotoxin-related inflammatory disorders[J].Expert Opin Investig Drugs,2010,19(4):513-520.
5 Song JE,Kang WS,Kim DK,et al.The effect of ulinastatin on postoperative blood loss in patients undergoing open heart surgery with cardiopulmonary bypass[J].JInt Med Res,2011,39(4):1201-1210.
6 Kumar AB,Suneja M.Cardiopulmonary bypass-associated acute kidney injury[J].Anesthesiology,2011,114(4):964-970.
7 Murphy GJ,Lin H,Coward RJ,et al.An initial evaluation of postcardiopulmonary bypass acute kidney injury in swine[J].Eur J Cardiothorac Surg,2009,36(5):849-855.
8 Bellomo R.Acute renal failure[J].Semin Respir Crit Care Med,2011,32(5):639-650.
9 Vohra HA,Whistance R,Modi A,et al.The inflammatory response to miniaturised extracorporeal circulation:a review of the literature [J].Mediators Inflamm,2009,2009:707042.
10 吴广礼,黄旭东,张丽霞.过度训练可通过破坏Bax/Bcl-2平衡激活caspase依赖的凋亡通路诱导大鼠肾小管上皮细胞凋亡 [J].中华肾脏病杂志,2011,27(2):118-123.
11 杨孟昌,陈玉培,徐茜,等.乳化异氟醚对缺氧/复氧乳鼠心肌细胞的作用及对caspase-3表达的影响 [J].中国全科医学,2009,12(4):625.
