IL-18BP联合泼尼松治疗阿霉素肾病大鼠的实验研究
2012-04-25王丽敏亚瑟尔
王丽敏,亚瑟尔
(佳木斯大学附属第一医院儿科,黑龙江佳木斯 154003)
患有肾病综合征的儿童会有肾小球毛细血管壁渗透性增加的症状,这将导致大量蛋白尿和低蛋白血症。肾病综合征主要是儿科疾病,儿童患病率比成年人多 15倍[1]。虽然任何年龄都有感染的机会,但是儿童时期感染最常见。这一般与个体和(或)家族过敏史有关[2]。肾病综合征的特点是大量的蛋白尿(成人> 3.5g/24h或儿童 40mg/m2˙h,低白蛋白血症 (<2.5g/L),水肿和高脂血症[1]。高脂血症是由于机体代偿性合成蛋白增加导致的结果[3]。微小病变型肾病(MCNS)在患有原发性肾病综合征儿童中是最常见的病理类型[4]。最近,遗传筛选方法支持了 T细胞起到关键作用的说法[5]。在肾病症候群中已有众多 T淋巴细胞因子起源的改变。这些细胞因子的表达异常,包括肿瘤坏死因子(TNF-α),血管渗透性生长因子(V PGF),以及 IL-1,IL-2,IL-4,IL-8,IL-10,IL-12,IL-13和 IL-18[6]。IL-18BP是 IL-18内源竞争性的抑制剂,它可以通过 IL-18的受体结合来有效的抑制生物活性 。它能够抑制由 IL-18引发的 IFN-γ和 IL-8的产生以及 N FKB的体外生产和 LPS诱导的 IFN-γ在体内的生产。因此,我们用阿霉素培养的微小病型肾病鼠模型来观察探讨 IL-18BP和泼尼松联合治疗对阿霉素肾病大鼠蛋白尿的影响及 IL-18BP可能的机制。
1 材料和方法
1.1 实验动物的选择
6周龄 56只健康、雄性 Wistar大鼠,体重(100±20)g,两次尿蛋白定性是阴性,由大连医科大学动物实验中心提供。
1.2 研究方法
1.2.1 分组及模型的制备:56只大鼠适应性喂养一周后,随机选择正常组10只,肾病组46只。注射阿霉素(海正药业有限责任公司,10毫克 /小瓶)根据王峥等人[7]方法,一次性尾静脉注射阿霉素为5mg/kg制备阿霉素肾病大鼠,正常对照组注射等量生理盐水,第 6天,收集所有大鼠尿测24h尿蛋白量。尿蛋白>30mg/24h被视为成功,去除不符合标准4只。其余肾病大鼠 (42只),随机分为4组,肾病模型组 (n=12),强的松治疗组(n=10),IL-18治疗组(n=10),强的松和 IL- 18联合治疗组(n=10)。
1.2.2 实验方法:(1)24h尿蛋白检测:用全自动生化分析仪检测24h尿蛋白定量。(2)血生化检测:用全自动生化分析仪检测血清总胆固醇(TC)、甘油三酯(TG)、总蛋白(TP)、白蛋白 (Alb)、尿素氮 (BUN)、肌酐 (Scr)。(3)用 ELISAKit检测血清 IL-18、IFN-γ和 IL-4水平。(4)给药方法:造模成功后泼尼松组第1~ 7天每天给药 13.5mL/kg(6.3mg/kg)第 8~15天,每天减量 10%,第 16~ 28天每天给药 2.7mL/kg(1.25mg/kg);联合组给予同剂量泼尼松,1h后再加用白细胞介素18结合蛋白(中美生物技术有限公司,北京)0.2mL腹腔注射;白介素18结合蛋白组给予白细胞介素18结合蛋白0.2mL腹腔注射。各组于每天上午 8时开始第1次给药,连续28d。
1.3 统计学方法
采用 SPSS版本17.0软件进行分析和处理数据,测量数据以均数±标准差±s)表示,两组间均值比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 尿蛋白变化
模型组及治疗组24h尿蛋白定量较正常组明显升高,呈现大量蛋白尿 (P<0.01),但联合治疗组与泼尼松组、IL-18BP组相比,尿蛋白明显减少,差异有统计学意义(P< 0.01)。见表 1。
表1 各组大鼠24h尿蛋白水平(±s,mg/24h,n=10)
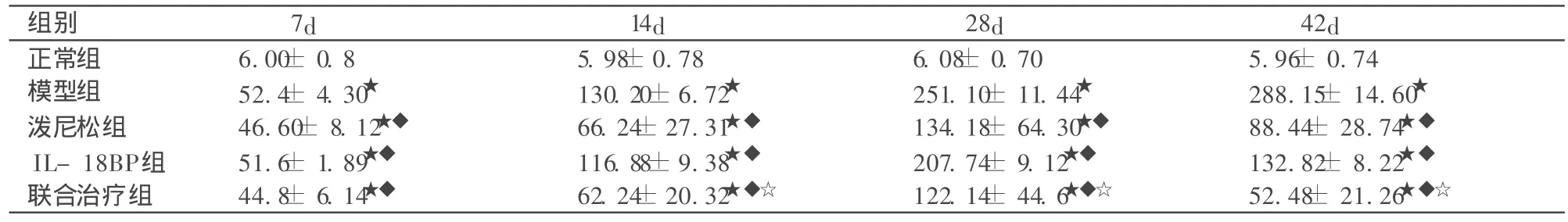
表1 各组大鼠24h尿蛋白水平(±s,mg/24h,n=10)
与正常组比较★P<0.01;与模型组比较◆P<0.01;与泼尼松组、IL-18BP组比较☆P<0.01。
组别 7d 14d 28d 42d正常组 6.00± 0.8 5.98±0.78 6.08± 0.70 5.96± 0.74模型组 52.4± 4.30★ 130.20±6.72★ 251.10± 11.44★ 288.15± 14.60★泼尼松组 46.60± 8.12★◆ 66.24±27.31★◆ 134.18± 64.30★◆ 88.44± 28.74★◆IL-18BP组 51.6± 1.89★◆ 116.88±9.38★◆ 207.74± 9.12★◆ 132.82± 8.22★◆联合治疗组 44.8± 6.14★◆ 62.24±20.32★◆☆ 122.14± 44.6★◆☆ 52.48± 21.26★◆☆
2.2 血生化指标
模型组血清中甘油三酯(TG)、总胆固醇(TC)显著高于正常对照组、治疗组 (P<0.01);白蛋白(ALB)显著低于正常组 (P<0.01);而联合治疗组与泼尼松组、IL-18BP组相比,差异有统计学意义 (P<0.01);尿素氮(BUN)、肌酐(Scr)含量各组间无显著性差异 (P> 0.05)。见表2。
表2 各组大鼠血清 TC,TG,Alb,BUN,SCr水平 (±s,n=10)

表2 各组大鼠血清 TC,TG,Alb,BUN,SCr水平 (±s,n=10)
与正常组比较★P <0.01;与模型组比较◆P<0.01;与泼尼松组、IL-18BP组比较☆P<0.01;BUN和 SCr水平在5组中无明显差异(P> 0.05)。
组别 TC(mmol/L) TG(mmol/L) Alb(g/L) BUN(mmol/L) SCr(μ mol/L)正常组 0.84± 0.19 0.68± 0.08 32.44± 2.56 6.33± 0.01 17.04± 0.88模型组 3.40± 0.74★ 2.20± 0.04★ 20.15± 1.69★ 7.81± 0.14★ 18.77± 1.26★泼尼松组 1.88± 0.32★◆ 2.84± 1.42★◆ 28.86± 3.36★◆ 5.98± 0.42★◆ 16.82± 0.74★◆IL-18BP组 2.16± 0.48★◆ 1.83± 0.24★◆ 27.36± 1.76★◆ 7.74± 0.16★◆ 17.34± 0.62★◆联合治疗组 1.52± 0.60★◆☆ 2.68± 0.82★◆☆ 29.34± 2.64★◆☆ 6.44± 0.36★◆☆ 17.24± 0.86★◆☆
2.3 血清 IL-4水平的表达
模型组各期血清 IL-4水平均有所下降,低于正常对照组、治疗组 (P<0.01)。而联合治疗组与泼尼松组、IL-18BP组相比升高明显,差异有统计学意义 (P<0.01);见表3。
表3 各组大鼠血清 IL-4水平 (±s,pg/mL,n=10)

表3 各组大鼠血清 IL-4水平 (±s,pg/mL,n=10)
与正常组比较★P<0.01;与模型组比较◆P<0.01;与模型组比较▲P> 0.05;与泼尼松组、IL-18BP组比较☆P<0.01。
时间 /分组 正常组 模型组 泼尼松组 IL-18BP组 联合治疗组7d 15.22± 1.44 63.68±3.27★ 68.24± 3.88★◆▲ 68.39± 4.88★◆▲ 70.39± 4.34★◆▲☆14d 14.26± 0.88 62.81±4.31★ 88.42± 4.86★◆ 108.42± 3.54★◆ 114.42± 3.42★◆☆28d 15.49± 1.38 56.18±1.73★ 96.49± 3.42★◆ 112.49± 3.42★◆ 119.49± 4.64★◆☆42d 14.77± 1.32 53.11± 3.61★ 96.86.20± 4.34★◆ 120.20± 4.19★◆ 132.20± 6.13★◆☆
2.4 血清 IL-18、IFN-γ水平的表达
模型组各期血清 IL-18、IFN-γ水平均高于正常对照组、治疗组 (P<0.01)。而联合治疗组与泼尼松组、IL-18BP组相比下降明显,差异有统计学意义 (P<0.01);见表4,5。
表4 各组大鼠血清 IL-18水平(±s,pg/mL,n=10)
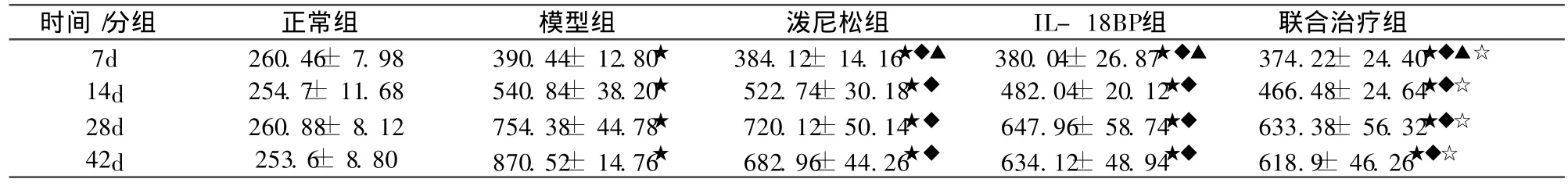
表4 各组大鼠血清 IL-18水平(±s,pg/mL,n=10)
与正常组比较★P<0.01;与模型组比较◆P<0.01;与模型组比较▲P> 0.05;与泼尼松组、IL-18BP组比较☆P<0.01。
时间 /分组 正常组 模型组 泼尼松组 IL-18BP组 联合治疗组7d 260.46± 7.98 390.44± 12.80★ 384.12± 14.16★◆▲ 380.04±26.87★◆▲ 374.22± 24.40★◆▲☆14d 254.7± 11.68 540.84± 38.20★ 522.74±30.18★◆ 482.04± 20.12★◆ 466.48± 24.64★◆☆28d 260.88± 8.12 754.38± 44.78★ 720.12±50.14★◆ 647.96± 58.74★◆ 633.38± 56.32★◆☆42d 253.6± 8.80 870.52± 14.76★ 682.96±44.26★◆ 634.12± 48.94★◆ 618.9± 46.26★◆☆
表5 各组大鼠血清 IFN-γ水平 (±s,pg/mL,n=10)

表5 各组大鼠血清 IFN-γ水平 (±s,pg/mL,n=10)
与正常组比较★P<0.01;与模型组比较◆P<0.01;与模型组比较▲P> 0.05;与泼尼松组、IL-18BP组比较☆P<0.01。
时间 /分组 正常组 模型组 泼尼松组 IL-18BP组 联合治疗组7d 81.45± 3.29 96.45± 3.30★ 96.66± 2.20★◆▲ 98.25±1.33★◆▲ 98.22± 2.10★◆▲☆14d 83.78± 4.35 115.66± 4.99★ 112.96± 3.40★◆▲ 102.84± 2.56★◆ 100.82± 3.2456★◆☆28d 85.66± 4.46 126.18± 15.85★ 120.14± 6.34★◆ 108.04± 3.28★◆ 106.84± 3.30★◆☆42d 85.41± 2.23 131.17±5.33★ 124.45±4.62★◆ 103.38± 4.86★◆ 99.14± 2.04★◆☆
3 讨论
微小变化肾病综合征的显著的临床特点之一是蛋白尿,它在肾脏疾病的进展中起着重要的作用。长期的尿蛋白可以引起肾小管损伤,进一步引起肾脏损害。儿童 PN S的发病机制迄今仍未明确,因此,研究蛋白尿的机制对微小病变型肾病综合征的诊断和治疗起着至关重要的作用。白细胞介素18(IL-18)是一种新发现的炎症因子,并与辅助性 T淋巴细胞亚群的相关性已经得到更多的关注。白细胞介素18(IL-18)开始时是当做干扰素 γ(IFN-γ)的引导因子 (IGIF)被发现的[8]。此外,在 IL-12的协同下,IL-18会生产干扰素γ并且使 T细胞增殖[9]。与 T细胞相似,NK细胞也可以被 IL-18[10]激活从而激增。具体来说,IL-18可以介导 N K细胞的细胞毒作用[11],IL-18介导的免疫反应不仅克服病毒,细菌和真菌感染,而且还可以通过激活免疫细胞抵制病原感染。在其他功能上 IL- 18类似于 IL-1,现已被归类在 IL-1系列中的促炎性细胞因子。最近的研究还显示出,在患有微小病变型肾病的患者的血液和尿液里,IL-18的水平不断上升,这表示 IL-18在微小病型肾病的发病机制中发挥重要作用。既往研究发现 IL-18和 IFN-γ的异常表达与蛋白尿的发生、发展密切相关。另有研究发现,PN S时存在 Th1/Th2细胞和 /或 Th1/Th2类细胞因子分泌失衡。其中 Th1类细胞主要参与细胞免疫或迟发性超敏反应;Th2类细胞主要参与体液免疫。IL-18及以 Th1型为主的免疫失衡在 MCNS发病机制中起重要作用,这有可能成为 MCNS治疗的新途径[12]。
IL-18BP是一个具有高亲和力特异性结合和拮抗 IL-18相关的蛋白因子。本实验通过对阿霉素诱导的微小病变肾病,应用 rmIL-18BP治疗后,IL-4水平显着增加,表明rmIL-18BP应用能够抑制辅助性 T细胞前体的 Th1向 Th2方向转化,促进 Th1/Th2平衡,抑制或中和内源性 IL-18的释放和活动,减少各种促炎症因子在肾脏积累,从而降低蛋白质的滤过,减少内源性 IL-18导致的微小病变肾病的进一步发展。我们的研究表明各组大鼠尿蛋白、血清 IL-18、IFN-γ明显高于对照组 (P<0.01);而泼尼松与 IL-18BP治疗组分别可降低 IFN-γ和 IL-18水平 (P<0.01),但联合治疗组降低 IFN-γ和 IL-18水平更明显,与单一治疗组比较差异有显著性 (P<0.01),说明 IL-18BP与泼尼松联合治疗组明显优于两者单一治疗组,IL-18和 IFN-γ在肾病进展中起重要作用,IL-18BP可能通过降低 IL-18和 IFN-γ而发挥治疗作用,因此可能成为微小病变肾病治疗的新途径。
[1]Behrman RE,Kliegman R,Jenson HB.Nelson Textbook of Pediatrics[M].18thed p.2190.Philadelphia,PA:WB Saunders Company,2007
[2]Meadow SR,Sarsfield JK.Steroid-responsive nephritic syndrome and allergy:clinical studies[J].Arch Dis Child,1981,56:509-516
[3]Wheeler DC,Bernard DB.Lipid abnormalities in the nephrotic syndrome: causes,consequences,and treatment[J].Am J Kidney Dis,1994,23:331-346
[4]Shalhoub RJ.Pathogenesis of lipoid nephrosis:a disorderof T-cell function[J].Lancet,1974,2:556
[5]Audard V,Grimbert P,Valanciuté A,et al.Recent approaches to the pathogenesis of minimal change nephritic syndrome[J].Nephrologie,2002,23:367-369
[6]Van den Berg JG,Weening JJ.Role of the immune system in the pathogenesis of idiopathic nephrotic syndrome[J].Clin Sci,2004,107:125
[7]王峥,王增贵,刘震,等.多柔比星诱发大鼠肾病模型的实验研究[J].华西医科大学学报,1990,21(4):430-432
[8]Okamura H,Tsutsi H,Komatsu T,et al.Cloning of a new cytokine that induces IFN-γ production by T cells[J].Nature,1995,378:88-91
[9]Tominaga K,Yoshimoto T,Torigoe K,et al.IL-12synergizes with IL-18 or IL-1 β for IFN-γproduction from human T cells[J].Int Immunol,2000,12:151-160
[10]Tomura M,Zhou XY,Maruo S,et al.A critical role for IL-18 in the proliferation and activation of N K1.1+ CD-3cells[J].J Immunol,1998,160:4738-4746
[11]Hyodo Y,Matsui K,Hayashi N,et al.IL-18 up- regulates perforin-mediated NK activity without increasing perforin messenger RN A expression by binding to constitutively expressed IL-18 receptor[J].J Immunol,1999,162:1662-1668
[12]王丽敏,张静,罗巧华.多柔比星肾病大鼠 IL-18、IFN-γ及IL-4的表达及意义 [J].黑龙江医药科学,2011,34(3):66-67
