大鼠脑组织中甲状腺素受体THRα1的表达与阿尔茨海默病的发病机制
2012-04-20颉宾芳孙雯雯刘卉王佳冰刘昕
颉宾芳孙雯雯刘卉王佳冰刘昕
·论 著·
大鼠脑组织中甲状腺素受体THRα1的表达与阿尔茨海默病的发病机制
颉宾芳*孙雯雯*刘卉△王佳冰*刘昕*
目的观察大鼠大脑皮层和海马区脑组织中甲状腺素受体THRα1的表达与阿尔茨海默病发生的相关性并对其机制进行初步探讨。方法SD大鼠腹腔注射D-半乳糖50 mg·(kg·d)-1,复制阿尔茨海默病动物模型,另设正常对照组,腹腔注射等量生理盐水。连续给药6周后观察动物精神状态、活动情况等;取大脑皮层和海马区组织制作病理切片,光镜下观察其形态学变化;分别用实时荧光定量PCR(FQ-PCR)法和Westernblot法检测阿尔茨海默病动物与正常大鼠脑组织中THRα1、CDK-5及p35 mRNA的差异性表达和pser404-tau蛋白的表达水平。结果与正常对照组相比,阿尔茨海默病模型组动物神情呆滞,反应迟钝,镜下见大脑皮层及海马区神经元排列紊乱,核浓染、固缩,神经元轴突染色较深呈拖尾状,形成神经元纤维缠结,尤以海马区表现更为显著。与对照组相比,模型组皮层区THRα1、CDK-51和p35 mRNA表达量增加,分别为 (1.20±0.30)、(4.71±0.54)、(2.11±0.40),差异有统计学意义(P<0.05);模型组海马区三者的表达量分别为(2.53±0.65)、(18.51±2.7)、(5.96±0.49),与对照组相比亦有统计学差异(P<0.05)。模型组pser404-tau蛋白呈高表达状态,与正常对照组相比P<0.05。结论大脑皮层及海马区脑组织中THRα1 mRNA的过表达及由此而加剧的神经细胞tau蛋白磷酸化可能参与或促进了大鼠阿尔茨海默病的发生发展。
甲状腺素受体α1 阿尔茨海默病 Tau蛋白磷酸化 细胞周期素依赖性蛋白激酶5
阿尔茨海默病((Alzheimer disease,AD)是老年人最常见的神经系统退行性疾病,发病机制迄今尚未阐明[1-3]。THRα1是脑组织中表达最多的甲状腺素受体(thyroid hormone receptor,THR)[4-5]。当甲状腺素与之结合后,通过甲状腺素反应元件(thyroid hormone response elements,TRE)调控靶基因的表达[4],而与脑组织tau蛋白磷酸化水平密切相关的细胞周期素依赖性蛋白激酶5(cyclin-dependent kinase5,CDK-5)即其靶基因之一。近年有关甲状腺激素水平与AD认知功能损害间关系的研究已有部分报道[6-8];但THRα1及CDK-5在脑组织中表达水平的变化是否与AD发生有关尚未见相关报道。本实验拟就此作初步研究。
1 材料
1.1 动物雄性健康SD大鼠40只,体重180~220 g,由湖南斯莱克有限公司实验动物中心提供(动物许可证号:HNASLKG20100293)。大鼠随机分笼饲养,自由摄食与饮水,室温20~22℃,维持每日光照12 h。标准鼠饲料由兰州大学实验动物中心提供。
1.2 方法
1.2.1 AD动物模型的复制 依随机数字表法将大鼠分为AD模型组和正常对照组,每组20只。AD模型组腹腔注射D-半乳糖溶液50 mg·(kg·d)-1[9],正常对照组注射等体积生理盐水,连续6周,每周称重1次,依据末次称重的克数调整给药剂量。期间观察动物一般状况,如精神、活动、毛发、饮食等。
1.2.2 脑组织取材及病理切片制作 实验6周之后,水合氯醛麻醉大鼠,迅速开胸暴露心脏,经左心室灌注4℃生理盐水100 mL快速冲洗,再以预冷的4%中性多聚甲醛灌注,后迅速断头取出大脑皮层及海马组织,随机自每组中各取8只制成病理切片,进行HE染色10和改良Bicschowsky染色11,用以观察脑组织中老年斑、神经原纤维缠结及神经元数量、体积、排列状况等形态学变化。剩余组织冷冻于-80℃,用以检测THRa1、CDK-5和p35 mRNA的表达及pser404-tau蛋白的表达。
1.2.3 大脑皮层及海马组织中THRa1、CDK-5和p35 mRNA表达的检测
1.2.3.1 RNA的提取及cDNA的合成 取皮层及海马部位脑组织各100 mg,按照Trizol Reagent说明书提取总RNA,采用紫外分光光度法对其定量。按M-MuLV First Stand CDNA合成试剂盒说明取2 μL(8 μg)总RNA作为模板,反转录为cDNA,-20℃保存。
1.2.3.2 RT-PCR Primer6软件设计各引物序列,由上海生工生物工程技术服务有限公司合成。THRa1:上游5′-CGGAATCAGTGCCAGTTGTGC-3′,下游5′-AGGAGTGGGCTCTGGTCGTTG-3′,扩增片段长度177 bp;CDK-5:上游5′-AGCCTTTGGTATCCCAGTCC-3′,下游5′-CAGTCGGTGTCCCT AGCAGT-3′,扩增片段长度224 bp;p35:上游5′-GAAGCGGCACTCCATCATCT-3′,下游5′-GGACA GGTTGGCACACGACAG-3′,扩增片段长度166 bp。设β-actin为内参照。2%琼脂糖电泳观察PCR结果。
1.2.3.3 SYBR Green FQ-PCR 按试剂盒说明设置反应参数,检测各目的基因mRNA表达量,每样本设3个平行,溶解曲线程序:94℃10 s,60℃30 s,从67℃~99℃自动绘制溶解曲线图。实验重复3遍。
1.2.4 pser404-tau蛋白表达检测 取海马组织100 mg,采用Western-blot法进行检测,依次加入一抗和辣根过氧化物酶标记的IgG二抗,最后以ECL超敏发光液显影成像分析。pser404-tau蛋白表达水平用目的蛋白条带分别与内参照β-actin条带灰度值之比标示,采用Image-Proplus软件分析。
1.3 统计学方法采用SPSS 17.0进行统计分析,计量资料以(x±s)表示,两两组间比较用t检验,检验水准α=0.05。
2 结果
2.1 一般情况在清醒状态下,正常对照组大鼠精神饱满,反应敏捷,皮毛光洁;而模型组动物随着造模时间的延长,逐渐出现精神差,神情呆滞,反应迟钝,活动减少,被毛无光泽,晦暗不顺,食欲减退等。
2.2 脑组织形态学变化
2.2.1 HE染色 正常对照组神经元排列规则整齐,形态完整;细胞核大而圆,着色较浅,位于细胞中央。胶质细胞的形态亦正常。AD模型组皮质及海马区神经元细胞数目减少,细胞排列松散、紊乱,在变性坏死神经元周围出现散在的粉红色斑块样淀粉样蛋白(图1)。
2.2.2 改良Bicschowsky染色法 正常对照组海马结构和神经元形态正常,细胞体未着色,轴突呈棕褐色,神经元纤维排列规则整齐、紧密、形态完整。AD模型组皮层及海马区神经元排列散乱,细胞内神经原纤维增粗,可见较多胞体和轴突染色较深的神经元成拖尾状,形成NFT(图2)。
2.3 THRα1、CDK-5和p35 mRNA的表达琼脂糖凝胶电泳示各基因扩增条带单一、无杂带,大小与预计相符,THRα1、CDK-5、p35、β-actin分别为177、224、166、200 bp(图3);SYBR Green FQ-PCR扩增曲线平滑,各基因均有明显的指数扩增期(图4)。设正常对照组各基因mRNA表达量为1,模型组皮层区THRα1、CDK-5、p35 mRNA表达量分别为正常对照组的 (1.20±0.30)、(4.71±0.54)、(2.11±0.40),与正常对照组相比,有统计学差异(*P<0.05);模型组海马区THRα1、CDK-5、p35 mRNA表达量分别为正常对照组的 (2.53±0.65)、(18.51±2.77)、(5.96±0.49),与模型组皮层区比较,有统计学差异(**P<0.05)(图5)。
2.4 Western-blot检测pser404-tau表达设正常对照组pser404-tau表达为1,与正常对照组相比较,模型组海马区tau蛋白磷酸化位点丝氨酸404磷酸化水平增加至(1.20±0.05),有统计学意义(P<0.05)(图6,图7)。
3 讨论
阿尔茨海默病的主要表现是认知与记忆功能逐渐恶化及继之而来的各种精神症状和行为障碍,海马作为大脑学习记忆的关键部位是AD最早和最易受损的部位。AD的特征性病理变化:一是出现以β-淀粉样蛋白为主体的老年斑(SP);二是大脑皮质及海马神经元出现大量神经原纤维缠结(NFT),主要成分是高度磷酸化的tau蛋白;三是海马锥体细胞颗粒空泡变性和胆碱能神经损伤、神经元缺失等[12-13],目前的研究多关注于各种原因引起的脑组织中SP形成在AD发生发展中的作用,而细胞内tau蛋白的过度磷酸化导致的NFT亦是AD发生的最重要变化之一。本实验采用腹腔注射D-半乳糖法复制AD动物模型,显微镜下观察皮层及海马区神经元病理形态学变化,除见到细胞排列散乱,数量减少,细胞核固缩浓染及在变性坏死神经元周围有散在的粉红色斑块样淀粉样蛋白即SP形成等变化之外,实验还观察到在皮层和海马区脑组织中有神经元纤维增粗、排列紊乱呈拖尾状等变化,即有NFT的形成。
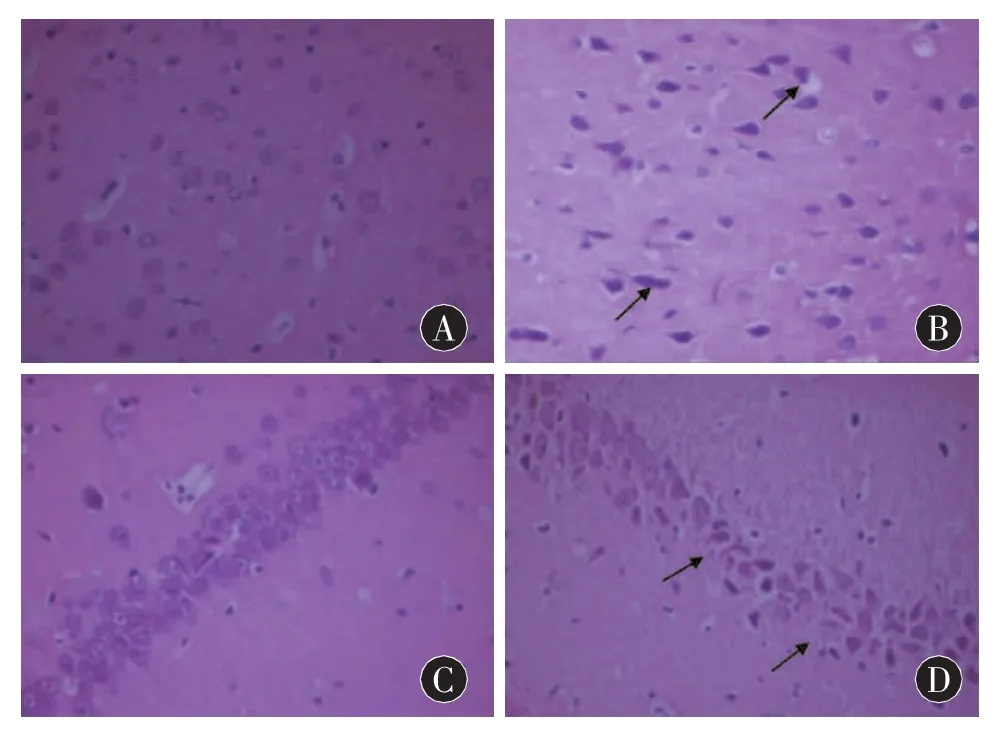
图1 脑组织形态学变化(HE,400×)A:正常组皮层区;B:模型组皮层区;C:正常组海马区;D:模型组海马区(箭头所示:皮层及海马区神经元排列散在、紊乱,神经元数目减少,可见大面积的核固缩、核浓染)
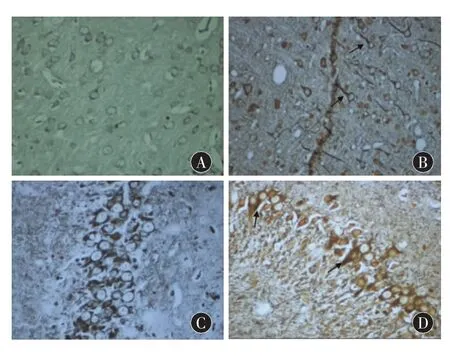
图2 脑组织形态学变化(银染,400×)A:正常组皮层区;B:模型组皮层区;C:正常组海马区;D:模型组海马区 (箭头所示:皮层及海马区神经元细胞内神经元纤维增粗、排列紊乱成拖尾状,形成NFT)
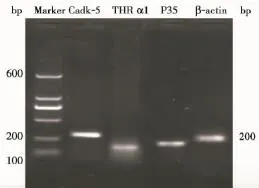
图3 RT-PCR示TRα1、CDK-5、p35、β-actin扩增产物
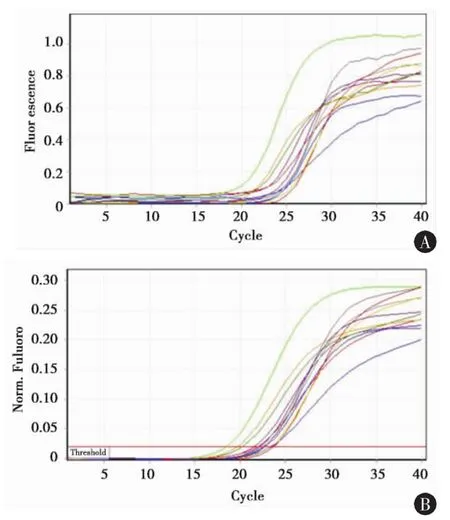
图4 SYBR Green实时荧光定量PCR扩增曲线
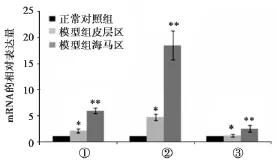
图5 各基因mRNA相对表达量①P35;②CDK-5;③THRα1注:与正常对照组比较,*P<0.05,**P<0.05

图6 Western-blot X-光照片①正常对照组;②:模型组
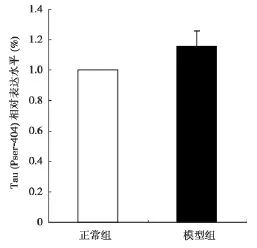
图7 Western blot检测各组大鼠海马区 Pser404-tau表达水平(P<0.05 vs正常组)
THRα有THRal及THRa2两类异构体,后者为甲状腺素的非功能受体[14-15]。脑内THRα1占全部受体的70~80%,是甲状腺素的主要功能型受体,参与细胞迁移、髓鞘形成、神经元分化等[16]。本实验观察到AD动物大脑皮层及海马区域THRal表达显著高于正常对照组大鼠。同时检测到CDK-5亦呈高表达状态。已证明在CDK-5启动子区分子结构中存在甲状腺素反应元件。甲状腺素-受体二聚体可与之特异性结合影响其下游基因转录。CDK-5是tau蛋白磷酸化的关键激酶,参与了分裂后神经元的靶蛋白磷酸化[17-19]。CDK-5激酶活性依赖于特定的调节亚基p35。故实验尚对比了AD模型组与正常组大鼠大脑皮层和海马中p35 mRNA 及pser404-tau蛋白的表达。结果显示,AD模型组大鼠的海马及皮层区 THRα1、CDK-5和 p35 mRNA,pser404-tau蛋白表达水平较正常对照组均有显著提高,尤其是海马区。因而,根据实验结果是否可以推测,由于THRα1的异常表达,通过CDK-5分子结构中的TRE,促进了CDK-5 mRNA的表达,在调节亚基p35的调节下CDK-5激酶活性大大增强,促进了的tau蛋白过度磷酸化,神经细胞内异常聚集形成神经原纤维缠结,导致微管稳定性降低,破坏、解聚,造成神经元的功能紊乱和退行性变,最终引起痴呆的发生。
[1] 彭丹涛,许贤豪.轻度认知损害向老年性痴呆转化的临床研究[J].中华神经科杂志,2007,40(6):418-421.
[2]Selina W, Wendy N.Linking Amyloid and Tau Pathology in Alzheimer′s Disease:The Role of Membrane Cholesterol in Aβ-Mediated Tau Toxicity[J].The Journal of Neuroscience,2009,29(31):9665-9667.
[3]Selkoe DJ.Alzheimer′s disease:genes,proteins,and therapy [J].Physiol Rev,2001,81(2):741-66.
[4] 柳明波,孙蓓,张镜宇.甲状腺激素受体研究进展[J].国际内分泌代谢杂志,2007,27(z1):56-58.
[5]Flamant F,Gauthier K,Samarut J.Thyroid hormones signaling is getting more complex:STORMs are coming[J].Mol Endocrinol,2007,21(2):321-333.
[6]van den Beld AW,Visser TJ,Feelders RA,et al.Thyroid hormones concentrations,disease,physical function,and mortality in elderly men[J].J Clin Endocrinol Metab,2005,90 (12):6403-6409.
[7]Ahmed OM,El-Gareib.Thyroid hormones states and brain development interactions[J].Int.J.Dev.Neurosci,2008,26(2):147-209.
[8]de Jong FJ, den Heijer T, Visser TJ, et al.Thyroid hormones,dementia,and atrophy of the medial temporal lobe[J].J Clin Endocrlnol Metab,2006,91(7):2569-2573.
[9] 彭友瑞,钟方旭,杨博,等.蜂王浆对D-半乳糖衰老模型大鼠学习记忆行为的影响[J].食品科学,2011,8(15):269-271.
[10]刘春喜,黄耀德,刘文超,等.双侧内嗅皮质注射13淀粉样蛋白对大鼠学习记忆能力的影响及局部病理改变[J].中国行为医学科学,2008,17(17):594-596.
[11]邓娟,王延江,张猛,等.吸烟对阿尔茨海默病大鼠认知功能和海马神经元病理变化的影响[J].中华老年心脑血管病杂志,2011,13(1):72-74.
[12]方传勤,李敬诚,许志强,等.高胆固醇对AD大鼠海马神经元缺失和Tau蛋白异常磷酸化的影响[J].中华神经科杂志,2009,8(4):359-362.
[13]Eichenbaum H.How does the hippocampus contribute to memory?[J].Trends Cogn Sci,2003,7(10):427-429.
[14]令亚琴,刘昕,令晓玲,等.甲状腺素受体β1在胃癌组织中的表达及其意义[J].中华肿瘤防治杂志,2006,13(2):124-126.
[15]刘春蓉,李兰英,刘奔,等.甲状腺激素受体mRNA在脑发育过程中的表达变化[J].中国地方病学杂志,2003,22(z1):114-117.
[16]武要洪,孙传政.甲状腺素受体与肿瘤的关系研究进展[J].实用癌症杂志,2009,24(6):675-677.
[17]才晓慧,方敏,李伟,等.鼠脑发育过程中 Cdk5激活剂一p39 mRNA的表达[J].中华神经医学杂志,2008,7(8):771-773.
[18]李培培,张丽丽,李敏.Cdk5在突触可塑性和学习记忆中的作用[J].中国神经精神疾病杂志,2009,35(3):188-190.
[19]黄天文,陈晓春.p25/cdk5可能参与人参皂苷Rb1减轻Aβ25-35诱导的tau蛋白过度磷酸化[J].中国药理学通报,2006,22(6):688-692.
An experimental study on the expression of THRα1 in brain tissues in a rat model of Alzheimer’s disease.
XIE Binfang,SUN Wenwen,LIU Hui,WANG Jiabing,LIU Xin.Deparentment of Pathology and Pathophysiology,Basic Medical Science of Lanzhou University,LanZhou 730000,China.Tel:0931-8915023.
ObjectiveTo study the role of thyroid receptor α1(THRα1)in brain tissues in Alzheimer’s disease (AD).MethodsD-galactose 50 mg·(kg·d)-1was administered by intraperitoneal injection into SD rats to create AD model.Control animals received intraperitoneal injection of the same amount of saline.The mental status and activities were then evaluated six weeks after treatment.Histological analysis was used to examine the morphological changes in the cerebral cortex and hippocampus.Real-time fluorescence quantitative PCR and Western-blot were used to detect the mRNA expression of THRα1,CDK-5 and p35 and protein expression of pser404-tau,respectively.ResultsCompared with control group,AD rats looked sluggish and were unresponsive.In the brain,particularly the hippocampus of AD rats,the neuronal arrangements were disorganized,nuclei were shrunk,and neuronal axons were deeply stained in a tail-like shape, forming neurofibrillary tangles.In AD rats, the mRNA expression levels of THRα1,CDK-5 and p35 were higher in the cortex and hippocampus.In addition,the expression level of pser404-tau protein was significantly higher in AD rats than in control rats(P<0.05).ConclusionsThe high level of THR α1 mRNA expression and phosphorylation of protein tau in neurons of the cortex and hippocampus may contribute to the pathological process of AD in rats.
Thyroid hormone receptorα1 Alzheimer's disease Tau phosphorylation CDK-5
R749.1
A
2011-10-31)
(责任编辑:李立)
10.3969/j.issn.1002-0152.2012.09.005
* 兰州大学基础医学院病理生理学研究所(兰州 730000)△甘肃省中医学院附属医院
