不同模式低氧及递增负荷训练对心肌肌球蛋白重链表达的影响
2012-04-13郝选明肖国强
阮 凌,郝选明,肖国强
(华南师范大学体育科学学院,广东广州510006)
高住低练和间歇低氧训练,目前已被作为两种经典的低氧训练的模式,大量的研究表明机体缺氧可以刺激产生一系列抗氧化反应[1],如心脏重量增加,左右心室壁增厚及心肌的生理性重塑等。心肌肌球蛋白由2条重链(MHC)和4条轻链(ML C)构成六聚体,是心脏的主要收缩蛋白之一。其中重链分别是α-MHC和β-MHC,虽然两者在结构上具有高度同源性,但它们在功能上差异很大。目前对于低氧及低氧训练对于心肌及其机能的影响尚未探明。本文主要通过两种不同模式低氧训练对于心肌肌球蛋白、心脏壁厚度及其相关指标之间的影响,寻找出两种模式低氧训练之间的区别和联系,并且为个性化低氧训练可提供一定的理论依据。
1 实验对象与方法
1.1 实验对象与分组
选用S D纯种雄性大鼠48只(购于中山医科大学实验动物中心),2月龄,体重为193.09g±8.10g。分笼饲养,以国家标准啮齿类动物饲料喂养,自由饮食,室内空气流通,相对湿度60%±10%,温度23℃±2℃。训练期间生活习性和饲养等各种条件均严格控制。在实验室适应3天后随机分为:常氧安静组、常氧运动组、间歇低氧对照组、间歇低氧训练组、高住低练对照组、高住低练组,每组8只。
1.2 实验安排
1.2.1 各组训练安排。①常氧安静组:正常进食,自由饮水不进行任何训练活动;②常氧运动组:正常进食,自由饮水进行有氧耐力训练;③间歇低氧对照组:低氧组在低氧帐篷中进行间歇低氧训练(I HT),每周3次,隔天1次,周日休息,每次1h(1个组合为5m i n低氧、5m i n间歇,共6个组合)。第1周氧的浓度为14%,第2周开始氧浓度由14%~11%逐周递减,每周递减1%[2];④间歇性低氧训练组:低氧训练模式同间歇低氧对照组,每次低氧训练后即刻进行有氧耐力训练;⑤高住低练对照组:每周3次,隔天1次,周日休息。大鼠晚8时进入低氧帐篷内,次日晨8时,出低氧帐篷,每次低氧刺激12h。低氧仪每次使用前都正常调零,并设定正常氧浓度为20.9%进行监测,低氧帐篷内的氧浓度控制在15.3%,使帐篷内形成常压低氧环境,模拟海拔高度相当于2500m[3];⑥高住低练组:低氧刺激模式同高住低练对照组,附加每次低氧训练后即刻进行有氧耐力训练。
1.2.2 运动模式。运动组用国产鼠类电动跑台进行训练,速度15m/m i n,每次30m i n,使动物熟悉跑台运动,1周后开始逐周递增负荷,每周增加速度5m/m i n,增加时间10m i n;最后1周速度达到30m/m i n,时间达60m i n。训练至4周结束[4]。
1.3 方法及测试指标
1.3.1 取材。最后一次运动即刻取材,大鼠称重(BW),0.03%的戊巴比妥钠麻醉(3m g/100g大鼠),开胸分离心脏,进行心脏称重后立刻置于冰冷的生理盐水中,去掉心房,分离右心室游离缘(R V)和左心室(包括室间隔,L V),测量左右心室重量及各室壁的厚度,称重后放入-80℃液氮中。
1.3.2提取和样品处理。心肌肌球蛋白分析的样品处理参照[5]方法改进:将-80℃冻存左、右心室心肌各取约10m g,加入缓冲液,玻璃匀浆器匀浆,按1∶500(组织与缓冲液比例w/v)加入缓冲液稀释,上样前样品加热到100℃孵育5m i n。每个泳道2-5u l。
1.3.3 制胶和电泳。参照方法[6,7]分离心肌MHC的采用10%甘油S D S-P AG E胶(见试剂配制)。先制作分离胶,后制作积层胶(具体操作方法步骤同分子克隆S D S-P AG E),电泳缓冲液分别按试剂配制的方案,在4℃的恒温水中恒压14V/c m电泳(恒压200V,52h)。
1.3.4 染色脱色和观察分析。电泳完毕,小心取下胶,考马斯亮蓝R 250染色6h,脱色5h。用生物电泳图像分析系统照相,用S MA R T V I EW ANA L Y S I S P R O G R AM分析软件处理分析,用S MA R T V I EW ANA L Y S I S P R O G R AM分析软件处理分析,胶用干胶机真空60℃干燥2h后保存。
1.4 统计处理
所有数据均用E X C E L、S P S S 15.0软件包进行统计处理,实验结果以±s表示,并以P<0.05作为显著性水平,P<0.01作为非常显著性水平。实验数据自身前后比较,采用单因素方差分析t检验。
2.1 心脏重量及左右心室重量变化结果
2 实验结果
常氧运动组左右心室及心脏重量均高于安静组;两低氧运动组均高于低氧组;间歇低氧组高于其它各组且存在显著性差异(P<0.05);低氧组左心室重量均高于右心室的重量,具有一定的差异性;间歇低氧组较其他各组各指标均具有显著性差异(P<0.05);
2.2 心脏重量及左右心室壁厚度变化结果
表1 不同模式下心脏重量及左右心室重量的对比分析(±s)

表1 不同模式下心脏重量及左右心室重量的对比分析(±s)
左心室重量 右心室重量 心脏重量常氧安静组0.56±0.070.57±0.120.93±0.11常氧运动组 0.57±0.070.59±0.090.96±0.11间歇低氧组0.69±0.08*0.62±0.22*1.04±0.15*间歇低氧运动组 0.71±0.09△□0.66±0.510.97±0.12高住组 0.61±0.320.58±0.050.96±0.13高住低练组 0.70±0.110.65±0.31*0.99±0.10*
与安静对照组比较:1)*P<0.05,2)△P<0.01;与运动组比较,3)**P<0.05,4)△△P<0.01两种低氧组比较5)□P<0.05,表2同
表2 不同模式下心脏左右心室壁厚度的对比分析±s)

表2 不同模式下心脏左右心室壁厚度的对比分析±s)
0.51±0.12 0.52±0.23常氧运动组 0.53±0.33△ 0.52±0.19△间歇低氧组 0.77±0.19**□ 0.72±0.56**□间歇低氧运动组 0.88±0.32△△□ 0.86±0.35△△□高住组 0.68±0.31 0.67±0.18高住低练组 0.72±0.47* 0.71±0.37左心室厚度 右心室厚度常氧对照组**
常氧运动组左右心室壁厚度均高于安静组;两低氧运动组高于低氧组,且存在非常显著性差异(P<0.01),高住组和高住低练组均低于间歇低氧组及间歇低氧运动组且存在显著性差异(P<0.05);间歇低氧运动组高于间歇低氧组且存在非常显著性差异(P<0.01);
2.3 左、右心室α-MHC和β-MHC变化结果
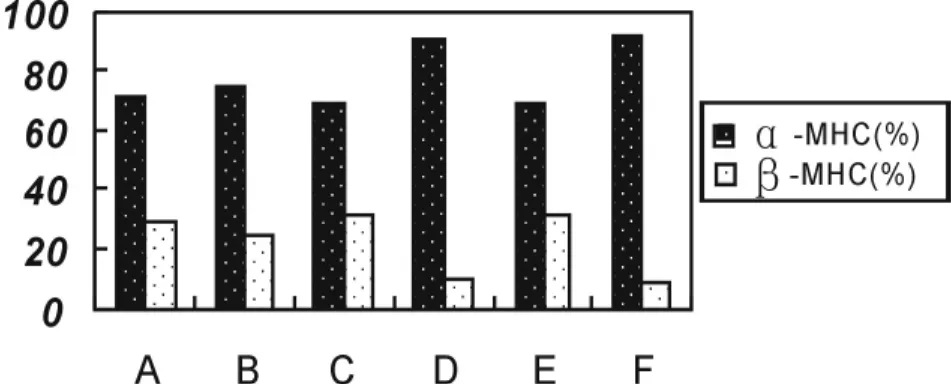
图1 左心室心肌MHC比例%

图2 右心室心肌MHC比例%

图3 电泳凝胶图:心肌MHC异构体表达
运动组左、右心室的α-MHC的比例相对于安静组低,无显著性差异,两个单纯低氧组与常氧组相比均出现α-MHC比例减小,而β-MHC比例增加,且具有显著性差异(P<0.05),而间歇低氧运动组和高住低练组左、右心室变化呈现出β-MHC大幅度向α-MHC转换、且具有非常显著性差异(P<0.01),高住低练组变化趋势高于间歇低氧运动组,存在显著性差异(P<0.05)。
表3 左、右心室α-MHC和β-MHC的变化结果(±s)

表3 左、右心室α-MHC和β-MHC的变化结果(±s)
与运动组比较:1)*P<0.05;2)△P<0.01,两种低氧组比较3)□P<0.05
R V α-MHC(%) β-MHC(%)L V α-MHC(%) β-MHC(%)常氧安静组(A) 57.12±11.78 42.88±11.78 71.02±12.03 28.98±12.03常氧运动组(B) 58.33±10.24 41.67±10.24 75.06±20.98 24.94±20.98间歇低氧组(C) 52.53±16.21* 47.47±16.21 68.03±16.79* 31.97±16.79间歇低氧运动组(D) 89.71±13.52△ 10.29±13.52 90.66±8.92△ 9.34±8.92高住组(E) 55.03±8.87*□ 45.97±8.87 69.71±7.17*□ 30.29±7.71高住低练组(F) 91.67±7.53△□ 8.33±7.53 91.33±15.12△□8.67±15.12
3 分析讨论
本实验采用间歇低氧和高住低练两种低氧模式进行训练;间歇性低氧训练(I HT)是利用可调控氧浓度的低氧制造仪,产生常压低氧气体,间歇性吸入低氧,造成体内适度缺氧,从而达到模拟高原训练的目的。高住低练(H i L o),是指居住在相当于2500m左右高度的缺氧环境中,而训练则在正常氧浓度环境下进行。四周低氧训练结束后,于最后一次运动即刻取材,称量心脏重量、心室壁厚度并利用电泳技术(S D S-P AG E)分离心肌肌球蛋白重链观察其比例变化。研究表明低氧及运动都可以改变MHC异构体组成,而不同模式的低氧训练对于改变MHC的研究报道尚未见到。
心肌表达两种MHC基因,分别为α-MHC和β-MHC。肌球蛋白以α-MHC为主,收缩力强,但失去增生能力。胚胎期心肌细胞肌球蛋白以β-MHC为主,收缩能力差,但具有增生力。虽然α-MHC和β-MHC在结构上具有高度同源性,但它们在功能上差异很大。α-MHC的A T P酶活性高,收缩速度快,但耗能量大;相反β-MHC的A T P酶活性低,收缩速度缓慢而持久且耗能小。本实验研究结果显示:运动组心脏重量、左右心室壁厚度均高于安静组这与前人研究一致;左心室壁厚度增加较右心室明显,这与左心室射血有关,运动组α-MHC比例增加,β-MHC减少,但幅度不大;这与S c h u等人[6]研究一致:给9和16个月龄有自发性高血压的大鼠进行低强度的踏车运动,持续6个月后发现,与对照组相比,低强度的踏延缓了α-MHC向β-MHC转换;A d v a n i S V等人为排除血流动力学的影响,采用异体心脏移植于腹主动脉的大鼠动物模型研究发现,游泳运动不但明显提高原位心脏心肌α-MHC含量,而且还可阻止移植心脏心肌α-MHC减少[7]运动引起心肌肥大的发生是心肌细胞从“胚胎表型”向“收缩表型”的转变的重塑过程,即α-MHC表达增加、β-MHC减少属“生理性心肌重塑”,肌球蛋白A T P酶活性增加,提高心肌纤维的收缩速度和能量利用率,是心脏功能增强的表现。
单纯低氧组心脏重量高于运动组无显著性差异,左右心室壁厚度高于运动组,且具有显著性差异(P<0.05),两低氧组比较,I HT增加更为明显,李强等研究发现I HT对健康成年人心血管机能的影响,结果显示“I HT”5天后心搏量增加,心输出量、心搏指数、心脏指数等也有明显增加[8]。这可能与I HT氧浓度低,刺激时间短,而通过H i L o训练氧浓度较高,低氧时间长,因此心室壁的厚度和心脏重量变化没有I HT大。“H i L o”训练法可对心脏功能产生有益影响。表现为左心室收缩分数和射血分数增加,每搏输出量和心输出量明显增加。“H i L o”训练法是通过改变左心室的收缩性而增强了心脏收缩功能[9]。在一定的缺氧条件下,心肌β-MHC mR NA和蛋白表达增加,而α-MHC表达降低,表现出由α-MHC向β-MHC的转换。这种MHC异构体比例的改变与长期缺氧引起的心室重量增加显著相关。心肌收缩蛋白由α-MHC向β-MHC转化的意义尚不完全清楚。有的学者认为[10,11],长期缺氧条件下,心肌线粒体有氧代谢产能减少,不能满足肥大心肌收缩功能的能量需求,因此,β-MHC比例相对增加,心肌耗能减少,有利于提高心肌能量利用效率。另一些学者则认为,当心肌因负荷过重的刺激而肥厚时,为了加速蛋白合成,合成的新蛋白即β-MHC是胚胎型异构蛋白,寿命较短,易衰竭,从而加速了心肌的疲乏和衰竭。但这种代偿性适应导致心肌收缩速度和输出功率下降,可能会对返回平原后的运动成绩产生不利影响,而且在心脏大强度负荷时可能存在一定的潜在的危险性。
两低氧复合运动组左、右心室心肌α-MHC比例为间歇低氧运动组(91%、90%),高住低练组(91%、92%),在低氧和运动的双重刺激下β-MHC向α-MHC转化比例高,与其它各组相比都具有非常显著性差异(P<0.01),这与单纯低氧组结果正好相反这可能是由于在低氧环境下叠加了递增强度的运动,由于实验是运动后即刻取材,所以对于两低氧运动组心肌MHC中可能会存在线粒体和内质网应激,为了适应这种应激,MHC参与心肌生理性重塑,肌球蛋白比例大量快速的转向了A T P酶活性高的α-MHC以适应环境变化。说明心肌肌球蛋白重链表达的调整是心肌对运动训练和低氧适应的重要途径之一[12]。高住低练组MHC转换比例高于间歇低氧组,推测可能是与高住低练的形式有关,低氧的强度不大,而每次低氧的时间长,使机体产生低氧习服;大鼠机体为了应对低氧刺激以及递增强度运动从而加速合成心肌蛋白使得β-MHC向α-MHC转化率提高效率最为显著,这样有利于改善心脏功能,在低氧条件下含A T P酶高的α-MHC比例的增加使心脏的收缩能力以利于机体能够更好地适应低氧及高原环境的影响。
实验结果显示:心肌肌球蛋白及相关指标对于改善和增强心功能H i L o组均优于I HT组,但是H i L o这种模式缺乏低氧运动对心肺功能的强烈刺激,因此根据运动训练的需求不同,还应设计不同的低氧模式进行训练[13]。因此,今后在选择模拟高原训练的时候不能够机械地采用单一的方式进行训练,而是根据项目的特点内容和方法进行重新设计和组合,针对性地选择合适的低氧方式进行运动训练。
[1]田野.运动生理高级教程[M].北京:高等教育出版社,2003:432-441.
[2]雷志平.间歇低氧训练的临床应用研究[J].成都体育学院学报,1997,23(3):65-68.
[3]胡杨.高原训练的多元化发展——从H i H i到H i L o再到H i H i+H i H i L o[J].体育科学,2010,30(11):74-78.
[4]B e d f o r d T G,T i p t o n CM,W i l s o n C N.M a x i m a l O x y g e n C o n s u m p t i o n o f R a t s a n d i t s C h a n g e s W i t h V a r i o u s E x p e r i m e n t a l P r o c e d u r e s[J].J A p p l P h y s i o l,1979(47):1278-1283.
[5]H a s h i m o t o T,Y a m a s a k i S T a g u c h i S.A l t e r a t i o n s i n t h e e x p r e s s i o n o f m y o s i n h e a v y c h a i n i s o f o r m s i n h y p o x i ai n d u c e d h y p e r t r o p h i e d v e n t r i c l e s i n r a t s[J].C o m p a r at i v e B i o c h e m i s t r y a n d P h y s i o l o g y P a r t B:B i o c h e m i s t r y a n d M o l e c u l a r B i o l o g y 2003,136(1):139-145.
[6]S c h u l t z R L,S w a l l o w J G,W a t e r s R P,e t a l.E f f e c t s o f e x c e s s i v e l o n g t e r m e x e r c i s e o n c a r d i a c f u n c t i o n a n d m y o c y t e r e m o d e l i n g i n h y p e r t e n s i v e h e a r t f a i l u r e r a t s[J].H y p e r t e n s i o n,2007,50(2):410-416.
[7]A d v a n i S V,G e e n e n D,M a l h o t r a A e t a l.S w i mm i n g c a u s e s m y o s i n a d a p t a t i o n i n t h e r a t c a r d i a c i s o g r a f t[J].C i r c R e s,1990,67:780.
[8]T a l m a d g e R J R o y R R.E l e c t r o p h o r e t i c s e p a r a t i o n o f r a t s k e l e t a l m u s c l e m y o s i n h e a v y-c h a i n i s o f o r m s[J].A pp l P h y s i o l 1993,75(5):2337-2340.
[9]W a r r e n CMG r e a s e r M L.M e t h o d f o r c a r d i a c m y o s i n h e a v y c h a i n s e p a r a t i o n b y s o d i u m d o d e c y l s u l f a t e g e l e l e c t r o p h or e s i s.A n a l B r i o c h e 2003,320(1):149-151.
[10]李强,高伟,魏宏文.间歇性低氧刺激对运动能力影响的实验研究[J].体育科学,2001,21(3):63-65.
[11]赵鹏,冯连世.新的低氧训练模式研究及应用进展
[J].体育科学,2005,25(6):70-74.
[12]常芸.运动员心脏的热点问题与研究进展[J].体育科学,2010,30(10):70-79.
[13]王海燕.低氧运动对大鼠心肌肌球蛋白重链及其基因表达的影响[J].沈阳体育学院学报,2004,23(3):31-32.
[14]李昭波,高云秋.运动对高血压性肥大心脏心肌肌球蛋白重链基因表达的影响[J].中国应用生理学杂志,1999(4):36-38.
[15]N a k a n i s h i K,N a k a t a Y,K a n a z a w a F,e t a l.C h a n g e s i n m y o s i n h e a v y c h a i n a n d i t s l o c a l i z a t i o n i n r a t h e a r t i n a s s o c i a t i o n w i t h h y p o b a r i c h y p o x i a-i n d u c e d p u l m on a r y h y p e r t e n s i o n P a t r o l 2002,197(3):380-387.
[16]MO R R I S D M.K E A R N E Y J T,B UR K E E R T h e e f f e c t s o f b r e a t h i n g s u p p t m l e n t a l o x y g e n d u r i n g a l t it u d e t r a i n i n g o n c y c l i n g p e r f o r m a n c e[J].S c i M e d S-p o r t,2000,3(2):165-175.
[17]刘福玉,黄庆愿,高钰琪,等.模拟高原游泳运动对大鼠血液粘滞度及心功能的影响[J].中国应用生理学杂志2004(1):8-11.
[18]S a k k a s G K,S a r g e a n t A J,M e r c e r TH,e t a l.C h a n g e s i n m u s c l e m o r p h o l o g y i n d i a l y s i s p a t i e n t s a f t e r 6m o n t h s o f a e r o b i c e x e r c i s e t r a i n i n g.N e p h r o l D i a l T r a n s p l a n t 2003,18(9):1854-1861.
[19]李永民,陈晓春,罗飞,等.人参总皂苷合黄连小檗碱对慢性心衰大鼠心肌肌球蛋白重链的影响[J].第四军医大学学报,2009,30(14):184-185.
[20]P u n k t K,N a u p e r t AA s m u s s e n G.D i f f e r e n t i a t i o n o f r a t s k e l e t a l m u s c l e f i b e r s’d u r i n g d e v e l o p m e n t a n d a g e i n g.A c t a H i s t o c h e m i c a 2004,106(2):145-154.
[21]L u e d e k e J D,M c C a l l R D,D i l l a m a n RM,e t a l.P r o p e rt i e s o f s l o w-a n d f a s t-t w i t c h s k e l e t a l m u s c l e f r o m m i c e w i t h a n i n h e r i t e d c a p a c i t y f o r h y p o x i c e x e r c i s e.C o m p B r i o c h e P h y s i o l o g y A M o l I n t e g r a P h y s i o l 2004,138(3):373-382.
[22]L e o n V e l a r d e F,B o u r i n M C,G e r m a c k R,e t a l.D i f f e r e n t i a l a l t e r a t i o n s i n c a r d i a c a d r e n e r g i c s i g n a l i n g i n c h r o n i c h y p o x i a o r n o r e p i n e p h r i n e i n f u s i o n.A m J P h y s i o l R e g u l I n t e g r C o m p P h y s i o l 2001,280(1):R 274-281.
[23]M o r a n o I,A d l e r K,W e i s m a n n K,e t a l.C o r r e l a t i o n o f m y o s i n h e a v y c h a i n e x p r e s s i o n i n t h e r a t w i t h c AMP i n d i f f e r e n t m o d e l s o f h y p e r t e n s i o n-i n d u c e d c a r d i a c h y p e r t r o p h y M o l C e l l C o r d i a l 1993,25(4):387-394.
[24]B a r n e s B R Z i e r a t h J R.R o l e o f AMP--a c t i v a t e d p r ot e i n k i n a s e i n t h e c o n t r o l o f g l u c o s e h o m e o s t a s i s.C u r r M o l M e d 2005,5(3):341-348.
[25]B a m f o r d J A,L o p a s c h u k G D,M a c L e a n I M,e t a l.E f f e c t s o f c h r o n i c A I C A R a d m i n i s t r a t i o n o n t h e m e ta b o l i c a n d c o n t r a c t i l e p h e n o t y p e s o f r a t s l o w-a n d f a s t-t w i t c h s k e l e t a l m u s c l e s.C a n J P h y s i o l P h a rm a c o l 2003,81(11):1072-1082.
[26]苏艳红,王瑞元,周 越.低氧、低氧耐力训练对大鼠肌球蛋白重链表达的影响[J].北京体育大学学报,2008,31(7):919-921.
