从深圳市医疗器械产业发展情况看我国医疗器械产业监管
2012-04-09王晓炜刘洪伟陈玉文
杨 涵,王晓炜,刘洪伟,李 军,陈玉文
(1.沈阳药科大学,辽宁 沈阳 110016; 2.广东省深圳市药品检验所,广东 深圳 518029)
随着我国医疗卫生事业的快速发展,医疗器械得到了越来越广泛的应用。2008年,在全球金融危机的影响下,许多行业出现了较大幅度的衰退,而欧盟医疗器械委员会发布报告称全球医疗器械销售额逆市增长了12%,首次超过药品[1],成为医药行业中的核心产业,同时也使得医疗器械行业成为当今世界经济中发展最快、贸易往来最活跃的工业门类之一。笔者通过对我国近几年医疗器械监管历程、生产企业规模变化等情况进行分析,试图找出医疗器械监管中存在的问题,促进深圳市医疗器械行业持续、稳定地发展。
1 我国医疗器械的监管历程
1996年,原国家医药管理局发布了《医疗器械产品注册管理办法》(16号令),第一次以部门规章的形式启动了中国的医疗器械市场准入注册制度[2],采用了与发达国家基本一致的医疗器械统一定义和按照风险等级划分的管理类别。2000年,中国医疗器械监管史上一个里程碑《医疗器械监督管理条例》诞生了。为了贯彻实施该条例,国家药品管理部门发布了系列规章(见表1),它们与该条例一起构成了一套基本完整的医疗器械监督管理法规体系。这些法规、标准、规范的出台,表明了国家对医疗器械产业的重视,进一步加强了医疗器械的监管力度,规范了市场环境。

表1 我国医疗器械监管法规的变革
2 深圳市医疗器械产业的发展情况
2.1 产业规模发展情况
根据深圳市食品药品监督管理局的统计,全市361家医疗器械生产企业(近80%)上报了相关统计数据,基本涵盖全市所有规模化生产的医疗器械企业,基本可代表深圳医疗器械产业的发展现状。统计结果见图1。可见,深圳市医疗器械产业规模增长速度很快,2010年全市年总产值为 163.08亿元人民币,同比增长34.45%;企业平均年产值大幅增加,2010年企业整体规模明显增加。另外,由于近年来医疗器械监管法规及企业生产体系要求维持在较高水平,企业开办门槛提高,从而使具有自主知识产权的自主品牌大型企业发展势头良好。

图1 2002—2010年深圳市医疗器械生产规模变化情况
2.2 企业数量变化
截至2010年底,深圳市处于正常生产经营状态的二类、三类医疗器械生产企业共有428家,同比增长了10.31%。表2反映出企业开始进入动荡和分化时期。一是规模化企业越来越多、越来越大,产业年总产值增长速度远远大于生产企业数量增长速度,说明深圳医疗器械行业内企业规模持续增长;另外由于2003年至2005年部分体外诊断试剂划归为医疗器械管理,无需按《药品生产质量管理规范》(GMP)要求开办,相关监管法规要求滞后,导致企业数量增加。二是近几年内企业数量基本保持稳定,由于近几年医疗器械监管法规体系日渐完善,再加上行业内老产品生产企业竞争激烈,新产品研发投入大、要求高,导致企业数量基本稳定。
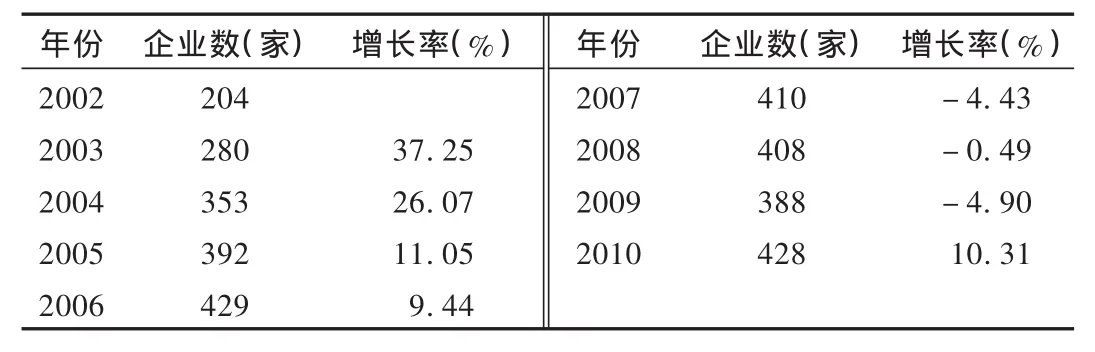
表2 2002——2010年深圳市二类、三类医疗器械生产企业数量变化
2.3 企业规模变化
深圳市医疗器械产业有着显著的高技术产业特性,企业自主知识产权、产品技术含量、技术附加值等指标远远高于全国的平均水平。近十几年来,年均30%以上的增长率已经使得深圳医疗器械产业初具规模。目前深圳医疗器械生产企业400多家,经营企业1000多家,生产企业中年产值过亿元的企业20家,产业聚集效应明显;产业年总产值150亿元人民币,出口额占总产值的比例超过60%,外向型经济特征显著;深圳已经成为我国医疗器械产业三大聚集区之一珠江三角洲区域的核心。
深圳市医疗器械行业中,中小企业占很大比例;按产值规模分布,各阶段的企业数量均有所增加,尤其是产值超过亿元的企业数量增长幅度较大。图2显示,深圳医疗器械产业集中度较高,龙头企业带动作用明显,使得中小企业快速成长。
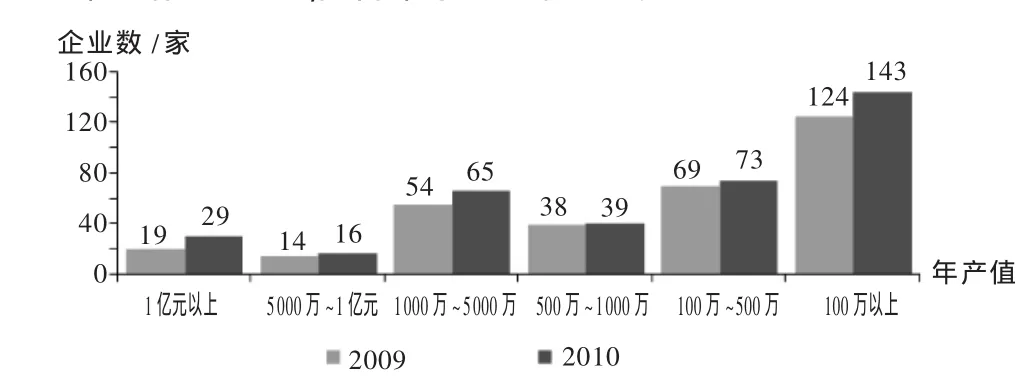
图2 2009年与2010年深圳市医疗器械生产企业年产值规模分布图
2.4 产品数量与种类
深圳市医疗器械产品种类比较齐全,几乎覆盖了临床医学的所有领域,主要集中在高技术医学影像诊断类、放射治疗类、医用电子仪器类、家用电子类、介入治疗类、口腔义齿类、体外诊断试剂类产品[3]。由此可见,随着深圳市医疗器械产业的不断发展,产业创新能力不断加强,“深圳制造”在国内及国外更加深入人心。
3 医疗器械监管中存在的问题
3.1 《医疗器械监督管理条例》内容不完善
现行条例在7年多的实践中虽然发挥了重要作用,但也存在诸多问题:首先是关于检测收费。根据规定,进行医疗器械注册及其强制性检测,可以收取费用,具体收费标准由国务院财政部门、国务院价格主管部门制定。但现行条例没有明确产品注册及其检测可以收取费用。由于没有法律规定的授权,财政部门一直没有批准医疗器械检测的收费标准。由于没有统一的收费标准,各检测中心的收费差异较大。若再不明确产品注册及其检测收费标准,将影响医疗器械产品注册检测工作的进行。其次,现行条例无命名管理的规定。我国医疗器械命名较混乱,不同生产者申报的相同或相似的产品命名不同,给产品分类和监管带来巨大困难。因此有必要设置命名管理的规定,由主管部门按照统一的原则管理医疗器械命名工作。整体而言,医疗器械产业发展快速,高科技产品、学科交叉产品不断上市,给医疗器械监管带来了严峻的挑战。因此,迫切需要进一步完善《医疗器械监督管理条例》以应对急速变化的形势。
3.2 公共信息平台不完善
现行医疗器械监管法规规定,要执行医疗器械国家标准、行业标准,而我国现有119个医疗器械国家标准、439个行业标准[4]。但是,当国际标准已有新版本而我国的国家标准或行业标准并未跟进时,一些已按照新国际标准执行的境外医疗器械,为了能在中国注册,不得不按照旧版标准制定产品标准并重新检测。
3.3 医疗器械检测机构权威性不够
深圳市医疗器械检测中心是全市唯一的医疗器械专项检测机构,也是全市唯一具有国家注册检验资质、同时承担监督抽样检验和国家检测项目研究的法定机构。目前该中心检测范围已涵盖368个项目,但对支撑本地业务发展来说依然不足。其主要原因并不是硬件设备和人员水平的差距,而是缺乏相关的国家认可资质。
4 加强医疗器械监管的对策建议
4.1 完善医疗器械监管法律法规
目前的《医疗器械监督管理条例》内容尚不完善,要加强医疗器械监管工作,就要加快立法工作,把医疗器械监管和药品监管放在同等重要的地位[5]。另外,还要完善企业生产使用过程中的监管法规,确保监管过程中所有环节安全有效。《药品管理法实施条例》第六十二条规定了药品注册及强制性检验可以收取费用,医疗器械的注册检验是该条例规定的强制性检验,因此以条例形式明确医疗器械检测收费标准是可行的[6]。医疗器械命名问题复杂,既要统一,又要科学规范,建议研究并借鉴全球医疗器械命名法。
4.2 建立信息平台
深圳医疗器械产业呈中小企业集群式发展模式,因此,公共信息平台和产业联盟的建设极为重要。由于注册产品标准涉及商业机密,除生产厂家外不向社会公布,故有必要建立一个全国性的医疗器械注册产品标准数据库[7],内部信息共享,使得监管部门及技术部门可对整个产品进行质量控制、横向比较、综合评价,以供医疗器械注册、监管、稽查部门了解整个行业的质量水平。
4.3 加强医疗器械检测机构建设
必要的基础建设规模,是目标实现的重要保障:医疗器械产品种类众多、学科跨度大,要求医疗器械检测实验室不仅要有通用安全实验室,也要有按专业、按学科分类的专业实验室,综合实验室的整体建设需要满足防震动、防辐射、隔音、防光等特殊要求。这些都决定了医疗器械检测中心的基础设施规划和建设必须起点高、投入大,需要政府给予全力支持、全力保障。
先进的设备条件,是目标实现的必要基础:医疗器械检测中心的设备必须是能够适应国际发展趋势的设备。还有很多医疗器械产品是涉及多学科、综合性的高新科技产品,没有对应的国际标准或国内相关标准,也没有通用的检测方法和检测设备,对其进行检验,都需要研制国际先进的专门工装和测试设备。由此,检测实验室只有配备了足够先进的设备条件,才能国内领先、国际一流。
重视人才队伍建设,是目标实现的关键:国际一流的实验室,不仅需要一流的设施设备,更重要的是要拥有一流的人才队伍。医疗器械检测需要多专业、多层次复合型人才,要建立多层次、多渠道、多形式的人才培养机制。建议尽快落实相关人才和项目引进政策,鼓励和支持高端人才留下来。
[1]Campbell G.Statistics in the world of medical devices:the contrast with pharmaceuticals[J].Journal of Biopharmaceutical Statistics,2008,18(1):4-19.
[2]常永亨.中国医疗器械监督管理之回顾与展望[J].中国医疗器械杂志,2011,35(3):209.
[3]陶笃纯.深圳医疗器械产业介绍[EL/OB].[2011-04-26].http:// wenku.baidu.com/view/ee2d61106edb6f1aff001f24.htm l.
[4]张 静.以监管药品的力度依法监管医疗器械[J].中国药业,2005,18(8):4-6.
[5]迟元勤,狄 泉.对医疗机构使用医疗器械监管的思考[J].齐鲁药事,2009,28(12):709-711.
[6]常永亨.从法规的系统性看医疗器械监督管理条例修订[J].中国医疗器械信息,2008,14(1):1-29.
[7]许 伟,蓝翁驰.医疗器械注册产品标准的现状分析与发展对策探究[J].中国医疗器械信息,2010,16(4):52-55.
