硼替佐米对小鼠急性出血坏死性胰腺炎肺损伤的治疗作用
2012-03-27姜仁鸦詹银楚吴善水余耀生姚宏宇胡雅国
姜仁鸦,詹银楚,吴善水,余耀生,姚宏宇,胡雅国
硼替佐米对小鼠急性出血坏死性胰腺炎肺损伤的治疗作用
姜仁鸦,詹银楚,吴善水,余耀生,姚宏宇,胡雅国
目的:观察硼替佐米对小鼠急性出血坏死性胰腺炎肺损伤的治疗作用。方法:连续7次腹内注射雨蛙素(每次间隔1 h)及脂多糖,制作小鼠重症急性胰腺炎(SAP)模型;将30只ICR雌性小鼠随机分为治疗组(注射脂多糖前0.5 h腹内注射0.5mg/kg硼替佐米)、模型组(注射脂多糖前0.5 h腹内注射50%DMSO)、空白组。最后一次注射雨蛙素2 h后麻醉小鼠,自右颈静脉取血检测血淀粉酶、LDH、CRP;光镜下观察小鼠胰腺和肺脏的病理形态,测定肺组织中MPO水平,实时荧光定量PCR测定肺组织中黏附分子ICAM-1、E-selectin、P-selectin的含量。结果:与模型组相比,治疗组小鼠血淀粉酶、LDH、CRP明显下降(P<0.05);治疗组小鼠胰腺和肺脏炎细胞浸润及出血明显减少(P<0.05),肺组织MPO和黏附分子的含量明显下降(P<0.05)。结论:硼替佐米通过抑制黏附分子表达,减少中性粒细胞浸润,对小鼠胰腺炎肺损伤有一定的治疗作用。
急性出血坏死性胰腺炎;肺损伤;ICAM-1;选择素;硼替佐米
急性胰腺炎肺损伤(acute pancreatitis associated lung injury,APALI)是急性出血坏死性胰腺炎(acute hemorrhagic necotizing pancreatitis,AHNP)早期最常见、最严重的并发症,75%的患者早期即可出现,临床上表现为急性呼吸窘迫综合征,在这个阶段,病死率高达30%-50%[1]。硼替佐米(PS-341)是目前唯一一个批准进入临床的蛋白酶体抑制剂,它能够特异性抑制26S蛋白酶体活性,使I-κBα的降解减少,从而间接抑制了NF-κB活化,使多种炎症介质、细胞因子及黏附分子的表达和释放降低,从而减轻SAP和胰腺炎肺损伤。本实验通过建立小鼠SAP模型,研究PS-341对小鼠APALI的治疗作用及其作用机制。
1 材料和方法
1.1 动物 ICR雌性小鼠30只(由浙江大学医学院动物中心提供,SYXK(浙)2005-0072),体质量19~21 g。合适的室温(21~25℃)和湿度条件下,12 h光照/12 h黑暗交替喂养,实验前禁食12 h不禁水。
1.2 主要试剂 PS-341纯粉受赠于加拿大蒙特利尔大学吴江平教授,雨蛙素、脂多糖购自美国Sigma公司,髓过氧化物酶(MPO)测试盒购自南京建成生物公司,Real-time PCR试剂盒购自TaKaRa生物公司(日本),黏附分子引物由上海英骏生物工程有限公司合成。
1.3 分组 将30只小鼠用完全随机方法分成治疗组、模型组、空白组,每组10只。
1.4 造模方法 通过连续7次腹腔注射50μg/kg雨蛙素,每次间隔1 h,并在首次注射雨蛙素5 h后腹腔注射10 mg/kg脂多糖。治疗组:注射脂多糖前0.5 h腹腔注射硼替佐米(0.5 mg/kg)0.2 mL(硼替佐米溶解于50%DMSO,0.9%的生理盐水稀释);模型组(DMSO组):注射脂多糖前0.5 h腹腔注射50% DMSO 0.2 mL(生理盐水稀释);空白组(NS组):用生理盐水代替雨蛙素和脂多糖,依照同样的方法腹腔注射。
1.5 血清和组织标本采集方法 首次注射雨蛙素8 h后,将小鼠用50mg/kg的戊巴比妥钠腹腔注射麻醉,右颈内静脉取血,离心得到血清,保存于-20℃冰箱中。取血结束,剖开胸腔和腹腔,将小鼠肺、胰腺快速取出,一部分用10%的中性福尔马林固定,另一部分放冻存管中液氮速冻,而后转移到-80℃冰箱中。
1.6 检测方法及指标 血清淀粉酶、CRP和LDH检测:血清解冻后,用生理盐水稀释5倍,采用全自动生化分析仪(Olympus AU5400,日本)检测。
胰腺及肺组织病理组织学检查:10%甲醛固定,HE染色,光镜下观察病理形态。请两位病理教研室老师对胰腺和肺组织的水肿、炎性浸润、出血和坏死情况评估,评估前对实验设计均未知。评分标准按照Schmidt等制定的胰、肺病理评分系统,见表1、表2。

表1 胰腺病理学评分

表2 肺脏病理学评分
肺组织髓过氧化物酶(MPO)测定:按说明书进行测定并计算结果。
实时荧光定量PCR(Real-time PCR)检测肺脏组织中ICAM-1、P-selectin、E-selectin表达:肺组织称重后放入研钵,加入液氮研磨至粉状,立即加入1 mL TRIzol混匀,室温放置5 min;加氯仿1/5体积(0.2mL),混匀室温放置10min;4℃12 000转高速离心15 min,转上层水相到1.5 mL EP管中,加入等体积异丙醇,混匀放置10 min;4℃,12 000转高速离心10 min,弃上清,加冰预冷的75%乙醇(DEPC水溶解)1mL,4℃7500转离心5min,弃上清,空气干燥5~10 min,溶于DEPC水中至20 uL,-80℃保存肺组织总RNA。再通过逆转录酶生成cDNA,cDNA1 uL+up-primer 1 uL+down-primer 1 uL+ddH2O 7 uL+supermix 10 uL,总共20 uL加入毛细管中,离心后植入PCR仪中,采用SYBR GreenⅠ嵌合荧光法进行检测,在Roche LightCycler Real-Time PCR扩增仪上完成。引物设计见表3。组织ICAM-1,E-selectin,F-selectin表达量同GAPDH比较,计算公式为

表3 引物设计
2 结果
2.1 血生化检测 与模型组相比,治疗组血淀粉酶、LDH、CRP均明显降低,(P<0.05),见表4。
2.2 光镜下各组胰腺及肺脏组织病理表现 组织病理学显示,与模型组相比,治疗组胰腺和肺脏出血、坏死、炎性细胞浸润均减少(P<0.05,P<0.01),见图1、图2,表5、表6。
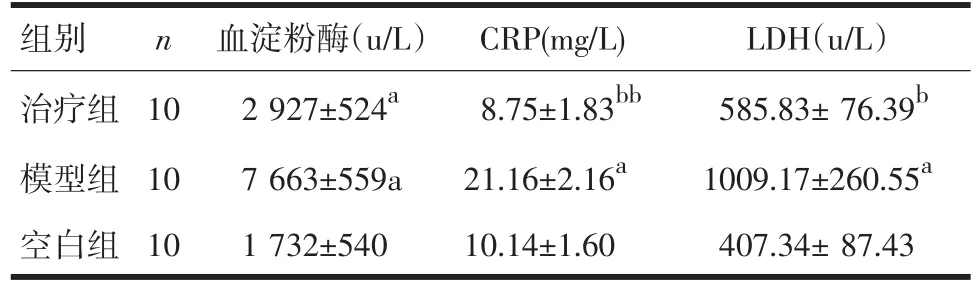
表4 血淀粉酶、LDH、CRP比较
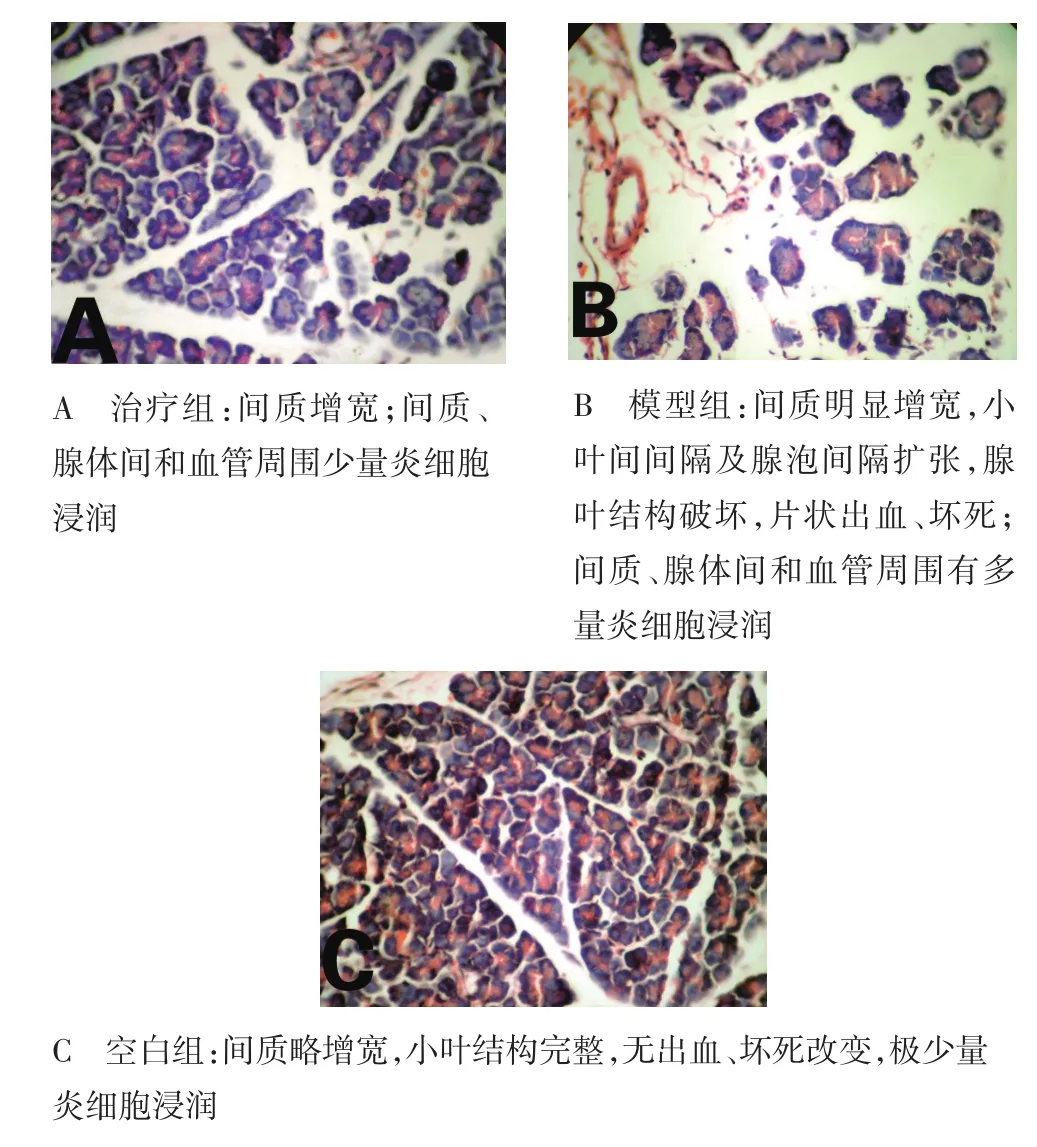
图1 胰腺组织病理形态学比较(HE×400)

图2 肺脏病理形态学观察(HE×400)
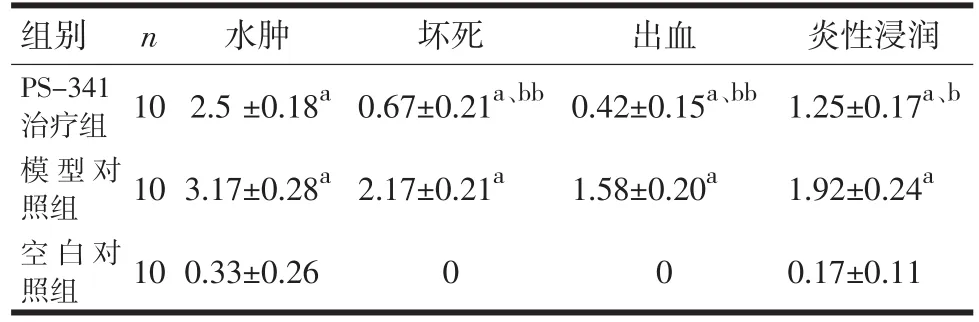
表5 各组胰腺组织病理学评分
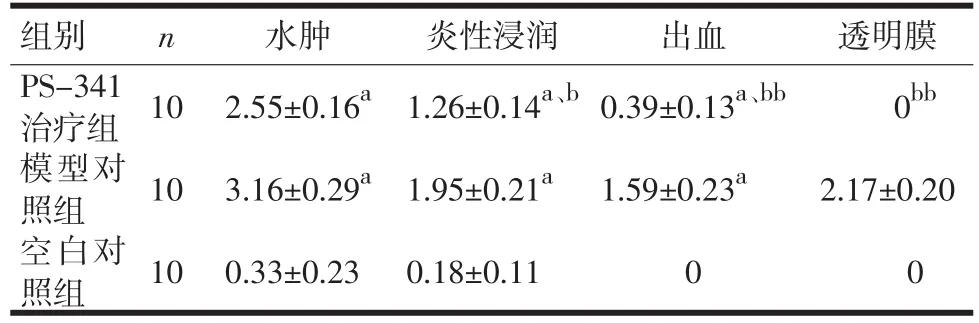
表6 各组肺脏组织病理学评分
2.3 肺脏MPO的比较 与模型组相比,治疗组的MPO的水平明显降低,两者之间有统计学意义。见图3。
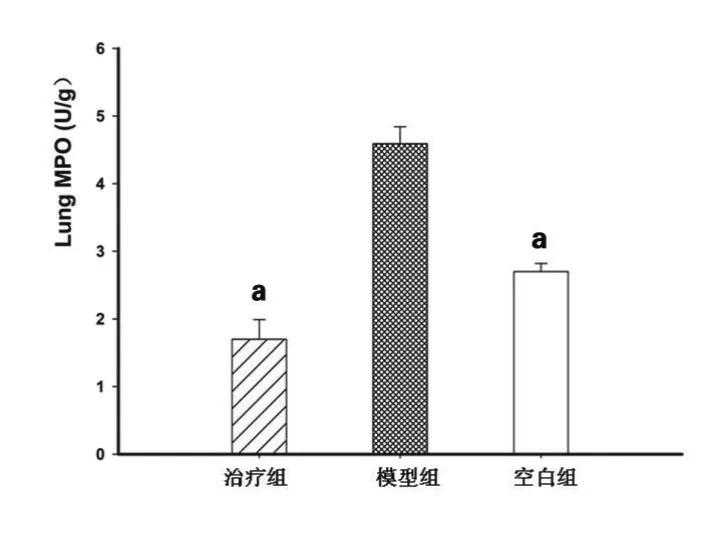
图3 肺脏髓过氧化物酶水平比较
2.4 肺脏中黏附分子的比较 与模型组相比,治疗组的黏附分子ICAM-1、P-selectin、E-selectin表达明显下降,见表7。
表7 肺脏中黏附分子的比较(u/m L,±s)
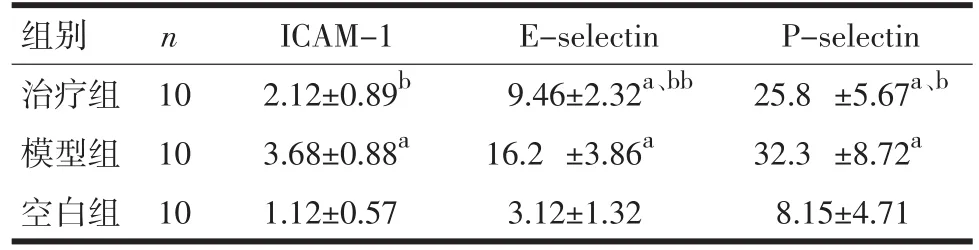
表7 肺脏中黏附分子的比较(u/m L,±s)
注:与空白组相比,aP<0.01;与模型组相比,bP<0.05,bbP<0.01
组别治疗组模型组空白组n 10 10 10 ICAM-1 2.12±0.89b3.68±0.88a1.12±0.57 E-selectin 9.46±2.32a、bb16.2 ±3.86a3.12±1.32 P-selectin 25.8 ±5.67a、b32.3 ±8.72a8.15±4.71
3 讨论
AHNP是临床常见的危重病,其发病急,进展快,患者早期即可出现全身炎症反应综合征(systemic imflammation reaction syndrome,SIRS),导致远离脏器损伤和多脏器功能不全(mulple organ dysfunction syndrome,MODS)。MODS最常累及的脏器是肺,APALI的发病机制尚未完全阐明。有研究表明,中性粒细胞在肺组织中的浸润对APALI起了关键性的作用,中性粒细胞的缺失可以减轻由胰腺炎引起的肺功能障碍[1]。本实验中发现,当诱导出急性胰腺炎肺损伤模型后,肺脏中MPO活性明显升高,说明在急性出血坏死性胰腺炎的情况下,肺脏中有大量的中性粒细胞浸润。肺脏的病理改变在胰腺炎发作后数小时即可出现,主要表现为肺组织水肿、充血,导致肺组织的顺应性下降。当SAP进一步发展时,白细胞进入肺间质,增加内皮细胞的通透性导致组织水肿。在实验性胰腺炎中,用抗中性粒细胞血浆减少循环中的中性粒细胞,可以减轻远离脏器的损伤,治疗AHNP肺损伤的有效方法就是抑制中性粒细胞的黏附、聚集和活化[2]。本实验中,用PS-341治疗的小鼠肺脏病理改变明显减轻;与模型对照组相比,PS-341治疗组小鼠肺脏MPO水平明显下降,两者之间有统计学意义。以上结果证实了减少中性粒细胞在肺脏中的浸润可以减轻SAP肺损伤。
黏附分子ICAM-1、E-selectin、P-selectin是表达在内皮细胞表面的一种糖蛋白,在急性炎症反应中,内皮细胞通过细胞因子、趋化因子和表达黏附分子对炎症刺激产生反应。E-selectin、P-selectin减慢循环中中性粒细胞移动的速度,以便它们能检测到内皮细胞表面的趋化因子和黏附分子[3]。激活的中性粒细胞黏附到内皮细胞表面,是由于中性粒细胞表面的受体蛋白(CD11/CD18)和内皮细胞表面的黏附分子(如ICAM-1)相互作用的结果[4]。在急性胰腺炎动物模型中,人们用单克隆抗体或抗细胞因子的药物减少黏附分子的表达,从而减轻肺损伤[5]。PS-341是一种强效、高度选择性的proteasome抑制剂,PS-341抑制了I-kB的降解,使NF-kB活性受到抑制。NF-kB活性受抑制后,各种黏附分子ICAM-1,E-selectin、P-selectin的产生大为减少,从而减少中性粒细胞在肺脏中的浸润,减轻肺损伤的程度。本实验中,模型对照组肺脏的ICAM-1,E-selectin、P-selectin水平明显高于PS-341治疗组,说明AHNP小鼠并发肺损伤时肺脏组织中黏附分子的产生明显增多,而PS-341治疗后黏附分子的产生明显减少,这一点与肺脏病理改变的严重程度及肺脏MPO水平的高低相一致。以上结果证实了下调黏附分子的表达可以减轻胰腺炎肺损伤。
PS-341通过抑制黏附分子的表达,减少中性粒细胞在肺脏中的浸润,从而减轻胰腺炎肺损伤。目前已知,抗氧化剂对NF-kB的活化也有抑制作用,但Steinle等[6]报道,应用N-乙酰半胱氨酸治疗大鼠胰腺炎模型,胰腺病变反而加重,血淀粉酶升高,这可能和药物的毒副作用以及用药时机有关。在预实验中,我们采用了0.1 mg/kg、0.2 mg/kg、0.5 mg/kg、1.0 mg/kg 4种剂量的PS-341做治疗,最终证实0.5 mg/kg是最佳的药物浓度。本实验用0.5 mg/kg PS-341治疗胰腺炎肺损伤,不但肺损伤减轻,而且血淀粉酶明显降低,胰腺损伤也明显减轻[7]。
[1]Bhatia M,Moochhala S.Role of inflammatory mediators in the pathophysiology of acute respiratory distress syndrome [J].J Pathol,2004,202(2):145-156.
[2]Bhatia M,Brady AK,Hofbauer B,et al.The effects of neutrophil depletion on a completely noninvasive model of acute pancreati⁃tis-associated lung injury[J].Int JPancreatol,1998,24(2):77-83.
[3]Wang Y,Thorlacius H.Mast cell-derived tumour necrosis fac⁃tor-alpha mediates macrophage inflammatory protein-2-induced recruitment of neutrophils in mice[J].Br J Pharmacol,2005,145 (8):1062-1068.
[4]Bhatia M,Wong FL,Cao Y,et al.Pathophysiology of acute pancre⁃atitis[J].Pancreatology,2005,5(2-3):132-144.
[5]R Horuk,M Bhatia.Treatment With BX471,a Nonpeptide CCR1 Antagonist,protects Mice Against Acute Pancreatitis-Associated Lung Injury by Modulating Neutrophil Recruitment[J].Pancreas, 2007,34(2):233-241.
[6]Steinle AU,Weidenbach H,Wagner M,et al.NF-kappaB/Rel ac⁃tivication in cerulean pancreatitis[J].Gastroenterology,1999,116 (2):420-430.
[7]胡雅国,詹银楚,陈丽萍,等.蛋白酶体抑制剂PS-341对重症急性胰腺炎小鼠的治疗机制[J].中国中西医结合外科杂志,2010, 16(6):667-669.
(收稿:2011-02-16 修回:2011-11-10)
(责任编辑 刘洪斌 田在善)
Experimental Study of Bortezomib in Protecting Acute Pancreatitis-Associated Lung Injury in Mice
JIANG Ren-ya,ZHAN Yin-chu,LIN Shui-quan,et al. Department of surgery,Quzhou people’s hospital,Zheji⁃ang Quzhou(324000),China
ObjectiveTo observe the therapeutic effect of Bortezomib(PS-341)on experimental acute pancreatitis-associated lung injury in mice.Methods Severe acute pancreatitis was induced by cerulin and li⁃popolysaccharide(LPS)in mice.Thirty minutes before the administration of lipopolysaccharide,the mice were treated either PS-341 or DMSO.Pancreatic inflammation and lung injury were assessed.The expression of inter⁃cellular adhension molecule 1,P-selectin,E-selectin in lung was studied by reverse transcriptase-polymerase chain reaction. Results Treatment with PS-341 significantly protected mice against pancreatitis-associated lung injury by attenuating myeloperoxidase activity,an indicator of neutrophil infiltration,lung morphological changes in histological sections,and down-regulating intercellular adhesion molecule 1,P-selectin,and E-selec⁃tin expression at mRNA in lung compared with DMSO-treated groups(P<0.05). Conclusion PS-341 may be a promising drug to prevent disease progression in acute hemorrhagic necrotizing pancreatiits by interfering with neutrolphil infiltration.
Acute hemorrhagic necrotizing pancreatitis,Lung injury,ICAM-1,Selectin,Bortezomib
R656.6;Q95-33
A
1007-6948(2012)01-0043-04
10.3969/j.issn.1007-6948.2012.01.013
浙江省科技厅资助项目(2006C33077)
浙江省衢州市人民医院肝胆外科(衢州 324000)
姜仁鸦,E-mail:yaya20011222@126.com
