菊米提取液对人结肠癌SW620细胞增殖和凋亡的影响
2012-03-27司马军刘丹丹王索安郑鸣之
司马军,陈 健,刘丹丹,沈 健,王索安,郑鸣之,仇 容
实验研究
菊米提取液对人结肠癌SW620细胞增殖和凋亡的影响
司马军1,陈 健2,刘丹丹2,沈 健2,王索安2,郑鸣之2,仇 容2
目的:观察菊米提取液对人结肠癌SW620细胞增殖和凋亡的影响。方法:用不同浓度的菊米提取液处理SW620细胞,MTT法检测菊米提取液对SW620细胞增殖的抑制作用;流式细胞术检测细胞凋亡率;比色法测定Caspase-3/7酶和Caspase-6酶活性。结果:菊米提取液对SW620细胞增殖有抑制作用,IC50为0.012mg/mL,且呈一定的量效关系;随着药物浓度的增加(0.001、0.002、0.005、0.01 mg/mL),细胞凋亡率分别为(6.46±0.02)%、(9.77±0.01)%、(13.11±0.04)%、(18.47± 0.05)%,对照组细胞凋亡发生率为(4.83±0.01)%,显示菊米提取液诱导的细胞凋亡作用随浓度的增大而增加。同时Caspase-3/7酶和Caspase-6酶活性显著增强。结论:菊米提取液在能抑制体外培养的SW620细胞增殖并诱导其凋亡,Caspase-3、6、7活性增强可能是菊米提取液诱导SW620细胞凋亡的机制之一。
菊米提取液;结肠癌;增殖;细胞凋亡
野菊花(Flos Chrysanthemi Indici)是菊科植物野菊Chrysanthemum indicum L的干燥状花序,是一种常用中药。据报道,野菊花水提液可抑制大鼠心、脑、肝等组织脂质过氧化,增加组织抗氧化酶的活性[1]。菊米多为菊科植物甘野菊(Chrysanthemum seticuspe)的花蕾制作而成。菊米与野菊花成分类似,富含挥发油、蛋白质、菊米内脂、野菊花素、黄酮等,也含有小白菊内酯、木犀草素、芹菜素、萜类化合物等成分,目前被广泛用于保健茶饮。已有研究证实[2,3],菊米提取液可通过影响NO途径,发挥抗氧化作用而舒张血管并对抗心肌缺血再灌注损伤;小白菊内酯、萜类化合物、木犀草素和芹菜素等均可过抑制肿瘤细胞增殖且诱导其凋亡而发挥抗肿瘤的作用。本研究将不同浓度的菊米提取液与人结肠癌SW620细胞共同培养,观察其对该细胞增殖和凋亡的影响。
1 材料与方法
1.1 材料 人结肠癌SW620细胞购自中科院上海细胞库。RPMI 1640细胞培养基(Gibco,美国);MTT、PI和DMSO(Sigma,美国);casapase-3/7、casapase-6活性检测试剂盒(Promega,美国);其他常规试剂均为国产分析纯。野菊米购自遂昌华昊菊米有限公司。酶联检测仪(Bio-Tek ELX800,美国);流式细胞仪(BD FACSCalibur,美国);多功能分辨荧光仪1420(Wallac 1420,美国)。
1.2 细胞培养 含10%胎牛血清的RPMI 1640完全培养液,置于含5%CO2培养箱中,在37℃、95%湿度条件下培养人结肠癌细胞株SW620。0.25%胰蛋白酶和0.02%EDTA消化、传代细胞。
1.3 药物处理及分组 菊米提取液的制备:取干的野菊米加入10倍的无水乙醇室温萃取24 h,过滤去沉淀,上清液用旋转蒸发器浓缩后,用DMSO溶解,依次制备成1、2、5和10mg/mL 4个浓度的母液。临用前再用含2%FBS的RPMI 1640培养液分别稀释1000倍制成相应的工作液(其中DMSO浓度为0.1%)。
1.4 细胞生存率测定 采用MTT法测定。用含2%FBS的DMEM培养液调整细胞浓度至3×104个/mL,按180μL/孔(6×103个左右细胞量)接种于96孔板中,16 h后给予各种不同处理,分为对照组(含终浓度为0.1%DMSO完全培养液培养)和4个不同浓度药物组(0.1%DMSO完全培养液中分别含0.001、0.002、0.005、0.01 mg/mL菊米培养液培养),并于37℃、5%CO2条件下继续培养48 h。然后各孔中按1∶9加入5 mg/mL MTT(用pH 7.4 PBS配制),再置37℃、5%CO2条件下继续培养4 h。弃去上清液,加入DMSO 150μL孔,摇床30min后,在酶联检测仪上570 nm波长处测吸光度(A)值,以A值间接反映存活细胞数量。
1.5 细胞凋亡测定 采用碘化丙啶(propidium iodide,PI)单染分析法用流式细胞仪测定细胞周期以反映细胞凋亡情况。收集各处理组细胞均匀打散,PBS冲洗3次后于70%乙醇中4℃固定18 h,洗去乙醇,加入RNase(50mg/mL)消化并用PI(100mg/mL)染色30 min,用流式细胞仪检测细胞亚二倍体凋亡峰,根据此亚二倍体峰计算凋亡细胞的百分率。
1.6 Caspase-3/7和Caspase-6酶活性分析 采用荧光比色法测定。具体操作根据Promega试剂盒说明书,即将细胞均匀接种于96孔板中,给予不同处理后,各孔加入与培养基等体积的caspase-3/7,caspase-6发光底物(分别为Z-DEVD-R110,Z-VEID-氨基萤光素),轻轻摇匀30 s,室温孵育2 h后于多功能荧光分析仪Wallac 1420 Explorer上测量萤光值(relative light units,RLU)。
1.7 统计学处理 各组资料以均数±标准差表示,并用SigmSata软件包处理。两组数据采用Student’s t-test进行显著性检验。多组数据采用单因素方差分析(Ono-way ANOVA)和Student-Newman-Keuls(SNK)检验。统计学检验水准α=0.05(双侧)。P<0.05认为差异具有统计学意义。
2 结果
2.1 菊米提取液对SW 620细胞增殖的影响 含菊米提取液0.001~0.01 mg/mL的完全培养基在培养48 h后,与不含药物的对照组相比,可呈剂量依赖性地抑制SW620细胞增殖(见表1),其IC50(半数抑制浓度)为0.012 mg/mL。菊米提取液对SW620细胞增殖的抑制作用与其质量浓度呈正相关(r=0.9984,P<0.05)。
表1 不同质量浓度菊米提取液对SW 620细胞增殖的影响(±s)

表1 不同质量浓度菊米提取液对SW 620细胞增殖的影响(±s)
注:与对照组比较,aP<0.05,aaP<0.01
组别对照组药物组(mg/mL)0.001 0.002 0.005 0.01吸光度(A570)0.9781±0.0242 0.9593±0.0078 0.8973±0.0131a0.7931±0.0499aa0.5847±0.0539aa
2.2 菊米提取液对SW 620细胞凋亡的影响 SW620细胞与含或不含有菊米提取液的完全培养基共同培养48 h后,收集全部培养细胞经流式细胞术检测,与对照组比较,不同浓度药物组均可显著提高细胞凋亡率,具有统计学差异(P<0.05),且呈现一定的剂量依赖性(见表2、图1)。
2.3 菊米提取液对Caspase-3/7、Caspase-6酶活性的影响 SW 620细胞与含或不含有菊米提取液的完全培养基共同培养48 h后,与对照组相比,除了0.001 mg/mL药物浓度组,其余3个药物浓度组的Caspase-3/7、Caspase-6酶活性均有显著增加(P<0.05),且呈现一定的剂量依赖性(见表3)。
表2 不同质量浓度菊米提取液对SW 620细胞凋亡的影响(±s)
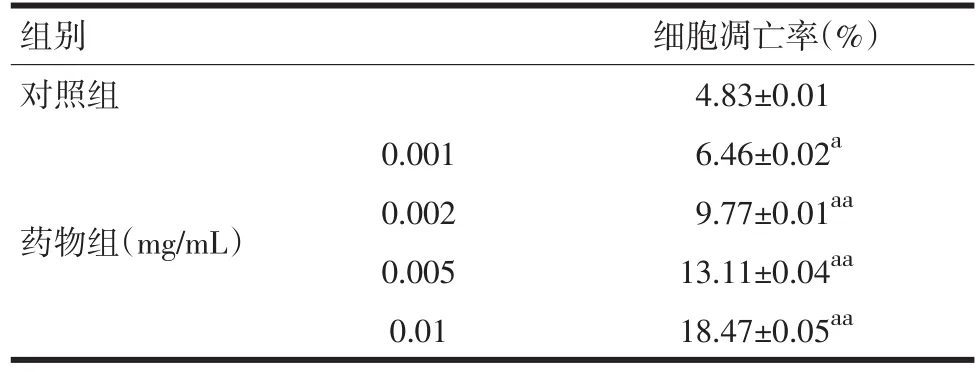
表2 不同质量浓度菊米提取液对SW 620细胞凋亡的影响(±s)
注:与对照组比较,aP<0.05,aaP<0.01
组别对照组药物组(mg/mL)0.001 0.002 0.005 0.01细胞凋亡率(%)4.83±0.01 6.46±0.02a9.77±0.01aa13.11±0.04aa18.47±0.05aa

图1 不同浓度菊米提取液对SW 620细胞凋亡的影响
表3 不同质量浓度菊米提取液对Caspase-3/7、Caspase-6酶活性的影响(±s)

表3 不同质量浓度菊米提取液对Caspase-3/7、Caspase-6酶活性的影响(±s)
注:与对照组比较,aP<0.05,aaP<0.01
组别对照组药物组(mg/mL)0.001 0.002 0.005 0.01酶活性(RLU)Caspase-3/7 548.01±25.51 891±67a1076.33±287.14a1314.31±206.09aa2067.34±267.49aaCaspase-6 629.67±78.03 885.02±86.31 1140.11±224.94a1203.33±216.71a1689.33±168.09aa
3 讨论
研究表明,肿瘤细胞凋亡的调节紊乱引起的细胞增殖与死亡的平衡失调,是导致人类多种恶性肿瘤发生发展的重要因素之一。故诱导和促进肿瘤细胞凋亡是治疗肿瘤的重要策略之一[4]。
菊米,据《增广本草纲目》记载,为处州一种山中野菊,土人采其蕾(蕊)干之,如半粒绿豆大,甚香且清圆黄亮。菊米具有多种独特的药理作用,如增强免疫力、清火明目、消热解暑、抗菌消炎平肝、降血压等。其含有的某些成分如黄酮、芹菜素等,均被报道具有抑制细胞增长和诱导细胞凋亡的抗肿瘤作用。本实验研究发现,菊米提取液在体外能明显抑制人结肠癌SW 620细胞的生长,且具有浓度依赖性。随着菊米提取液浓度由0.001 mg/mL增加至0.01mg/mL,存活的SW620细胞随之减少,细胞增殖抑制率由1.88%增至40.28%,这可能与其诱导细胞凋亡有关。随后,利用流式细胞术检测菊米提取液对SW 620细胞凋亡的影响,结果显示,菊米提取液可随着浓度的增加而使细胞凋亡率增大,经0.001mg/mL至0.01mg/mL的菊米提取液处理48 h后,其细胞凋亡率分别达到了对照组的1.3、2.0、2.7、3.8倍。在对SW620细胞Caspase-3/7酶及Caspase-6酶活性的检测实验中,证实了菊米提取液可通过诱导细胞凋亡而抑制肿瘤细胞的生长。以上实验结果与以往研究一致,提示菊米提取液确实可抑制SW 620细胞的增殖,诱导其凋亡,但究竟是提取液中的某一个成分,还是多个成分的共同作用,这有待进一步实验的研究证实。
细胞凋亡在控制细胞增殖、肿瘤发生和生长中起着关键性作用,是由基因控制的细胞自主性死亡过程。细胞凋亡是在基因调控下的一个严密完整的程序过程。Caspase家族在凋亡过程中起到关键性的作用,Caspase-3、Caspase-7与Caspase-6是主要的处于细胞凋亡下游的凋亡效应分子。Caspase-3是哺乳动物细胞凋亡中的关键蛋白酶,执行剪切细胞结构蛋白的作用,直接使细胞发生凋亡,是细胞凋亡过程中最重要的终末执行酶[5]。正常情况下,胞浆中 Caspase-3以无活 性 的 Caspase-3酶 原(Pro-CPP32)存在,只有当细胞发生凋亡时才变为有活性的Caspase-3。活化的Caspase-3进而酶切聚ADP-核糖聚合酶,最终导致DNA片段化致细胞凋亡。Caspase-7与Caspase-3在诱导肿瘤细胞凋亡的过程存在正相关,但在细胞凋亡级联反应中Caspase-7究竟位于Caspase-3的下游,还是平行关系,意见不一[6]。Caspase-6参与细胞凋亡的执行并可降低凋亡信号诱导细胞死亡的阈值,其与Caspase-3二者有38%同源性,二者是不同凋亡途径共同的下游路径,但二者的调控机制及相互关系并不十分明确[7]。Caspase-3蛋白早于Caspase-6蛋白的激活,并与Caspase-6蛋白的活化有密切关系,活化的Caspase-6蛋白反过来又能活化Caspase-3蛋白,形成对Caspase-3蛋白活化的正性循环[8]。本实验用荧光比色法观察到,随着菊米提取液浓度的增加,Caspase-3/7酶和Caspase-6酶活性的改变呈剂量依赖性增高,0.001mg/mL至0.01mg/mL的菊米提取液处理SW620细胞48 h后,其酶活性分别为对照组的1.6、1.9、2.4、3.7倍和1.4、1.8、1.9、2.7倍。更进一步说明诱导肿瘤细胞凋亡为菊米提取液发挥抗肿瘤作用的机制之一。但菊米提取液抑制肿瘤细胞增殖是否还有其他途径,尚待进一步的研究。
[1]Matsuda H,Morikawa T,Toguchida I,et al.Medicinal flowers.VI. Absolute stereostructrures of two new flavanone glycosides and a phenylbutanoid glycoside from the flowers of Chrysanthemum indi⁃cum L.:their inhibitory activities for rat lens aldose reductase[J]. Chem Pharm Bull(Tokyo),2002,50(7):972-975.
[2]叶挺梅,徐和靖,汪洋,等.菊米提取液舒张血管作用及其机制研究[J].中国病理生理杂志,2007,23(4):644-647.
[3]叶挺梅,陈文良,朱立,等.菊米提取液对抗心肌再灌住损伤[J].中国病理生理杂志,2008,24(12):2328-2332.
[4]胡会华,周士福,李青国.新辅助化疗中凋亡效应因子caspase-7、caspase-3及凋亡抑制因子survivin关系初探[J].中国综合临床, 2007,23(10):896-898.
[5]Cheng X,Liu H,Fang L,et al.2-DG enhances chemosensitivity of breast cancer cells to adriamycin[J].Chin Phaomacol Bull,2010, 26(10):1371-1376.
[6]Bressenot A,Marchal S,Bezdetnaya L,et al.Assessment of apopto⁃sis by immunohistochemistry to active caspase-3,active caspase-7, or cleaved PARP in monolayer cells and spheroid and subcutane⁃ous xenografts of human carcinoma[J].Histochem Cytodhem,2009, 57(4):289-300.
[7]Lee SC,Chan JY,Pervaiz S.Spontaneous and 5-fluorouracil-in⁃duced centrosome amplification lowers the threshold to resvera⁃trol-evoked apoptosis in colon cancer cells[J].Cancer Lett,2010, 288(1):36-41.
[8]Gazitt Y,Akay C.Arsenic trioxide:An anticancermissilewithmul⁃tiplewarheads[J].Hematology,2005,10(3):205-213.
(收稿:2011-07-22 修回:2011-11-20)
(责任编辑 刘洪斌)
Effect of Jumi Extraction on Proliferation and Apoptosis of Human Colon Cancer Cell Line SW620
SI⁃MA Jun,CHEN Jian,LIU Dan-dan,et al. Department of Surgery,Hangzhou Red Cross Hospital,Zhejiang Prov⁃ince,Hangzhou(310004),China
ObjectiveTo explore the effect of Jumi extract on proliferation and apoptosis of human colon cancer cell line SW620. Methods SW620 cells and culture media containing Jumi extract(0.001,0.002, 0.005,or 0.01 mg/mL)were co-incubated for 48 h.Cell proliferation rate,cell apoptosis,caspase-3/7 and cas⁃pase-6 activity were determined by methyl thiazolyl tetrazolium(MTT)colorimetric assay,flow cytometry analy⁃sis and spectrophotometric detection,respectively. Results The proliferation of SW620 cells was significantly inhibited by Jumi extract(0.001-0.01 mg/mL)in a dose-dependent manner.IC50 is 0.012mg/mL.Apoptosis rates in the cells treated with Jumi extract(0.001,0.002,0.005,or 0.01 mg/mL)were(6.46±0.02)%,(9.77± 0.01)%,(13.11±0.04)%and(18.47±0.05)%respectively,which were higher than those in the control group (4.83±0.01)%.Compared with the control group,caspase-3/7 and caspase-6 activity were significantly in⁃creased in all Jumi treated groups. Conclusion The Jumi extract can inhibit the proliferation of colon cancer cell line SW620 in vitro in a dose-dependent manner and promote cell apoptosis through caspase-3,caspase-7 and caspase-6 pathway.
Jumi extraction,Colon cancer,Proliferation,Apoptosis
Q95-33;R735.3+5
A
1007-6948(2012)01-0039-04
10.3969/j.issn.1007-6948.2012.01.012
浙江省中医药科技计划项目(2010ZB022);浙江省嘉兴市科技计划项目(2010AY1017);浙江省医药卫生科研基金项目(2008A033)
1.浙江省杭州红十字会医院普外科(杭州 310004)
2.浙江医学高等专科学校
仇 容,E-mail:zmzjjpdd181@sina.com
