(S-[11C]甲基)-D-半胱氨酸的自动合成与动物实验
2012-03-22王红亮黄婷婷唐刚华胡孔珍吴克宁
梁 祥 王红亮 黄婷婷 唐刚华 胡孔珍 吴克宁
(中山大学附属第一医院核医学科 广州 510080)
放射性标记氨基酸正电子发射断层(PET)和单光子发射计算机断层(SPECT)显像剂已应用于临床上,其与2-18F-2-脱氧-D-葡萄糖(18F-FDG)联用,可弥补18F-FDG的某些不足,有助于鉴别肿瘤组织与炎症或其他糖代谢旺盛病灶[1]。目前,应用的氨基酸PET显像剂绝大多数空间构型为L型。但是,Tamemasa等[2,3]报道了放射性标记D-氨基酸也可作为肿瘤显像剂。研究表明,2-[123I]碘代-D-苯丙氨酸(2-123I-D-Phe)[4,5]、[11C]D-蛋氨酸(11C-D-MET)[6]、O-([11C]甲基)-D-酪氨酸(11C-D-CMT)[6]、O-([18F]氟甲基)-D-酪氨酸(18F-D-FMT)[6,7]、O-2-([18F]氟乙基)-D-酪氨酸(18F-D-FET)[7]、O-(3-[18F]氟丙基)-D-酪氨酸(18F-D-FPT)[7]肿瘤显像优于各自相应的L-氨基酸。因此,标记D-氨基酸可望作为肿瘤氨基酸显像剂。本文报道(S-[11C]甲基)-D-半胱氨酸(11C-D-MCYS)的自动化合成与初步动物实验研究。
1 材料与方法
1.1 试剂与仪器
氢化铝锂(1.0 mol/L,LiAlH4)、氢碘酸(HI)、D-半胱氨酸(D-CYS,美国Sigma-Aldrich公司),其余试剂均为国产分析纯;Sep Pak Plus C18柱(美国Waters公司);GEMINIGXL-16型PET-CT扫描仪(北爱尔兰PHILIPS公司);安捷伦1200型分析型高效液相层析仪(美国Agilent公司);高效液相层析放射性检测仪(美国华盛顿Bioscan公司);FC3200型NaI高能PMT放射性检测器(美国华盛顿Bioscan公司);Cyclone10/5回旋加速器(比利时IBA公司);碳-11碘甲烷合成模块(PET-CS-I-IT-I) (北京派特生物有限公司);昆明种小鼠(雌性、清洁级、4-6周龄)、S180小鼠肉瘤细胞株(中山大学实验动物中心)。
1.2 11C-D-MCYS的自动化合成
由 PET回旋加速器生产11CO2,通过低温 N2捕集、释放、干燥后进入反应管。通入的11CO2与LiAlH4发生还原反应生成11CH3OH,再与HI发生取代反应生成11CH3I。11CH3I与前体D-CYS在Sep Pak Plus C18柱上发生烷基化反应生成11C-D-MCYS,其合成路线见图1。
由PET回旋加速器通过核反应14N(p,a)11C生产11CO2,然后传送到碘甲烷合成模块中。11CO2通过Loop环(液氮冷却至–160ºC )被捕集。移去液氮冷却环,通入He气(20 mL/min)并释放11CO2,经P2O5柱干燥后进入反应管。通入的11CO2与LiAlH4发生还原反应生成11CH3OH,再与HI发生取代反应生成11CH3I。在He气作用下,11CH3I被传输到Sep Pak Plus C18柱。
实验前,将3–4 mg 前体D-CYS溶于0.25 mL含0.5 mol/L NaOH的乙醇-水(体积比为1:1)溶液中,装载于Sep Pak Plus C18柱中。11CH3I在Sep Pak Plus C18柱上与D-CYS发生烷基化反应生成11CD-MCYS。用5 mL NaH2PO4(0.05 mol/L、pH=3–4)缓冲液洗脱Sep Pak Plus C18柱上的11C-D-MCYS,淋洗液通过一个Sep Pak Plus C18柱和0.22 μm过滤膜进入无菌瓶中,得到11C-D-MCYS注射液。
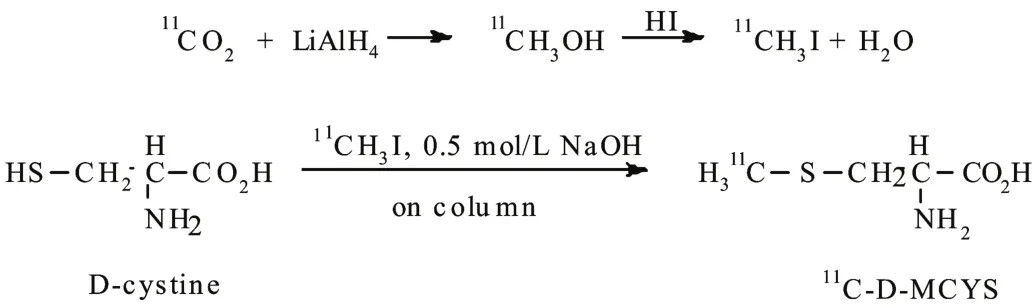
图1 11C-D-MCYS的合成路线Fig.1 Synthetic scheme of 11C-D-MCYS.
1.3 11C-D-MCYS的质量检验
用标准pH试纸测定注射液的pH值,目测其颜色和澄清度。使用放射性HPLC,反相分析型XDBC18柱(4.6´150 mm,5 µm)和NaI高能PMT放射性检测器测定放化纯度,流动相为 VA(3 mmol/L NaH2PO4):VB(甲醇)=45:55,流速为1 mL/min,254 nm UV 检测。
1.4 动物模型制作及PET-CT显像
无菌条件下在小鼠右大腿肌肉注射 0.2 mL松节油,3–4天右腿出现肌肉脓肿者为炎症模型;将S180小鼠肉瘤细胞株复苏后,培养3–4代,制成癌细胞悬浮液,调整浓度为1×107个/mL,取0.1 mL注射到小鼠右背皮下。接种后第10天,小鼠右背部可见明显肿块,瘤直径>1 cm入选为肿瘤模型。所有动物饲养于中山大学实验动物中心实验室动物房,恒温恒湿条件,定时给食。
腹腔注射10%的水合氯醛0.1 mL麻醉小鼠,待其意识消失,经尾静脉分别注射0.2 mL(3.7 MBq)的11C-D-MCYS和18F-FDG,固定于纸板上。于注射后15、30、45、60 min行PET-CT全身显像,经衰减矫正后,迭代重建获得横断面、矢状面、冠状面断层图像及MIP(maximum intensity projection)图像。
2 结果和讨论
2.1 11C-D-MCYS的自动化合成与质量检测
11CO2与LiAlH4发生还原反应后,再与HI发生取代反应生成11CH3I,未校正放化产率为65%–75%(n=4),放化合成时间约7.5–9.5 min;11CH3I与前体D-CYS在Sep Pak Plus C18柱上发生烷基化反应生成11C-D-MCYS,11C-D-MCYS未校正放化产率为(51±4)%(n=4),放化合成时间~2 min,总放化合成时间~12 min。11C-D-MCYS注射液为无色或浅黄色溶液(pH=6–8),11C-D-MCYS的放化纯度>99%。11C-D-MCYS HPLC图谱示于图2,其保留时间约1.8–2.3 min,标准品D-MCYS的保留时间约为1.5–1.9 min,11CH3I的保留时间约为5.8–6.5 min。本法制备11C-D-MCYS的步骤和工艺简单,可用于实现11C-D-MCYS的自动化合成,其注射液可用于动物实验。

图2 11C-D-MCYS放射性色谱(a)、紫外线色谱(b)和标准品D-MCYS紫外线色谱(c)Fig.2 Typical high-performance liquid chromatograms of 11C-D-MCYS and standard coinjection: radioactive chromatogram of 11C-D-MCYS (a) and ultraviolet chromatogram of 11C-D-MCYS(b) and standard D-MCYS (c).
2.2 动物PET-CT显像
11C-D-MCYS和18F-FDG PET-CT显像结果示于图 3,图中十字线中心指示肿瘤或炎症。小鼠尾静脉注射11C-D-MCYS后,放射性很快分布全身,腹部和膀胱的放射性较高。大量11C-D-MCYS聚集于膀胱,因此11C-D-MCYS主要经过泌尿系统排泄。炎症组织放射性摄取较低,在15 min时摄取较高,尔后呈降低趋势,60 min时炎症组织与对侧大腿肌肉的放射性摄取比值为 1.27±0.09(n=4);肿瘤组织摄取11C-D-MCYS明显高于周围正常组织,11C-DMCYS摄取随时间增加,60 min时肿瘤组织与对侧大腿肌肉的摄取比值为 4.04±1.01(n=4)。尾静脉注射18F-FDG后,炎症组织和肿瘤组织摄取18F-FDG明显高于周围正常组织,60 min时炎症组织和肿瘤组织与左大腿肌肉的摄取比值分别为3.13±0.32 (n=4)和 4.22±0.71(n=4)。因此,11C-D-MCYS在肿瘤显像方面具有一定的潜力,在区分炎症和肿瘤方面优于18F-FDG。
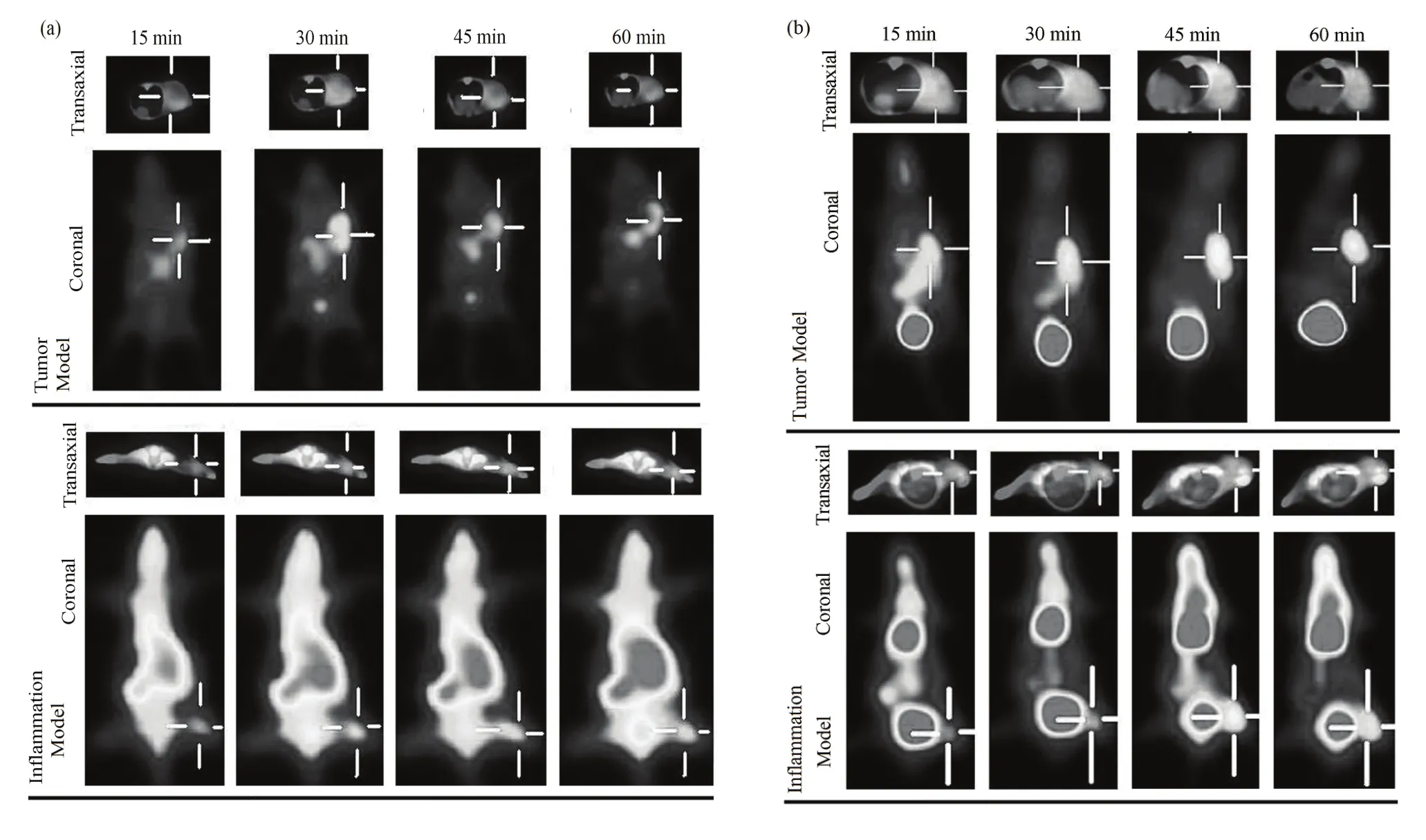
图3 肿瘤模型(上)和炎症模型(下)小鼠11C-D-MCYS PET-CT显像(a)和18F-FDG PET-CT显像(b)Fig.3 PET imaging of S180 sarcoma-bearing (upper) and aseptic inflammation(low) mice models with 11C-D-MCYS (a) and 18F-FDG (b).
2.3 组织病理检查
小鼠显像后,解剖取左侧肌肉、脓肿和肿瘤处组织进行切片检查(图4)。经H&E染色后镜下观察,左侧肌肉组织表现为横纹肌纤维有序排列,为正常组织(a);脓肿处组织表现为横纹肌组织中大量的炎症细胞浸润,为炎症组织(b);肿瘤处组织可见大量的异型性细胞,为肿瘤组织(c)。
放射性标记的氨基酸PET和SPECT显像剂已应用于临床,与18F-FDG联合应用可弥补18F-FDG的不足,有助于鉴别肿瘤组织与炎症或其他糖代谢旺盛病灶,但大多数临床应用的氨基酸显像剂空间构型为L型。文献[4–7]报道,放射性标记D-氨基酸如 2-123I-D-Phe、11C-D-MET、11C-D-CMT、18FD-FMT、18F-D-FET、18F-D-FPT等可用于肿瘤显像,优于各自对应的L-氨基酸。这些标记D-氨基酸为非蛋白质组成氨基酸,主要通过氨基酸转运机制被肿瘤摄取,很少参与蛋白质合成,且标记D-氨基酸在血液中能较快在体内清除,因而,标记D-氨基酸在肿瘤组织中摄取较高,而在炎症组织中摄取较低,并能获得较理想的肿瘤与本底放射性比值[4–7]。动物PET显像结果表明:S180肉瘤组织摄取11C-DMCYS比炎症组织高,与上述标记D-氨基酸有相类似的体内摄取现象。其可能原因在于:11C-D-MCYS为非蛋白质组成氨基酸,主要通过氨基酸转运机制被肿瘤组织较高摄取,仅少量参与蛋白质合成而造成炎症组织低摄取。因此,11C-D-MCYS在肿瘤显像方面具有一定潜力。11C-D-MCYS是11C-L-MCYS类似物,也可能与L-氨基酸转运系统(LAT1)具有高亲和力[8]。LAT1在多数肿瘤细胞中过度表达,而在炎症组织细胞中低表达,因而,11C-D-MCYS 有可能通过LAT1转运机制被S180肉瘤组织高度摄取,而被炎症组织低摄取,但11C-D-MCYS的转运作用机制有待进一步研究。
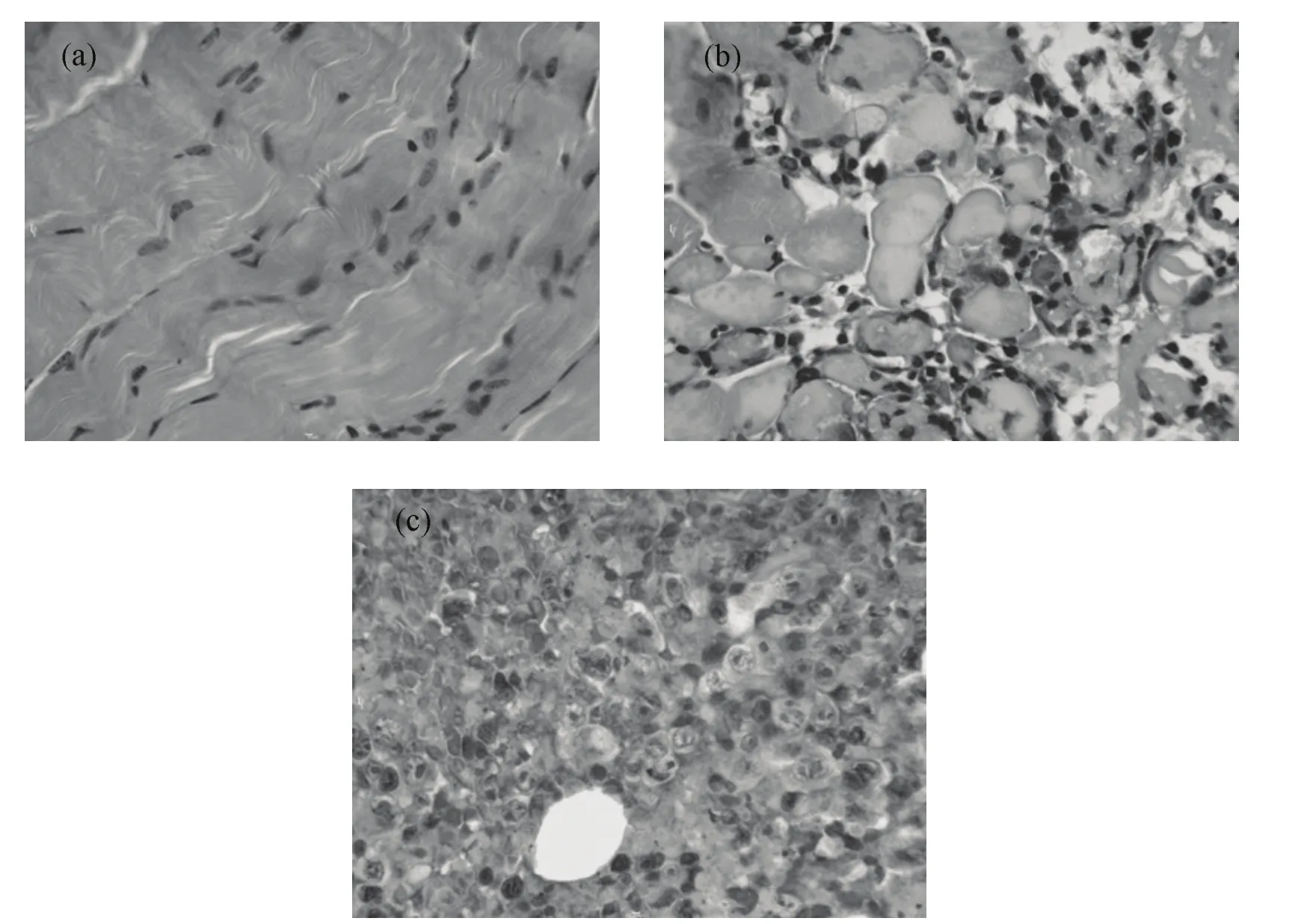
图4 小鼠正常肌肉组织(a)、炎症肌肉组织(b)和肿瘤组织(c)病理切片检查Fig.4 Microscopic histological examination of specimens excised from normal muscle (a), inflammatory muscle(b), and tumor tissue(c) in mice, stained by hematoxylin and eosin (HE) and magnified by×400.
3 结语
11CO2与LiAlH4发生还原反应后,与HI发生取代反应生成11CH3I。11CH3I与前体D-CYS在Sep Pak Plus C18柱上发生烷基化反应生成11C-D-MCYS,总放化合成时间约为12 min,放化纯度>99%。该法合成工艺简单、合成时间短、产率较高。PET显像显示,肿瘤组织高度摄取11C-D-MCYS,而炎症组织摄取低,表明11C-D-MCYS在肿瘤显像方面具有一定潜力。
1 Jager P L, Vaalburg W, Pruim J, et al. Radiolabeled amino acids: basic aspects and clinical applications in oncology [J]. J Nucl Med, 2001, 42(3): 432–445
2 Tamemasa O, Goto R, Suzuki T. Preferential incorporation of some11C-labeled D-amino acids into tumor bearing animals[J]. Gann, 1978, 69(4): 517–523
3 Tamemasa O, Goto R, Taketa A, et al. High uptake of11C-labelled D-amino acids by various tumors[J]. Gann, 1982, 73(1): 147–152
4 Kersemans V, Cornelissen B, Bacher K, et al. In vivo evaluation and dosimetry of123I-2-Iodo-D-Phenylalanine, a new potential tumor-specific tracer for SPECT, in an R1M rhabdomyosarcoma athymic mouse model[J]. J Nucl Med, 2005, 46(12): 2104–2111
5 Bauwens M, Keyaerts M, Lahoutte T, et al. Intraindividual comparison of the human biodistribution and dosimetry of the D and L isomers of 2-[123I]iodophenylalanine[J]. Nucl Med Commun, 2007, 28(10): 823–828
6 Tsukada H, Sato K, Fukumoto D, et al. Evaluation of D-Isomers of O-11C-Methyl tyrosine and O-18FFluoromethyl tyrosine as Tumor-Imaging agents in tumorbearing mice: comparison with L-andD-11C- Methionine [J]. J Nucl Med, 2006, 47(4): 679–688
7 Tsukada H, Sato K, Fukumoto D, et al. Evaluation of D-isomers of O-18F-fluoromethyl, O-18F-fluoroethyl and O-18F-fluoropropyl tyrosine as tumor imaging agents in mice[J]. Eur J Nucl Med, 2006, 33(9): 1017–1024
8 Deng H, Tang X, Tang G, et al. S-11C-Methyl-L-Cysteine: A new amino acid PET tracer for cancer imaging[J]. J Nucl Med, 2011, 52(2): 287–293
