非接触调频模式AFM的发展及生物学应用
2012-03-22张金金
李 林 张金金 胡 钧
(中国科学院上海应用物理研究所 上海 201800)
原子力显微镜(AFM)是用探针针尖和样品表面原子间的范德华力呈现样品表面特征的扫描探针显微镜,能对金属、半导体和绝缘体表面进行成像。在材料科学领域,AFM为了解材料的表面形貌特征提供了直接依据;在生物领域,AFM对不同环境下生物分子结构在纳米尺度上的成像发挥了重要作用[1–3]。AFM的成像模式有接触模式、轻敲模式和非接触调频模式。非接触调频模式AFM具有分子和原子级别的成像分辨能力[4,5],样品几乎不受到影响和损伤,即使对软物质表面也能进行高分辨成像,从而使AFM的应用跨前了一步。
1 非接触调频模式AFM在真空中的高分辨成像
非接触调频模式AFM的成像原理是:当探针靠近样品表面时,由于范德华力的作用,探针悬臂的共振峰会发生偏移,探测该频率偏移并维持其恒定,可进行反馈成像[5]。系统流程如图1所示。非接触调频模式AFM的成像参数为探针悬臂振幅、成像频率偏移和频率偏移基准。为实现高分辨,通常先设定频率偏移基准为零,再细微调节探针悬臂振幅和成像频率偏移,优化成像条件。须注意的是,探针悬臂振幅减小时,最大成像频率偏移会增加。
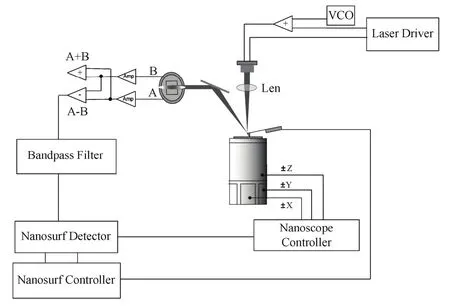
图1 非接触调频模式AFM系统流程图Fig.1 Schematics of non-contact frequency-modulation AFM.
图2(a)为扫描隧道显微镜(STM)对硅晶体(111)-(7×7)表面的成像图(横坐标为扫描范围),每一硅晶格呈菱形,含有12个硅原子,菱形对角线分别为4.66和2.69 nm;图2(b)是非接触调频模式AFM在真空中对该样品表面的高分辨成像图,图像中上部可清晰分辨出单个硅原子和五个硅晶格,且每个晶格内硅原子的排布情况与扫描隧道显微镜图像一致。这也证实非接触调频模式AFM在真空中可实现对晶体表面原子级的分辨率。图中分辨率较低的部位,由系统稳定性和探针尖端的多针尖现象造成。扫描开始时是多针尖探针,成像分辨率不高;扫至中上部时,多针尖变为单针尖,信噪比大大提高,从而实现了原子级的分辨率。表明虽然非接触调频模式AFM实现了在真空中对平整晶体表面的原子级分辨率成像,但将它应用于单个、起伏较大的单分子成像会遇到技术瓶颈,即系统的稳定性和探针尖端的锐利程度。

图2 硅晶体(111)-(7×7)表面的STM图像(a)和真空中非接触调频模式AFM图像Fig.2 Images of Si(111)-(7×7) surface by scanning tunneling microscope (a), and by non-contact frequency-modulation AFM in vacuum(b).
非接触调频模式AFM难以实现单分子的高分辨成像,这是因为单个分子在纵向上起伏较大,很易由于系统不稳定导致探针针尖与样品表面的接触,使样品变形甚至损坏,同时探针锐利的针尖也被破坏。最近,科研工作者将非接触调频模式AFM放入真空超低温环境中,实现了单分子成像[6],由于温度仅为5 K,探针悬臂的热漂移非常小,系统稳定性大大增强。另外,探针尖端吸附一氧化碳分子,可得到更锐利的尖端[7],从而避免出现多针尖,使成像过程中始终保持单针尖扫描样品。同时,为达到高分辨成像,探针针尖与样品表面必须十分接近,因此,探针悬臂得以非常小的振幅稳定振动,须选择悬臂弹性系数很大的探针进行成像。图3(c)和(d)为非接触调频模式AFM在真空低温环境下实现对铜(111)表面上五苯环的单分子超高分辨成像[6],与图3(b)中扫描隧道显微镜对该样品的成像图像相比,具有更高的分辨率,可清晰分辨出组成每个苯环的各个原子。证实了非接触调频模式AFM在真空低温下实现了对单分子的超高分辨成像,为其结构研究提供了直接证据。

图3 五苯环模型(a)与五苯环的STM图像(b),真空低温下非接触调频模式AFM的单分子级分辨成像(c,d)Fig.3 Model (a) and STM image (b) of the pentacene molecule, and single molecule resolution of pentacene molecule by non-contact frequency-modulationAFM in vacuum and cryo-temperature (c,d).
2 非接触调频模式AFM的溶液中高分辨成像
非接触调频模式AFM的高分辨成像能力,且其探针与样品间的相互作用力较小,故在生物学研究中的受到青睐,同时,为保持生物样品(如磷脂双分子层、蛋白质等)的结构,需在生理环境中进行成像。
AFM 的接触模式和轻敲模式实现了对磷脂双分子层、DNA、蛋白质等生物样品在溶液中的成像[8–13],为生物学研究提供了有用信息。但是,对单个生物大分子至今尚未实现纳米/亚纳米级分辨率的突破,其解析能力和应用范围受到极大限制。对于接触式 AFM,即便使用最软的悬臂探针(弹性系数k ≈ 0.01 nN/nm),由于悬臂本身的热噪声和仪器本底噪声,实现稳定成像所需的力再小也得10–50 pN,而高分辨需很尖锐的探针,则形成的压强很高。例如,若分辨率为1 nm,直接接触的面积约1 nm2,若接触力为10 pN,其压强约为100大气压。自然状态下的蛋白分子及生物样品的杨氏模量较小,此压强将导致生物样品的巨大形变,甚至破坏生物分子结构;还将导致尖锐探针顶端损坏,降低系统的点分辨能力。这是接触模式和轻敲模式AFM 无法对生物大分子获得超高分辨率图像的根本原因。
基于非接触调频模式AFM较高的灵敏度、较小的探针与样品间的接触力,Fukuma等[14,15]发展了一套适合在生理环境中成像的非接触调频模式AFM系统。众所周知,激光二极管的主要噪音来源于模跳跃(mode hopping),对于非接触调频模式AFM成像,尤其是微振幅操作,这个噪音造成震荡回路偏离,直接导致系统失稳。为了尽可能减小甚至消除此类噪声,射频干涉是有效方法之一。如图4(a)所示,在激光驱动信号中耦合一个300 MHz的射频信号,快速关闭激光二极管,从而减少模跳跃效应。前置处理电路中的带通滤波器则减小电路噪声,提高信噪比。通过硬件改进,非接触调频模式AFM 在溶液中对云母成像就能达到原子级分辨率[15](图4b)。
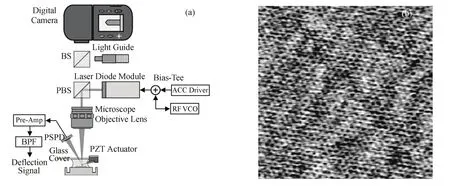
图4 溶液中成像的非接触调频模式AFM系统图(a)及其对云母的原子级分辨率图像(b)Fig.4 Schematics of non-contact frequency-modulation AFM for imaging in solution (a) and the atomic resolution of mica by this system (b).
3 非接触调频模式AFM在生物结构研究中的应用
常规模式AFM实现了大范围磷脂双分子层[12]、不同磷脂混合双分子层[13]及磷脂双分子层不同相变的成像[16],但对磷脂头部排布结构一无所知。非接触调频模式AFM在溶液中实现了对磷脂双分子层DPPC的高分辨成像[17]。DPPC磷脂双分子层由两条十六个碳原子组成的碳链和一个磷脂头部组成。如图 5,每个磷脂头部排布成六边形形状,通过A到B的长度和高度测量可知,磷脂头部中心距离为0.49 nm。DPPC磷脂双分子层磷脂头部的结构信息,为研究其功能提供了有力证据。
非接触调频模式AFM在生理环境中实现了对单个蛋白大分子的高分辨成像[18,19]。我们知道,蛋白质是细胞中的主要功能分子,发挥多种多样的功能,如催化作用、参与生物体内新陈代谢的调剂作用、运输代谢物质的作用等。而人类免疫球蛋白是对人体免疫功能有重要作用的一种蛋白质,对其结构的解析具有重要意义[20,21]。图6为非接触调频模式AFM在溶液中对人类免疫球蛋白IgM的高分辨成像[18],每一个分子呈中间凸出的结构,高度~6 nm,图像分辨率~2 nm。表明非接触调频模式AFM可在溶液中对单个蛋白大分子实现高分辨成像,为它在生物结构学的应用拓宽了道路。
4 结论与展望
非接触调频模式AFM的发展为我们在纳米尺度上的研究提供了有用工具,也为生物结构学的研究提供了直接依据。
对于生物大分子结构,10Å是一个非常重要的分辨率指标,蛋白大分子的二级结构,通常都需10Å或稍高(亚纳米)的分辨率才可明确解析。从这个意义上说,对于分辨率从15Å增至10Å,对于结构生物学的意义就能成指数级上升,因为与机理相关的结构变化及分子间的相互作用,大多在这个结构层次上发生。所以,在生理条件下实现蛋白大分子以及细胞表面膜(生命科学中最具挑战的复杂结构之一)的纳米/亚纳米级高分辨率成像,是单分子结构生物学的重要目标之一。相信不久的将来,通过仪器的发展,必然可对生物样品实现10Å以上的分辨率,从而对基础生物学、新药研发以及生物学核心科学命题作出贡献,并进而发展成为结构生物学中一个重要的普适技术方法。
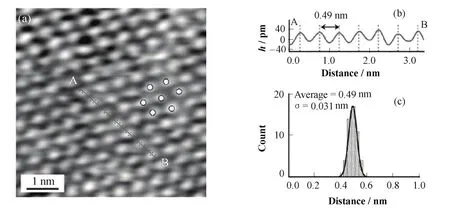
图5 非接触调频模式AFM对DPPC磷脂双分子层的高分辨成像(a) 在溶液中的成像图,可分辨出单个磷脂头部,(b), (c) 测量磷脂头部中心距离为0.49 nmFig.5 The high resolution imaging of DPPC bilayer in solution by non-contact-frequency modulation AFM.(a) The high resolution image of DPPC bilayer in solution by non-contact frequency-modulation AFM. The single headgroup is seeable, (b, c) The central distance of two headgroups is 0.49 nm by lateral measurement.
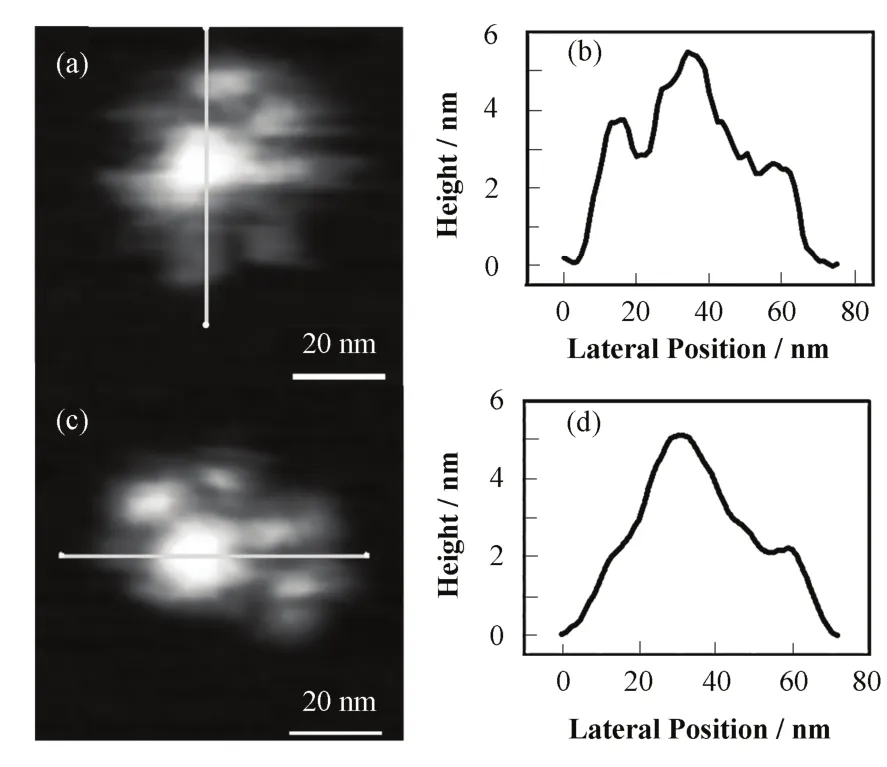
图6 非接触调频模式AFM对人类免疫球蛋白IgM的高分辨图像(a,c)以及IgM分子的中间凸起结构(b,d)Fig.6 The high resolution images (a,c) of IgM by non-contact frequency-modulationAFM, and the measurement of IgM molecule higher central part structure (b,d).
1 Binnig G, Rohrer H, Gerber Ch, et al. Tunneling through a controllable vacuum gap[J]. Appl Phys Lett, 1982, 40(2): 178–180
2 Binnig G, Rohre H, Gerber Ch, et al. Surface studies by scanning tunneling microscopy[J]. Phys Rev Lett, 1982, 49(1): 57–61
3 Binnig G, Quate C F, Gerber Ch, Atomic force microscope[J]. Phys Rev Lett, 1986, 56(9): 930–933
4 Giessibl F J, Trafas B M. Piezoresistive cantilevers utilized for scanning tunneling and scanning force microscope in ultrahigh vacuum[J]. Rev Sci Instrum, 1994, 65(6): 1923–1929
5 Giessibl F J. Atomic resolution of the silicon (111)-(7×7) surface by atomic force microscopy[J]. Science, 1995, 267(5194): 68–71
6 Gross L, Mohn F, Moll N, et al. The chemical structure of a molecule resolved by Atomic Force Microscopy[J]. Science, 2009, 325(5944): 1110–1114
7 Lee H J, Ho W. Single-bond formation and characterization with a scanning tunneling microscope[J]. Science, 1999, 286(5445): 1719–1722
8 Lyubchenko Y L, Gall A A, Shlyakhtenko L S, et al. Atomic force microscopy imaging of large double stranded DNA molecules[J]. Biophys J, 1992, 61(6): A149
9 Bustamante C, Vesenka J, Tang C L, et al. Circular DNA molecules imaged in air by scanning force microscopy[J]. Biochemistry, 1992, 31(1): 22–26
10 Henderson E. Imaging and nanodissection of individual supercoiled plasmids by atomic force microscopy[J]. Nucleic Acids Res, 1992, 20(3): 445–447
11 Butt H J, Downing K H, Hansma P K. Imaging the membrane protein bacteriorhodopsin with the atomic force microscope[J]. Biophys J, 1990, 58(6): 1473–1480
12 Zasadzinski J A, Helm C A, Longo M L, et al. Atomic force microscopy of hydrated phosphatidylethanolamine bilayers[J]. Biophys J, 1991, 59(3): 755–760
13 Garnaes J, Schwartz D K, Viswanathan R, et al. Domain boundaries and buckling superstructures in Langmuir-Blodgett films[J]. Nature, 1992, 357(6373): 54–57
14 Fukuma T, Kimura M, Kobayashi K, et al. Development of low noise cantilever deflection sensor for multienvironment frequency-modulation atomic force microscopy[J]. Rev Sci Instrum, 2005, 76(5): 053704
15 Fukuma T, Jarvis S P. Development of liquid-environment frequency modulation atomic force microscope with low noise deflection sensor for cantilevers of various dimensions[J]. Rev Sci Instrum, 2006, 77(4): 043701
16 Pedersen T B, Kaasgaard T, Jensen M, et al. Phase behavior and nanoscale structure of phospholipid membranes incorporated with Acylated C14-Peptides[J]. Biophys J, 2005, 89(4): 2494–2503
17 Asakawa H, Fukuma T. The molecular-scale arrangement and mechanical strength of phospholipids /cholesterol mixed bilayers investigated by frequency modulation atomic force microscopy in liquid[J]. Nanotechnology, 2009, 20(26): 264008
18 Martinez-Martin D, Herruzo E T, Dietz C, et al. Noninvasive protein structural flexibility mapping by bimodal dynamic force microscopy[J]. Phys Rev Lett, 2011, 106(19): 198101
19 Yamada H, Kobayashi K, Fukuma T, et al. Molecular resolution imaging of protein molecules in liquid using frequency modulation atomic force microscopy[J]. Appl Phys Express, 2009, 2(9): 095007
20 Boes M, Prodeus A P, Schmidt T, et al. A critical role of natural immunoglobulin M in immediate defense against systemic bacterial infection[J]. J Exp Med,1998, 188(12): 2381–2386
21 Beutner U, Lorenz U, Illert B, et al. Neoadjuvant therapy of gastric cancer with thehumanmonoclonal IgM antibody SC-1: Impact on the immune system[J]. Oncol Rep, 2008, 19(3): 761–769
