反义miR-196a对人胰腺癌PANC-1细胞侵袭和迁移的抑制作用*
2012-03-17张世能庄晓虹庄燕妍黄凤婷陈文博程文捷
张世能, 庄晓虹, 唐 健, 庄燕妍, 黄凤婷, 陈文博, 程文捷
(1中山大学孙逸仙纪念医院消化内科,广东广州510120;2海南省农垦总医院肿瘤血液科,海南海口571103)
微小RNA(microRNA)是一类真核生物内源性小分子单链非编码RNA,长度通常为18~25个核苷酸,microRNA通过转录后调控机制抑制靶基因表达而发挥“癌基因”或“抑癌基因”作用[1]。胰腺癌早期诊断困难,易发生转移,预后恶劣。既往胰腺癌的分子机制研究多关注于编码基因的作用,随着非编码RNA与肿瘤发生发展相关性研究的不断深入,业已显示胰腺癌存在特异的microRNA表达谱,研究表明血清miR-196水平与胰腺癌预后相关[2]。采用化学合成的反义microRNA,可以特异地靶向敲除单个的microRNA分子,从而达到下调某microRNA活性的目的[3]。本研究中,我们首先检测胰腺癌细胞系miR-196a的表达状况,在此基础上,采用脂质体转染化学合成的反义miR-196a,观察反义miR-196a对胰腺癌细胞PANC-1体外增殖、侵袭和迁移能力的影响作用及其机制,以期探讨胰腺癌转移的新机制和防治的新靶点。
材料和方法
1 细胞及主要试剂
人胰腺癌细胞系CAPAN-2、BXPC-3、SW1990和PANC-1由中山大学孙逸仙纪念医院消化实验室保存,体外培养传代。永生化人胰腺导管上皮细胞系H6c7由加拿大安大略癌症研究所Prof.Mingsound Tsao惠赠,体外培养传代。miR-196a(货号: 4373104)及其引物 RNU6B(货号:4363381)购自ABI。反义miR-196a和miR-negative control(NC)购自上海吉玛公司。LipofectamineTM2000(Lipo)、Opti-MEM培养基、K-SFM培养基、反转录酶试剂盒(SuperScriptTMIII Reverse Transcriptase Kit)和PCR试剂购自Invitrogen。DMEM液体培养基、重组表皮生长因子 (recombinant epidermal growth factor,rEGF)、牛垂体提取物(bovine pituitary extract,BPE)、胎牛血清(fetal bovine serum,FBS)和牛血清白蛋白(bovine serum albumin,BSA)购自Gibco。Transwell板购自Corning。
2 主要方法
2.1 细胞培养 人胰腺癌细胞系培养于含10%胎牛血清的DMEM培养液,在37℃、5%CO2、饱和湿度条件下培养,每2~3 d换液或传代1次,以0.02% EDTA和0.25%胰蛋白酶的1∶1混合液消化,完全培养基中和。H6c7细胞培养于K-SFM培养基(含1×105U/L青霉素、100 mg/L链霉素、0.2 μg/L rEGF和20 mg/L BPE)在37℃、5%CO2、饱和湿度条件下培养,采用0.05%胰蛋白酶消化,以0.4%BSA 1∶1中和。
2.2 实验分组 反义miR-196a组:使用Lipo将反义miR-196a转染入PANC-1细胞(终浓度100 nmol/L);miR-NC组:使用Lipo将miR-NC(终浓度100 nmol/L)转染入PANC-1细胞;Lipo组:仅转染Lipo的PANC-1细胞;空白组:常规培养的PANC-1细胞,不加Lipo和microRNA片段。各组在转染后24 h、48 h和72 h,观察细胞增殖情况,转染后48 h检测细胞凋亡和细胞迁移能力。
2.3 实时荧光定量PCR检测miR-196a表达 分别收集各组细胞,采用 Trizol一步法提取细胞总RNA,异丙醇法浓缩RNA,琼脂糖凝胶电泳法检测RNA的完整性。取2 μg总RNA,用SuperScriptTMIII Reverse Transcriptase Kit逆转录合成 cDNA,应用LightCycler 480型实时荧光定量PCR仪(Roche)进行PCR定量检测。PCR条件:95℃15 s,60℃30 s,74℃ 30 min,40个循环。记录每个反应管中的荧光信号到达所设域值所经历的循环数,即Ct值;以U6作为内参照,采用定量PCR中的相对定量法,各组细胞中miR-196a相对表达率采用2-ΔΔCt法计算。
2.4 细胞计数试剂盒-8(cell counting kit-8,CCK-8)检测细胞增殖 具体方法参照CCK-8试剂盒说明书进行。将PANC-1细胞按1×104cells/well接种于96孔培养板(100 μL/well)中,适时转染,分别于转染后24 h、48 h和72 h,每孔加入10 μL CCK-8试剂,5%CO2、37℃的细胞培养箱中孵育4 h,终止孵育,上机检测(以培养基+10 μL CCK-8作为空白调零孔)。在酶联免疫检测仪上测定各孔450 nm和630 nm双波长处吸光度(A)。每组设4个复孔,实验重复3次。
2.5 流式细胞术检测细胞凋亡 各组转染后48 h,制备单细胞悬液,4℃ 1 000 r/min离心5 min,弃上清,PBS洗涤、离心、重悬,调整细胞密度为1×109/ L。按照Annexin V/碘化丙啶(propidium iodide,PI)试剂盒说明书染色后使用流式细胞术分析细胞凋亡情况,结果以凋亡细胞百分率(%)表示。实验重复3次。
2.6 Transwell检测细胞侵袭能力 取出Matrigel,在冰上融化,按1∶8稀释(用不完全DMEM),取50 μL在Transwell上室制备人工基底膜,置37℃、5% CO2细胞培养箱4 h后备用。各组细胞用无血清高糖DMEM培养基洗2次后,调整细胞密度为109/L,各取100 μL接种到Transwell小室内,每组重复3孔;同时在24孔板内(下室)加入500 μL含20% FBS的DMEM高糖培养基作为趋化因子。培养8 h后取出小室,用棉签擦去上层细胞,4%多聚甲醛固定15 min,PBS洗2次,0.1%结晶紫染色15 min;洗涤残余染料,倒置显微镜观察并拍照,每组随机选取10个视野计数,实验重复3次。
2.7 Transwell细胞迁移实验 除不用Matrigel在Transwell上室制备人工基底膜外,余下方法同前侵袭实验。每组设3个复孔,实验重复3次。
2.8 萤光素酶报告基因的检测 microRNA靶点预测软件(PicTar、TargetScan和miRanda)提示核因子κB抑制蛋白α(nuclear factor κB inhibitor α,NFKBIA)mRNA 3'UTR的390~396位点是miR-196a的可能结合位点(binding site,BS)。体外合成该位点的DNA片段并将该序列插入到psi-CHECKTM-2载体(Promega)海肾萤光素酶编码基因的下游,构建成野生型NFKBIA的3'UTR萤光素酶表达载体。根据microRNA与靶基因结合的特点,设计引物对miR-196a与NFKBIA的3'UTR相结合的种子序列区进行突变,构建成突变型NFKBIA的3'UTR萤光素酶表达载体。将构建好的载体转入DH5α感受态细胞中,将菌液涂布于含氨苄青霉素(100 mg/L)的LB培养皿过夜培养。挑取单克隆菌落经99℃、5 min热裂解,取上清做PCR鉴定阳性克隆,并以质粒小量提取试剂盒提取质粒进行Xho I和Not I双酶切和测序鉴定,酶切产物以含溴化乙啶的1%琼脂糖凝胶电泳分离,UVP凝胶成像系统成像。载体鉴定成功后,将野生型/突变型NFKBIA的3'UTR萤光素酶表达载体与反义 miR-196a/对照 microRNA共转染PANC-1细胞,每组重复3复孔。转染后48 h,使用双萤光素酶检测试剂盒(E1910,Promega)检测海肾萤光素酶的活性,同时检测萤火虫荧光素酶活性作为内参照。
3 统计学处理
结果
1 miR-196a在胰腺癌细胞系及H6c7中的表达
本实验以永生化正常胰腺导管上皮H6c7细胞为阳性对照,检测胰腺癌细胞系CAPAN-2、BXPC-3、SW1990和PANC-1中miR-196a的表达,结果显示:与H6c7细胞相比,人胰腺癌细胞系中miR-196a的表达水平明显上调,见图1。本课题选择PANC-1为进一步的研究对象。
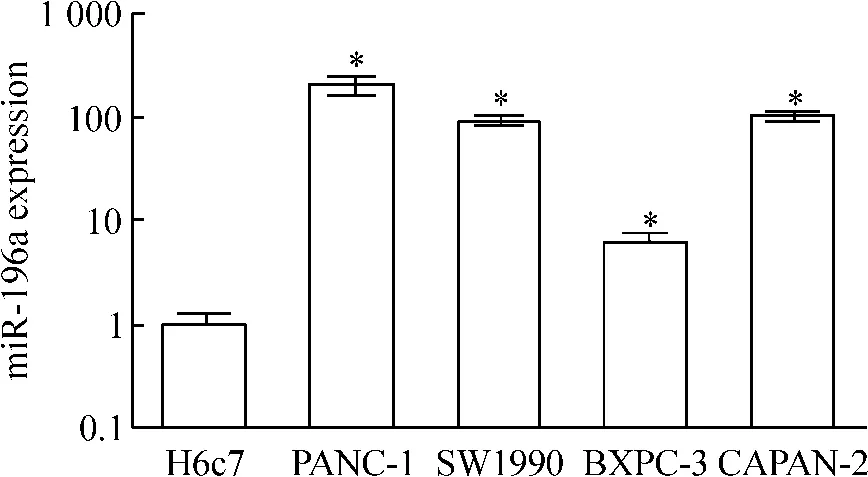
Figure 1.Overexpression of miR-196a in pancreatic cancer cells.±s.n=3.*P<0.05 vs H6c7.图1 胰腺癌细胞miR-196a的过表达
2 转染反义miR-196a后PANC-1细胞中miR-196a的表达变化
如图2所示,定时荧光定量PCR检测结果表明,若以miR-NC组细胞的miR-196a表达量作为1,反义miR-196a转染组PANC-1细胞miR-196a表达量约为0.2,明显下调近80%(P<0.01)。而其它3组之间比较,差异无统计学意义。

Figure 2.Anti-miR-196a down-regulated the expression of miR-196a in PANC-1 cells.±s.n=3.**P<0.01 vs other groups.图2 反义miR-196a的转染下调PANC-1细胞miR-196a的表达
3 转染反义miR-196a对PANC-1细胞增殖和凋亡的影响
CCK-8法检测转染后的PANC-1细胞的各组间的细胞增殖能力,对各组所测得的A值进行统计学分析发现各组间的差异没有统计学意义(P>0.05)。流式细胞术检测各组细胞凋亡率,结果显示:反义miR-196a转染组细胞凋亡率为15.45%± 7.99%,miR-NC组为15.57% ±5.45%,Lipo组为14.47%±6.47%,空白组为9.79% ±4.40%,见图3。统计学分析显示各组细胞凋亡率无显著差异(P>0.05)。这些结果表明反义 miR-196a转染对PANC-1细胞体外增殖和凋亡无显著影响。

Figure 3.Inhibitory effect of miR-196a down-regulation on the apoptosis of PANC-1 cells 48 h after transfection detected by flow cytometry.A:blank control group;B:Lipo group;C:miR-NC group;D:anti-miR-196a group.图3 流式细胞术检测转染反义miR-196a对PANC-1细胞凋亡的影响
4 转染反义miR-196a对PANC-1细胞侵袭和迁移能力的影响
在200倍光镜下观察可见空白组细胞有一定的侵袭和迁移能力,48 h每个视野下侵袭(迁移)数为106.3±11.2(61.0±5.0),Lipo组为97.1±13.8 (56.0±7.0),miR-NC组为98.2±12.9(58.2± 5.6),反义 miR-196a组为 56.3±7.1(32.3± 4.6)。与其它3组比较,反义miR-196a组细胞侵袭和迁移能力明显受抑(P<0.01),而其它3组之间比较差异无统计学意义(P>0.05),见图4。
5 双萤光素酶报告基因的检测
生物信息学软件预测NFKBIA可能是 miR-196a的靶基因之一,见图5。根据预测结果构建双萤光素酶报告基因载体导入DH5α感受态细胞中。培养后挑取单克隆菌落进行酶切鉴定和测序显示构建成功,见图6。将构建成功的双萤光素酶报告基因载体转染入PANC-1细胞48 h后,分别检测海肾萤光素酶和萤火虫萤光素酶活性,并使用内参萤火虫萤光素酶对海肾萤光素酶活性进行标准化校正。结果显示:共转染野生型NFKBIA的3'UTR和反义miR-196a可使海肾萤光素酶相对活性较共转染野生型NFKBIA的3'UTR和对照microRNA者显著降低(P<0.05),而共转染突变型NFKBIA的3'UTR和miR-196a则较之无明显差异(P>0.05),见图7。
讨论
研究表明胰腺癌存在独特的microRNA表达谱。zhang等[4]报道了8个microRNA在所研究的标本中表达的阳性率达到70%~100%,表达上调差异性在3~2 018倍。它们是miR-196a、miR-190、miR-186、miR-221、miR-222、miR-200b、miR-15b和 miR-95。本课题组前期采用博奥公司和康成公司的芯片分别检测了胰腺癌组织和胰腺癌细胞中的microRNA表达谱,显示miR-196a是一个在胰腺癌中表达异常增高的microRNA[5]。

Figure 4.Inhibitory effect of miR-196a down-regulation on PANC-1 cell invasion(×200).A:blank control group;B:Lipo group;C:miR-NC group;D:anti-miR-196a group.图4 体外Transwell迁移实验观察下调miR-196a后对PANC-1细胞侵袭能力的抑制作用

Figure 5.Identification of NFKBIA as an miR-196a target by TargetScan program.图5 生物信息学分析NFKBIA是miR-196a的靶基因之一
miR-196a与多种肿瘤的发生发展可能有关。Dou等[6]通过SNP分析显示miR-196a多态性与神经胶质瘤的发病风险明显相关。Peng等[7]的研究发现miR-196a-2突变的纯合子CC与胃癌淋巴结转移高度相关。另有研究发现 miR-196a与白血病[8]、食管癌[9]、结肠癌[10]等肿瘤的分化、增殖、凋亡和迁移相关。虽然miR-196a在胰腺癌中呈高表达,且有研究表明miR-196a-2表达与胰腺癌预后相关,但是miR-196a在胰腺癌中的作用远没有被阐明。本研究通过直接瞬时转染microRNA对miR-196a功能进行了检测,该法优点在于化学合成反义microRNA简便、快捷,可避免构建表达载体的步骤,从而有效提高特定microRNA的表达。本研究将反义miR-196a转染入PANC-1细胞内,使细胞内miR-196a表达下调,结果显示反义miR-196a转染后对PANC-1细胞增殖和凋亡无明显影响,但对细胞体外迁移能力具有明显抑制作用。
为了解miR-196a影响细胞侵袭迁移能力的可能机制,我们构建含野生型或突变型NFKBIA的3' UTR萤光素酶表达载体,结果显示:共转染野生型NFKBIA的3'UTR和反义miR-196a可使海肾萤光素酶相对活性较共转染野生型NFKBIA的3'UTR和对照microRNA者显著降低,而共转染突变型NFKBIA的3'UTR和miR-196a则较之无明显差异。NFKBIA是IκB家族的重要成员之一,在静息状态下,存在于细胞胞浆中,与NF-κB的二聚体组成三聚体滞留于胞质中而处于无活性状态。当细胞受到外源性刺激时,IκB迅速降解,NF-κB被激活且从三聚体中释放出来,借助于核定位信号进入细胞核发挥基因转录调控作用。NFKBIA在多种肿瘤如前列腺癌、结直肠癌和胶质母细胞瘤中呈低表达。最近Bredel等[11]研究表明在胶质母细胞瘤中NFKBIA常缺失,但不突变;NFKBIA缺失对胶质母细胞瘤发病的影响类似于EGFR扩增,和生存期相对较短相关。本研究初步显示miR-196a可能参与胰腺癌细胞转移潜能的调控,反义miR-196a可提高NFKBIA的表达,间接阻止NF-κB信号转导通路的转导进而抑制其下游基因的表达,从而抑制胰腺癌细胞的侵袭转移,我们将进一步开展体内动物实验和NF-κB信号通路相关基因的检测以证实上述假设。

Figure 6.The electrophoresis of NFKBIA vector and double digestion for identification.M1:DL2000 DNA marker; Lane 1:original plasmid;Lane 2:plasmid with double digestion;M2:1 kb DNA marker;yellow arrow: NFKBIA;red arrow:psi-CHECKTM-2 vector.图6 NFKBIA双萤光素酶报告基因双酶切鉴定电泳图

Figure 7.The cotransfection of wild-type NFKBIA 3'-UTR and anti-miR-196a significantly down-regulated the relative activity of Renilla luciferase(Rluc)normalized to firefly luciferase(Fluc)compared with other groups,while there was no significant difference when cotransfected with mutant-type NFKBIA 3'-UTR and anti-miR-196a.±s.n=3.*P<0.05 vs other groups.图7 双萤光素酶报告基因的检测
[1] Hanahan D,Weinberg RA.Hallmarks of cancer:the next generation[J].Cell,2011,144(5):646-674.
[2] Kong XY,Du YQ,Wang GK,et al.Detection of differentially expressed microRNAs in serum of pancreatic ductal adenocarcinoma patients:miR-196a could be a potential marker for poor prognosis[J].Dig Dis Sci,2011,56 (2):602-609.
[3] 郭 敏,李育敏,费 嘉,等.以microRNA-21为靶标的反义寡核苷酸对人白血病K562细胞的抑制作用[J].中国病理生理杂志,2009,25(6):1127-1131.
[4] Zhang Y,Li M,Wang H,et al.Profiling of 95 micro-RNAs in pancreatic cancer cell lines and surgical specimens by real-time PCR analysis[J].World J Surg,2009,33(4):698-709.
[5] Zhang SN,Zuo HJ,Yu Z,et al.Expression profiles of microRNAs in human pancreatic cancer cell lines[J].Chinese-German J Clin Oncol,2009,8(2):77-80.
[6] Dou LP,Li YH,Wang LL,et al.HOXA9 is direct target of miR-196a[J].Xi Bao Yu Fen Zi Mian Yi Xue Za Zhi,2011,27(2):166-169.
[7] Peng S,Kuang Z,Sheng C,et al.Association of microRNA-196a-2 gene polymorphism with gastric cancer risk in a Chinese population[J].Dig Dis Sci,2010,55(8): 2288-2293.
[8] Coskun E,von der Heide EK,Schlee C,et al.The role of microRNA-196a and microRNA-196b as ERG regulators in acute myeloid leukemia and acute T-lymphoblastic leukemia[J].Leuk Res,2011,35(2):208-213.
[9] Luthra R,Singh RR,Luthra MG,et al.MicroRNA-196a targets annexin A1:a microRNA-mediated mechanism of annexin A1 downregulation in cancers[J].Oncogene,2008,27(52):6667-6678.
[10] Schimanski CC,Frerichs K,Rahman F,et al.High miR-196a levels promote the oncogenic phenotype of colorectal cancer cells[J].World J Gastroenterol,2009,15 (17):2089-2096.
[11] Bredel M,Scholtens DM,Yadav AK,et al.NFKBIA deletion in glioblastomas[J].N Engl J Med,2011,364 (7):627-637.
