JNK通路促进大鼠脑缺血再灌注海马神经元凋亡*
2012-03-17高维娟刘莎莎
张 霞, 钱 涛, 高维娟, 刘莎莎
(1承德医学院病理生理学教研室,河北承德067000;2河北化工医药职业技术学院,河北石家庄050026)
脑血管病是神经系统常见病、多发病,其致死率、致残率均较高,缺血造成了脑组织的损伤,再灌注使可逆性缺血损伤加重,并通过各种反应将可逆损伤转化为不可逆损伤。有研究表明,在缺血再灌注损伤时存在一种细胞死亡形式即细胞凋亡,并在缺血/再灌注损伤的病理过程中起着重要作用。同时大量研究表明脑缺血再灌注可以激活c-Jun N端激酶(c-Jun N-terminal kinase,JNK),而且JNK激活在脑缺血介导的神经元凋亡过程中发挥重要作用[1-2]。因此本研究选择特异性 JNK抑制剂SP600125和激动剂茴香霉素(anisomycin),观察其对脑缺血再灌注后海马神经元caspase-3表达的影响,探讨JNK通路在脑缺血再灌注诱导的海马神经元凋亡中的作用。
材料和方法
1 主要试剂
SP600125和anisomycin均购自Enzo;二甲基亚砜(DMSO)购自Sigma。SP600125及anisomycin用10%DMSO溶解配置成20 nmol/L及300 ng/L的贮存液避光于4℃冰箱保存。Caspase-3抗体(用于免疫组化)购自Santa Cruz,DAB显色剂购自北京中杉试剂公司。抗caspase-3多克隆抗体(用于Western blotting)购自Bioworld;BCA蛋白定量试剂盒购自Solarbio;Trizol reagent购自Invitrogen;随机上、下游引物和TaqMan荧光探针由大连宝生物公司提供,Premix Ex TaqTM实时荧光定量PCR试剂盒购自大连宝生物公司;原位末端细胞凋亡POD检测试剂盒购自自Roche。其它试剂为国产分析纯。
2 动物及分组
成年SD雄性大鼠90只,清洁级,体重240~280 g,由天津山川红实实验动物科技有限公司提供,许可证号为SCXK(津)2009-001。实验前动物处在同一环境(室温22~25℃,避免强光及噪音刺激,足够的食物和饮水)适应性饲养1周。随机分为5组:假手术组、全脑缺血再灌注组、JNK抑制剂组+全脑缺血再灌注组、JNK激动剂组+全脑缺血再灌注组、全脑缺血再灌注组+溶剂对照组。每组12只动物。
3 模型制备
采用改良的四血管闭塞法制作大鼠全脑缺血模型。4%水合氯醛10 mL/kg腹腔麻醉,颈背侧纵切口约1.5 cm,分离颈旁肌暴露第一颈椎横突,寻找翼状孔,用直径0.5 mm的电凝针烧灼其中的椎动脉,造成永久性闭塞,缝合切口,然后分离双侧颈总动脉并埋线备用,缝合切口。术后恢复24 h,选用恢复良好的动物,用微动脉夹夹闭双侧颈总动脉造成全脑缺血30 min,然后去除双侧微动脉夹恢复血液灌流,以大鼠翻正反射消失、瞳孔散大作为全脑缺血成功的标准,且剔除癫痫发作大鼠。假手术组仅暴露双侧椎动脉及颈总动脉,不凝闭椎动脉,也不予微动脉夹夹闭双侧颈总动脉。其它组手术进程同模型组,JNK抑制组、JNK激动剂组以及溶剂对照组的动物在夹闭双侧颈总动脉前30 min利用大鼠立体定位仪分别侧脑室注射SP600125(SP600125溶于10%DMSO,最终浓度为 20 mmol/L)、anisomycin(anisomycin溶于10%DMSO,最终浓度为300 μg/L)或10%DMSO,各10 μL。药物在5 min内注完,留针2 min。
4 免疫组织化学法检测海马组织caspase-3的表达
取海马冠状石蜡切片,采用SP法行免疫组组化学染色。切片依次脱蜡至水,PBS浸泡5 mim,电磁炉水浴抗原修复,修复完后,自然冷却至室温;3% H2O2孵育30 min,PBS冲洗5 min,3次,滴加正常山羊封闭血清,室温孵育30 min,倾去勿洗;滴加1∶100的caspase-3多抗,4℃冰箱过夜;次日37℃温箱孵育30 min,PBS冲洗5 min,3次,擦干切片周围水分后,滴加生物素标记的Ⅱ抗,37℃温箱孵育30 min; PBS冲洗5 min,3次,擦干切片周围水分后,滴加SP复合物即链酶亲和素-生物素-过氧化物酶复合物,37℃温箱孵育30 min;三蒸水洗5 min,3次,DAB显色,脱水、透明、封片。每张切片在大脑海马CA1区随机选择5个400倍视野,通过MiVnt图像分析系统进行定量分析。
5 Western blotting检测海马组织caspase-3蛋白水平
称取海马组织,提取总蛋白,BCA法进行蛋白浓度定量,应用Western blotting方法对各组大鼠海马组织的caspase-3蛋白水平进行了检测。取25 μg样品,以12%SDS-PAGE电泳分离,分离的蛋白用半干电转移法转移到PVDF膜上,0.5%脱脂奶粉封闭过夜,抗体孵育(caspase-3Ⅰ抗浓度1∶500孵育2 h),TBST洗膜3次,然后用兔抗大鼠的Ⅱ抗(浓度1∶5 000)室温孵育1 h,TBST洗膜后采用ECL发光液显色,X射线底片曝光。以β-actin为内参照,实验重复5次,用Quantity One软件对蛋白条带灰度值进行分析。
6 实时荧光定量PCR法检测海马组织caspase-3 mRNA表达
取-80℃保存的海马组织,Trizol法抽提总RNA,RNA定量后逆转录合成cDNA。以合成的cDNA为模板,构建质粒,制备合适的标准品质粒,对其进行10倍倍比稀释,以103、104、105、106和107拷贝作阳性模板,每个标准品设2个重复,制作标准曲线。同时应用ABI的Primer Express 3.0设计的引物及带有5'FAM荧光基团和3'Eclipse淬灭基团的TaqMan水解探针,采用Premix Ex TaqTM实时荧光定量PCR试剂盒一步法检测各组海马组织中caspase-3 mRNA表达。25 μL反应体系,反应条件如下:先95℃60 s,再95℃10 s,60℃30 s,40个循环,荧光信号监测点选在60℃反应后单点接收荧光信号。反应结束后获取循环阈值(Ct值),对拷贝数以10为底取对数,作为横坐标,Ct值为纵坐标,通过标准曲线对未知模板进行定量,然后进行实验数据分析。
7 TUNEL染色法检测海马神经细胞凋亡水平
取相应的组织玻片常规脱蜡脱水,经蒸馏水浸泡及PBS洗涤后滴加H2O2,37℃烤箱放置40 min后PBS洗涤,滴加蛋白酶K后37℃孵育10 min,PBS洗涤。将凋亡检测试剂盒中试剂1与试剂2配成TUNEL反应混合物,混匀后加在经上述处理的切片上,37℃烤箱放置60 min后PBS洗涤,滴加转化剂POD,37℃烤箱放置30 min后洗涤,DAB显色,苏木素复染,脱水,透明,封片。400倍显微镜下观察,每张切片随机选取不重叠的5个CA1区视野,计数TUNEL阳性细胞数,取均值为该例计数结果。定量分析方法为光镜下计算凋亡指数(apoptotic index,AI)。AI=凋亡细胞数/总细胞数×100%。
8 统计学处理
结果
1 JNK抑制剂与激动剂对海马组织caspase-3蛋白表达的影响
免疫组织化学染色显示,caspase-3阳性表达在细胞质内。模型组caspase-3表达量最高,与假手术组相比差异有统计学意义(P<0.05)。与模型组相比,JNK抑制剂组caspase-3表达明显降低(P<0.05),而JNK激动剂组caspase-3表达明显增加(P<0.05),溶剂对照组则无明显差异(P>0.05),见图1。

Figure 1.Effects of JNK inhibitor(SP600125)and agonist(anisomycin)on expression of caspase-3 protein in rat hippocampal tissues after cerebral ischemia-reperfusion(IR)(immunohistochemical staining,×400).±s.n=6.#P<0.05 vs sham; *P<0.05 vs cerebral IR.图1 免疫组织化学染色检测JNK抑制剂和激动剂对脑缺血再灌注大鼠海马组织caspase-3蛋白表达的影响
Western blotting结果显示,海马组织caspase-3蛋白同免疫组化表达变化一致,见图2。
2 JNK抑制剂与激动剂对海马组织caspase-3 mRNA的影响
对本实验中所提取的RNA进行紫外分光光度计检测,结果为1.8 <A260/A280<2.0。实时荧光定量PCR结果显示,拷贝的范围在103~107内,Ct值和cDNA拷贝数呈线性关系,线性关系较好,说明定量准确、可靠,见图3。Caspase-3 mRNA同caspase-3蛋白表达变化一致,见图4。
3 JNK抑制剂与激动剂对海马神经元凋亡的影响
TUNEL染色结果显示,各组海马神经元凋亡情况同免疫组化表达变化一致,见图5。
讨论

Figure 2.Effects of JNK inhibitor(SP600125)and agonist(anisomycin)on expression of caspase-3 protein in rat hippocampal tissues after cerebral ischemia-reperfusion(IR)detected by Western blotting.±s.n=6.#P<0.05 vs sham;*P<0.05 vs cerebral IR.图2 Western blotting检测JNK抑制剂和激动剂对脑缺血再灌注大鼠海马组织caspase-3蛋白表达的影响
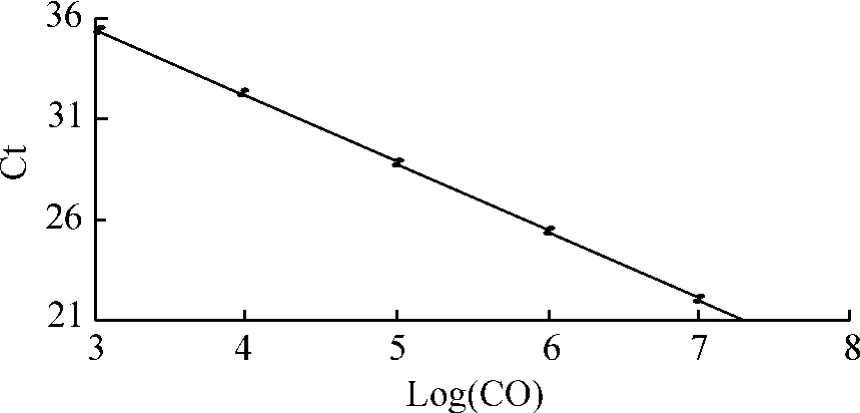
Figure 3.PCR standard curve for caspase-3 quantification图3 Caspase-3的标准曲线
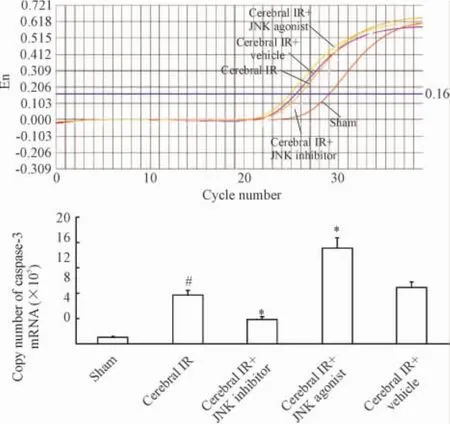
Figure 4.Effects of JNK inhibitor(SP600125)and agonist (anisomycin)on expression of caspase-3 mRNA in rat hippocampal tissues after cerebral ischemiareperfusion(IR)detected by real-time PCR.±s.n=6.#P<0.05 vs sham;*P<0.05 vs cerebral IR.图4 JNK抑制剂和激动剂对脑缺血再灌注大鼠海马组织caspase-3 mRNA表达的影响

Figure 5.Effects of JNK inhibitor(SP600125)and agonist(anisomycin)on apoptosis of rat hippocampal neurons after cerebral ischemia-reperfusion(IR)(TUNEL staining,×400).±s.n=6.#P<0.05 vs sham;*P<0.05 vs cerebral IR.图5 JNK抑制剂和激动剂对脑缺血再灌注大鼠海马神经元凋亡的影响
缺血再灌注损伤最早是于1960年由Jenings首先提出,目前学者一致认为:缺血再灌注损伤是由多种因素、多种机制交互式作用、相互影响而导致的极其复杂的病理生理过程。近年来研究发现缺血再灌注损伤与丝裂原活化蛋白激酶信号转导通路密切相关[3-4]。丝裂原活化蛋白激酶是细胞内的一种丝/苏氨酸蛋白激酶,它受到刺激后磷酸化而活化。而JNK/SAPK是哺乳类细胞中丝裂原活化蛋白激酶中极为重要一个亚类,逐渐引起普遍的关注。JNK细胞信号转导途径与脑组织缺血再灌注损伤有密切联系[5]。已有研究表明JNK信号通路可被缺血再灌注的应激刺激激活[6-7],而且JNK激活与神经元凋亡有关。国内外大量研究表明,JNK在局灶和全脑缺血神经元凋亡过程中发挥了重要作用[8],脑缺血再灌注的刺激首先激活JNK信号通路模块中的MAPKKK;继而激活MAPKK,包括MKK4和MKK7,最后激活JNKs[9]。激活的JNK又可进一步磷酸化其核底物及胞浆底物,促进神经元的凋亡。JNK激活后可通过2条途径发挥作用:一是上调促凋亡相关蛋白的表达从而激活死亡受体凋亡通路,另一条途径是通过调节Bcl-2家族成员的活性参与线粒体介导的细胞凋亡通路,2条途径最终都可激活caspase-3。通过这2条途径激活的caspase-3可激活CAD (caspase-activated DNase),并可切割核DNA修复酶PARP[poly(ADP-ribose)polymerase],从而导致核DNA不可复性的损伤,最终导致细胞凋亡。Caspase-3是半胱氨酸蛋白酶家族中的重要成员,并且在细胞凋亡过程中处于核心地位,凋亡的最后实施是通过它的激活而实现。
本实验通过应用 JNK信号转导通路抑制剂SP600125和激动剂anisomycin对全脑缺血再灌注后海马神经元损伤进行干预,并观察其对caspase-3蛋白和mRNA的影响,以及海马神经元凋亡的情况,来探究JNK细胞信号转导通路在脑缺血再灌注损伤中的机制,从而为临床上出现的脑缺血再灌注损伤提供新的治疗措施。SP600125是一种非常有效的选择性抑制JNK-1、2、3的抑制剂,通过可逆性竞争ATP抑制JNK的磷酸化,达到抑制JNK信号转导通路的作用,而anisomycin能通过活化JNK,进一步通过死亡受体通路和线粒体通路,起到促进脑缺血再灌注诱导神经元凋亡的作用。经本实验证实,应用SP600125对脑缺血再灌注干预后,由于此细胞转导通路被阻断,海马组织的caspase-3蛋白和mRNA较缺血再灌注组明显下降,凋亡细胞也明显下降;而应用anisomycin对脑缺血再灌注干预后,由于此细胞转导通路被激活,海马组织的caspase-3蛋白和mRNA较缺血再灌注组明显增加,同时凋亡细胞也明显增加;同时溶剂对照组与缺血再灌注组相比则无明显变化。由此推测缺血再灌注损伤与JNK激活密切相关。
总之,JNK通路参与了脑缺血再灌注后的海马神经元凋亡,最终通过促进caspase-3的表达来发挥促凋亡作用。
[1] Chang L,Karin M.Manmalian MAP kinase signalling cascades[J].Nature,2001,10(6824):37-40.
[2] 王耀岐,李 军,曹 红,等.ERK和JNK通路在沙土鼠脑缺血预处理中的表达及作用[J].中国药理学通报,2006,22(3):337-340.
[3] King LA,Toledo AH,Rivera-Chavez FA,et al.Role of p38 and JNK in liver ischemia and reperfusion[J].Hepatobiliary Pancreat Surg,2009,16(6):763-770.
[4] Li L,Zhang YM,Qiao WL,et al.Role of mitogen-activated protein kinases in the regulation of paraventricular nucleus to gastric ischemia-reperfusion injuries[J].Chin Med J(Engl),2007,120(12):1082-1087.
[5] 王 宁,薛荣亮,姚凤珍,等.SP600125-JNK抑制剂对大鼠脑缺血再灌注神经元的保护作用[J].第四军医大学学报,2007,28(20):1838-1841.
[6] Gu Z,Jiang Q,Zhang G.c-Jun N-terminal kinase activation in hippocampal CA1 region was involved in ischemic injury[J].Neuroreport,2001,12(5):897-900.
[7] Tian H,Zhang G,Li H,et al.Antioxidant NAC and AMPA/KA receptor antagonist DNQX inhibited JNK3 activation following global ischemia in rat hippocampus[J].Neurosci Res,2003,46(2):191-197.
[8] Irving EA,Bamford M.Role of mitogen-and stress-activated kinases in ischemic injury[J].J Cereb Blood Flow Metab,2002,22(6):631-647.
[9] Brunet A,Pouysségur J.Mammalian MAP kinase modules: how to transduce specific signals[J].Essays Biochem,1997,32:1-16.
