昼夜节律蛋白Cry2作为结直肠癌预后和化疗敏感性预测因子的研究*
2012-03-17周俊怿方乐堃邓艳红刘焕亮汪建平黄美近
周俊怿, 方乐堃, 邓艳红, 刘焕亮, 王 磊, 汪建平, 黄美近
(中山大学附属第六医院,广东广州510655)
昼夜节律(circadian rhythm)是以24 h左右为周期变动的生命活动,又称近日节律[1]。越来越多的流行病学调查发现昼夜节律的紊乱与乳腺癌、结肠癌的发病相关[2-5]。动物都存在着维持昼夜节律的系统——昼夜节律蛋白,目前至少发现9种昼夜节律蛋白(Clock、Per1、Per2、Bmal1、Cry1、Cry2、Tim、酪蛋白激酶1和糖原合酶激酶3β)[6-8]。目前对昼夜节律及其调控蛋白研究日益深入,昼夜节律对结直肠癌的发生、发展、预后存在影响,但目前尚未有报道使用昼夜节律蛋白对结直肠癌的预后进行评估。本文旨在探索用昼夜节律蛋白Cry2对结直肠癌的预后及新辅助化疗敏感性、新辅助化疗后的生存期进行预测。
材料和方法
1 材料与对象
选16名规律地接受包含5-氟尿嘧啶的新辅助化疗的结直肠癌切除术患者。使用结肠镜获取新辅助化疗之前的肿瘤标本。通过CT/MRI计算肿瘤体积的减少率或肿瘤反应速度,从而反映化疗疗效。使用实体肿瘤疗效评估标准来评估化疗疗效:完全反应(complete response,CR;病灶消失)、部分反应(partial response,PR;缩小≥30%)、病灶稳定(stable disease,SD;缩小<30%或增大≤20%)和病灶进展(progress disease,PD;增大≥20%)。同时,我们收集307名在2001年至2005年间接受结直肠癌切除术的患者的肿瘤标本与随访资料,这些患者未接受新辅助治疗。本研究通过医院伦理委员会的批准。以总生存为结束点,生存时间从手术当天算起,直至死亡或者最后一次随访的时间。
2 主要试剂
免疫组化试剂盒和3,3'-二氨基联苯胺(3,3'-diaminobenzidine,DAB;北京中杉金桥生物技术有限公司);兔单克隆抗体Cry2(Abcam)。
3 方法
3.1 组织芯片(tissue microarray,TMA)制作[9]组织石蜡块对照其相应的HE染色玻片,确定肿瘤组织位置,为确保组织芯片样本代表性及防止掉片导致信息丢失,使用组织芯片仪(MiniCore,ALPHELYS)以直径2 mm在石蜡块上取出选定组织(每份标本取2份组织)。每个标本取2个点,制成组织芯片蜡块,每个芯片蜡块含12×8个点。标本置于免疫组化专用防脱片载玻片上,制作成组织芯片玻片。
3.2 免疫组织化学 TMA玻片在二甲苯脱蜡,通过梯度的乙醇重新水化,清水洗净后,置于枸橼酸盐缓冲液(pH=6)中,使用微波加热3 min修复抗原。冷却后,于3%过氧化氢中浸泡10 min,消耗内在的过氧化物酶,再在室温下予10%正常山羊血清孵育20 min,封闭非特异性抗原。最后将组织芯片覆盖上兔单克隆抗体Cry2(Abcam,1∶100稀释),置于湿盒中4℃过夜。接着将芯片置于Ⅰ抗(北京中杉金桥生物技术有限公司)中室温孵育1 h,最后滴加DAB。最后,用苏木素复染,盐酸酒精脱色,并封片。使用普通兔IgG代替Ⅱ抗作为阴性对照。使用免疫组化检测阳性的组织作为阳性对照。
3.3 免疫组化检测的评分标准 所有标本均于100和200倍放大下获取图片,并由2名独立的病理医生单独阅片,使用Image-Pro Plus 6.0进行细胞计数,并进行半定量评分(immunoreactivity score,IRS)。阳性肿瘤细胞比例,1分:<25%;2分:25%~50%;3分:50%~75%;4分:>75%。表达强度,0分:无表达;1分:弱阳性;2分:中等阳性;3分:强阳性。然后将2个分数相乘,通过绘制ROC曲线获得分界值,IRS 0~4分定义为Cry2低表达,IRS 5~12分定义为Cry2高表达。
4 统计学处理
使用SPSS 16.0对数据进行统计分析。ROC曲线分析确定Cry2高、低表达的分界点。Cry2表达和结直肠癌患者的临床病理特点间的关系用χ2检验进行分析,用log-rank检验进行单因素生存分析,用Cox回归模型确定独立预后因素,用Kapla-Meier法绘制生存曲线。设定双侧P<0.05为有意义结果。实验重复3次。计量资料以均数±标准差(s)表示。
结果
1 Cry2在化疗敏感和化疗抵抗病例中的差异
16名接受以5-氟尿嘧啶为基础的新辅助化疗的结直肠癌患者,以化疗反应分成2组,CR/PR组8名患者,SD/PD组8名,结果表明,CR/PR组Cry2表达较低,SD/PD组Cry2表达较高,见图1。因为总例数为16例,少于40例,用Fisher确切概率检验进行分析,差异有统计学意义,见表1、图2。
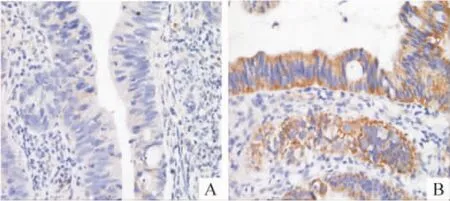
Figure 1.Expession of Cry2 in colorectal cancer tissues from chemotherapy-sensitive(A)and chemotherapy-resistant(B)patients(immunohistochemical staining,×200).图1 化疗敏感和化疗抵抗患者结直肠癌组织Cry2的表达

表1 新辅助化疗患者Cry2的表达Table 1 .Expression of Cry2 in patients with neoadjuvant chemotherapy(n=8)
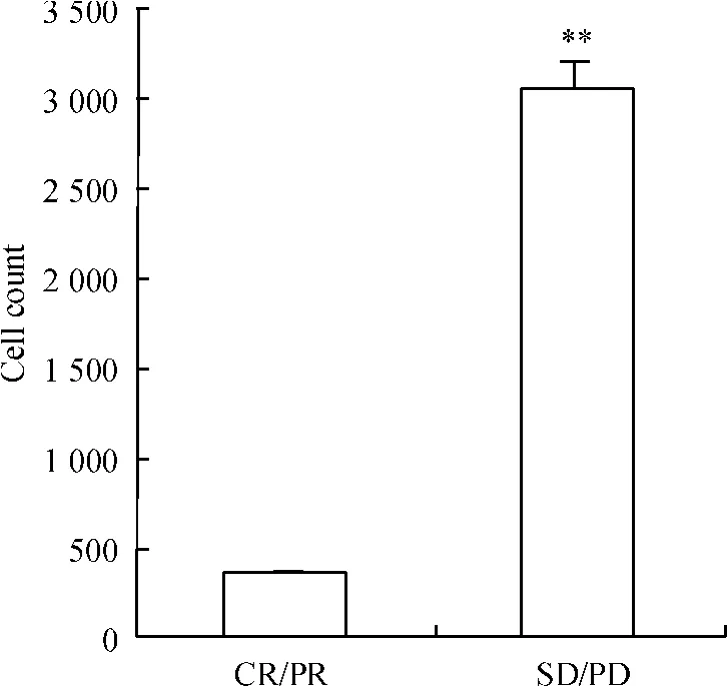
Figure 2.Comparison of Cry2 expression between CR/PR and SD/PD groups.CR/PR:complete response/partial response;SD/PD:stable disease/progress disease. s.n=3.**P<0.01 vs CR/PR group.图2 CR/PR组和SD/PD组Cry2表达的比较
2 307例结直肠癌患者基本资料
收集307名2001年至2005年间接受结直肠癌切除术的患者,并按Cry2表达的强弱分成2组,见表2。这2组在性别、年龄、肿瘤位置、组织分级、肿瘤分期及采纳化疗各方面无显著差异,具可比性。
3 Cry2表达高低对总生存时间的影响
性别、年龄、组织分级、病理学T分期和是否化疗对患者的总生存时间均无影响,肿瘤位置、淋巴结转移、远处转移及Cry2表达情况对总生存时间存在影响。结肠肿瘤、无淋巴结转移及远处转移、Cry2低表达预后较好,见表3、图3。
4 Cry2表达是影响预后的独立因素
性别、病理学T分期、化疗与否对生存的影响并非独立的,年龄、肿瘤位置、组织分级、病理学N分期、病理学M分期和Cry2的表达是影响预后的独立因素,见表4。
5 Cry2表达是影响化疗预后的独立因素
年龄、肿瘤位置、组织分级、病理学T分期对化疗影响并非独立的。性别、病理学N分期、病理学M分期和Cry2的表达是影响化疗预后的独立因素,见表5、图4。
讨论
1 Cry2对新辅助治疗的指导作用
Cry2的表达与昼夜节律调整有关[10],而昼夜节律与肿瘤的发生有关[2-5],结果显示SD/PD组Cry2表达较高,而CR/PR组Cry2表达较低。这充分说明了Cry2高表达时化疗疗效较差,而Cry2低表达时化疗疗效较好。进一步可以说明,Cry2高表达时,患者化疗效果差,可不考虑行新辅助化疗,Cry2低表达时,化疗效果好,可考虑行新辅助化疗。当然我们的研究中,病例数仍然不足,需继续扩大病例数,使结果更为可信。

表2 2001~2005年结直肠癌手术患者Cry2的表达情况Table 2 .Expression in Cry2 in patients with colorectal cancer excision between 2001 and 2005

Figure 3.The different overall survival time of all the patients with high and low Cry2 expression.图3 所有病人Cry2表达高低对总生存时间的影响

表3 患者不同预后参数的单因素分析Table 3 .Univariate analysis of the average survival time of all the patients

表4 所有患者不同预后参数的多因素分析Table 4 .Multivariate analysis of the overall survival time of all the patients(n=307)

表5 患者接受新辅助化疗后不同预后参数的多因素分析Table 5 .Multivariate analysis of the overall survival time of the patients with neoadjuvant chemotherapy(n=79)

Figure 4.The different overall survival time of the patients who received neoadjuvant chemotherapy between high and low Cry2 expression.图4 新辅助化疗病人Cry2表达高低对总生存时间的影响
2 Cry2预测CRC患者总生存的作用
AJCC第6版中,ⅡA和ⅡB期5年生存率分别为71.6%和 66.4%,IIIA、IIIB和 IIIC期分别为46.2%、40.1%和28.3%。2002年,美国国家癌症数据中心研究发现,细化III期结肠癌分期标准可以进一步区分预后。其中IIIA期(T1~2,N1)5年生存率为59.8%、IIIB期(T3~4,N1)5年生存率为42.0%,IIIC期(任何T,N2)5年生存率为27.3%(P<0.01)。本研究中,Cry2高表达的病人总生存时间比Cry2低表达的患者总生存时间短。Cry2表达的高低与性别、年龄、肿瘤位置、组织学等级、病理学分级等无关,同时多因素COX回归分析的结果显示,Cry2高表达可以作为提示结直肠癌患者预后差的独立因素。这将为评估患者预后带来巨大的方便,仅仅通过免疫组化的方法,就可以对结直肠癌患者预后进行评估,但是目前我们的样本量仍然有限,在下一步研究中,应继续扩大样本量,并进行多中心研究,明确Cry2作为预后因子的作用。在单因素分析中,其它提示总生存率低的因素分别是肿瘤位置(P<0.01)、淋巴结转移(P<0.05)和远处转移(P<0.01)。
3 Cry2预测新辅助化疗效果的作用
文献报道昼夜节律对化疗疗效有相当显著的影响[11-20]。在我们的实验中,我们分析了结直肠癌患者的Cry2表达和新辅助化疗治疗结果之间关系(表5、图5)。新辅助化疗以5-氟尿嘧啶为基础,加或不加亚叶酸钙或草酸铂。Kaplan-Meier分析显示,Cry2高表达的患者化疗后总生存时间仍比对照组短(P<0.05),与所有病人(化疗和不化疗的病人)的总生存情况类似,这说明化疗并不能使Cry2表达高的患者生存期延长至与Cry2表达低的患者相同,提示Cry2可以作为化疗的预测分子标志物。多因素Cox回归分析显示,Cry2高表达预示着更差的预后,所以Cry2可以作为一个独立的因子,预测结直肠癌患者新辅助化疗后的预后情况。
[1] Bass J.Physiology:on time metabolism[J].Nature,2011,480(7378):466-467.
[2] Chen-Goodspeed M,Lee CC.Tumor suppression and circadian function[J].J Biol Rhythms,2007,22(4): 291-298.
[3] Stevens RG.Circadian disruption and breast cancer:from melatonin to clock genes[J].Epidemiology,2005,16 (2):245-258.
[4] Hansen J,Stevens RG.Case-control study of shift-work and breast cancer risk in Danish nurses:impact of shift systems[J].Eur J Cancer,2012,48(11):1722-1729.
[5] Schernhammer ES,Laden F,Speizer FE,et al.Rotating night shifts and risk of breast cancer in women participating in the nurses’health study[J].J Natl Cancer Inst,2001,93(20):1563-1568.
[6] Badiu C.Genetic clock of biologic rhythms[J].J Cell Mol Med,2003,7(4):408-416.
[7] Ko CH,Takahashi JS.Molecular components of the mammalian circadian clock[J].Hum Mol Genet,2006,15 (Suppl 2):R271-R277.
[8] Barnes JW,Tischkau SA,Barnes JA,et al.Requirement of mammalian timeless for circadian rhythmicity[J].Science,2003,302(5644):439-442.
[9] 蒋 李,王 磊,黄美近,等.TPI-2表达与结直肠癌发生发展的关系与意义[J].中国病理生理杂志,2011,27 (7):1403-1405,1413.
[10] Gauger MA,Sancar A.Cryptochrome,circadian cycle,cell cycle checkpoints,and cancer[J].Cancer Res,2005,65(15):6828-6834.
[11] Giacchetti S,Itzhaki M,Gruia G,et al.Long-term survival of patients with unresectable colorectal cancer liver metastases following infusional chemotherapy with 5-fluorouracil,leucovorin,oxaliplatin and surgery[J].Ann Oncol,1999,10(6):663-669.
[12] Adam R,Avisar E,Ariche A,et al.Five-year survival following hepatic resection after neoadjuvant therapy for nonresectable colorectal liver metastases[J].Ann Surg Oncol,2001,8(4):347-353.
[13] Lévi F,Zidani R,Misset JL.Randomized multicentre trial of chemotherapy with oxaliplatin,fluorouracil,and folinic acid in metastatic colorectal cancer[J].Lancet,1997,350(9079):681-686.
[14] Halberg F,Haus E,Cardoso SS,et al.Toward a chronotherapy of neoplasia:tolerance of treatment depends upon host rhythms[J].Experientia,1973,29(8):909-934.
[15] Levi FA,Hrushesky WJ,Blomquist CH,et al.Reduction of cis-diamminedichloroplatinum nephrotoxicity in rats by optimal circadian drug timing[J].Cancer Res,1982,42 (3):950-955.
[16] Levi F.Chronopharmacology of anticancer agents[M].∥Redfern PH,Lemmer B.Physiology and pharmacology of biological rhythms.1st ed.Berlin:Springer,1997:299-331.
[17] Levi F.From circadian rhythms to cancer chronotherapeutics[J].Chronother Int,2002,19(1):1-19.
[18] Eriguchi M,Fujii Y,Takeda Y,et al.Chronotherapy: application to chemotherapy for gastric cancer and colorectal cancer[J].Oncologia,1992,25(35):118-120.
[19] Eriguchi M,Osada I,Fujii Y,et al.Pilot study for preoperative administration of 1-OHP to patients with advanced scirrhous type gastric cancer[J].Biomed Pharmacother,1997,51(5):217-220.
[20] Eriguchi M,Nonaka Y,Yanagie H,et al.A molecular biological study of anti-tumor mechanisms of an anticancer agent Oxaliplatin against established human gastric cancer cell lines[J].Biomed Pharmacother,2003,57 (9):412-415.
