持续性心房颤动患者2型小电导钙激活钾通道基因和蛋白表达的变化
2012-03-17徐先增曾知恒伍伟锋刘唐威
徐先增 黄 凯 曾知恒 伍伟锋 刘唐威
广西医科大学第一附属医院心内科 南宁 530021
心房颤动(房颤)是临床上最常见的一种心律失常,发病后可致病死率明显增加[1]。房颤发生后可使离子通道重构,动作电位时程缩短,频率适应性下降,易于房颤维持,即“电重构”[2-3]。2型小电导钙激活钾通道(type 2small-conductance calcium-activated potassium channel,SK2)是钙激活钾通道的一种亚型,人心肌细胞上有表达,参与心肌细胞的复极过程,心房表达多于心室[4],已有研究证实SK2表达量的变化与房颤有关[5-6]。但目前对于SK2和房颤关系的研究多限于动物实验,本研究以持续性房颤患者为研究对象,目的在于探究人患持续性房颤后SK2的变化在电重构中的作用。
1 资料与方法
1.1 一般资料 收集我院心胸外科住院的风湿性心脏病行二尖瓣置换成形术的患者,持续性房颤23例(房颤组),其中3例既往合并脑栓塞,窦性心律18例(窦律组),取体外循环插管前的新鲜右心耳组织,分两份分别用于逆转录酶联聚合反应(reverse transcription polymerase chain reaction,PTPCR)和免疫组化。取材前患者签署知情同意书,且获得医院伦理委员会同意。
1.2 RT-PCR (1)总RNA提取:按1mL Trizol(Invitrogen公司)/100mg心耳组织,分步提取总RNA。(2)逆转录:取1μg总RNA参照逆转录试剂盒(Invitrogen公司)说明书将其中的mRNA逆转录成cDNA。(3)引物设计:用primer 5.0软件设计,由上海生工公司合成。目的基因KCNN2(SK2的编码基因,NCBI编号NM_021614.2)上游5'-GGACTGTCCGAGCTTGTG-3',下游5'-TGATGTTCTGGGTCTTTGC-3',扩增片段486bp;内参基因GAPDH(NCBI编号NM_002046.3)上游5'-AGAAGGCTGGGGCTCATTTG-3',5'-AGGGGCCATCCACAGTCTTC-3',扩增片段258bp。(4)PCR反应:反应体系(25μL)包括cDNA 1μL,目的基因上下游引物各0.5μL,内参基因上下游引物各0.5 μL,2×PCR Mix(北京天根公司)12.5μL,去离子水9.5μL;反应程序为94℃5min(94℃30s,62℃30s,72℃30s)×35个循环,72℃10min。(5)电泳及图像扫描:2%琼脂糖凝胶100V稳压电泳,ChemiDoc XRS凝胶成像系统(Bio Rad公司)成像,Quantity one软件分析PCR电泳结果,测量同泳道目的和内参两条带的Trace Qty值,用其比值代表目的基因的相对表达量。
1.3 免疫组化 心耳标本经4%多聚甲醛固定,制作蜡块,切片,SP法染色。一抗:兔抗人KCNN2(Abcam公司,编号ab83733)1:1000,二抗:羊抗兔(碧云天公司)1:5000。阴性对照实验不加一抗,其余步骤相同。每张切片随机取5个高倍视野(×400),应用图像分析软件(imagepro plus,IPP)测定每个视野阳性信号的累积光密度(integrate optical density,IOD),并取均值。IOD值越大,表明组织中SK2蛋白表达量越多。
1.4 统计学方法 应用SPSS 16.0统计软件包进行统计处理。所测得数据用±s表示。正态资料用t检验,偏态资料用秩和检验,两样本构成比用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 基线资料 与窦律组比较,房颤组患者二尖瓣狭窄病变更多,左房内径和心胸比率更大,差异有统计学意义(P< 0.05),其他相关指标差异无统计学意义(P>0.05)。见表 1。
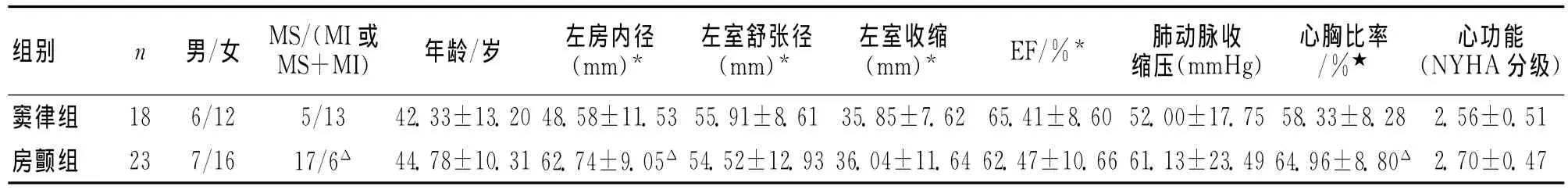
表1 2组患者基线资料比较
2.2 RT-PCR 同一心房组织同时扩增目的基因KCNN2和内参基因GAPDH的特异性引物,琼脂糖凝胶电泳显示相互之间无明显干扰,为两条分离的条带。见图1。条带分子量与待扩增的片段长度一致,分别为486bp和258bp。2组内参基因GAPDH基因表达差别无统计学意义(P>0.05),但房颤组较窦律组KCNN2表达显著降低(P<0.05),与内参基因的比值亦显著降低(P<0.05),下调幅度44%,提示房颤组患者心房组织的KCNN2mRNA水平明显降低。见表2。

图1 PT-PRC测定右心房KCNN2的基因表达 1~4来自4例窦律患者,5~7来自3例房颤患者
表2 2组患者心房组织KCNN2的基因表达 (±s)

表2 2组患者心房组织KCNN2的基因表达 (±s)
?
2.3 免疫组化 与窦律组比较,房颤组心房肌细胞增大明显。SK2蛋白阳性表达呈棕黄色,在胞膜和胞浆均有分布,胞核内则无明显分布。胞膜阳性表达呈相对淡染的环状;胞浆阳性表达主要在核周。心耳各层心肌细胞组织表达相对均匀,无明显灶性或区域性表达。房颤组与窦律组比较SK2蛋白表达减少,IOD分别为2 525 900±772 807.4和2 206 917±1 170 312,下调幅度13%,但差异无统计学意义(P>0.05),但细胞内分布特点变化不明显。见图2。
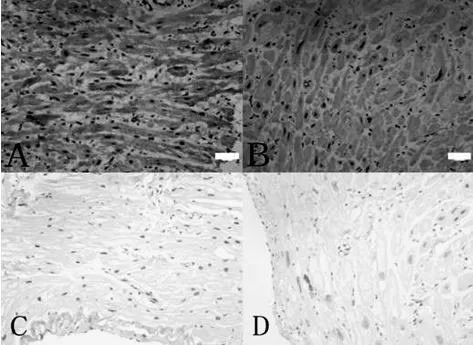
图2 免疫组化测定右心房SK2的蛋白表达(×400)A窦律患者的阳性表达,B房颤患者的阳性表达,C窦律患者的阴性对照,D房颤患者的阴性对照
3 讨论
心房颤动是临床上常见的心律失常,各种类型心脏病均可导致心房颤动。一旦发生心房颤动,可使心房有效不应期缩短,降低频率适应性,即所谓“电重构现象”,使得心房颤动更加易于发生和维持。离子通道的重构是导致电重构的基础,探究各种离子通道的重构对于研究心房颤动的发生和维持机制以及寻找可能的治疗靶点都有重要意义。目前治疗心房颤动的抗心律失常药物往往导致严重的致恶性室性心律失常,原因是其作用的离子通道靶点房室间分布不具有选择性,而为了尽量避免可能的致恶性室性心律失常作用,寻找仅作用于心房分布特异性离子通道靶点如I(Kur)的抗心律失常药物成为研究的热点[7]。钙激活钾通道分布非常广泛,被细胞内微量钙离子(<1.0μM)激活,按电导大小可分为大电导(BK)、中电导(MK)和小电导(SK)三种类型,SK2则属于SK的一种亚型,α亚基是通道的功能亚基,为KCNN2基因所编码,可被极低浓度(100pM~10nM)的蜂毒明肽特异性阻断[8]。研究证明心房的SK2表达明显多于心室[4],短时间快速刺激肺静脉即可见SK2表达增加,蛋白膜向转移增强,全细胞水平电流密度加大,且这些变化与动作电位的缩短关系明显,因此被认为是治疗心房颤动的另一个可能的理想靶点[9]。而近期的动物实验确实也证明,应用SK2阻断剂能够预防和终止心房颤动的发作[10]。但以上研究均为模拟短期心房颤动的动物实验,人患持续性心房颤动后SK2的结构和功能的改变并不为人知晓。
本研究则探讨人患持续性心房颤动后SK2基因和蛋白的变化,为能使2组更具可比性,我们选择的对象均为风湿性心脏病二尖瓣病变病例,但房颤组中二尖瓣狭窄比例更大,而窦律组二尖瓣关闭不全比例更大。对比发现,房颤患者的左房内径以及心胸比例更大,提示心功能不全与房颤存在互为因果的关系。通过RT-PCR发现,房颤组SK2基因表达下降明显,而通过免疫组化发现蛋白表达也有小幅下降,但差异无统计学意义。这一结果与初步的动物实验提示该通道表达上调的结果不相符,原因有以下几种可能:(1)长期持续性的房颤通过某些机制,使SK2基因蛋白早期上调,但晚期出现再次下调,这一推断需要来自阵发性房颤患者实验结果的进一步证实;(2)人患房颤后SK2基因蛋白的表达本就下调,毕竟动物模型的实验结果不能完全适用于临床患者。本研究未从全细胞或单通道水平测定离子通道功能的变化,但一些学者认为离子通道功能的改变很大程度上取决于通道基因表达的改变[11]。因为人患持续性房颤后SK2基因和蛋白表达下调,用于防治动物阵发性房颤有效的SK2特异性阻断剂用于持续性房颤患者可能无效或有害。但也应看到,细胞内钙负荷增加导致的L型钙电流密度下降是心房颤动发生后电重构中最重要的改变[12-13],而一些钾电流如I电流密度下降可能仅为次要作用[14],其综合改变的结果仍然是有效不应期缩短,而此时应用I的阻断剂仍可改善电重构,预防或终止房颤的发生[7]。另外,SK2功能水平主要受细胞内Ca2+浓度影响,房颤发生后细胞内Ca2+浓度增加,因此即使SK2基因和蛋白表达下调,其功能水平仍然因为Ca2+浓度增加而上调,此时应用SK2特异性阻断剂后,仍然有益于预防或终止房颤的发生,当然这些推测需要进一步实验证实。因此即使SK2基因蛋白表达下调,同样也可能不会影响SK2特异性阻断剂预防和治疗房颤患者,但最终结果仍需进一步研究证实。
综上所述,与初步的动物实验结果不同,人患持续性房颤后SK2基因和蛋白表达下调,用于防治动物阵发性房颤有效的SK2特异性阻断剂是否适用于持续性房颤患者仍然有待于进一步实验证实。
[1] Crandall MA,Horne BD,Day JD,et al.Atrial fibrillation significantly increases total mortality and stroke risk beyond that conveyed by the CHADS2risk factors[J].Pacing Clin Electrophysiol,2009,32(8):981-986.
[2] Franz MR,Karasik PL,Li C,et al.Electrical remodeling of the human atrium:similar effects in patients with chronic atrial fibrillation and atrial flutter[J].J Am Coll Cardiol,1997,30(7):1 785-1 792.
[3] Wijffels MC,Kirchhof CJ,Dorland R,et al.Atrial fibrillation begets atrial fibrillation.A study in awake chronically instrumented goats[J].Circulation,1995,92(7):1 954-1 968.
[4] Xu Y,Tuteja D,Zhang Z,et al.Molecular identification and functional roles of a Ca2+-activated K+channel in human and mouse hearts[J].J Biol Chem,2003,278(49):49 085-49 094.
[5] Li N,Timofeyev V,Tuteja D,et al.Ablation of a Ca2+-activated K+channel(SK2channel)results in action potential prolongation in atrial myocytes and atrial fibrillation[J].J Physiol,2009,587(Pt 5):1 087-1 100.
[6] Ozgen N,Dun W,Sosunov EA,et al.Early electrical remodeling in rabbit pulmonary vein results from trafficking of intracellular SK2channels to membrane sites[J].Cardiovasc Res,2007,75(4):758-769.
[7] Hirt MN,Eschenhagen T.Vernakalant:a novel antiarrhythmic drug for the rapid conversion of atrial fibrillation to sinus rhythm[J].Dtsch Med Wochenschr,2010,135(19):971-976.
[8] Wei AD,Gutman GA,Aldrich R,et al.International Union of Pharmacology.LII.Nomenclature and molecular relationships of calcium-activated potassium channels[J].Pharmacol Rev,2005,57(4):463-472.
[9] Nattel S.Calcium-activated potassium current:a novel ion channel candidate in atrial fibrillation[J].J Physiol,2009,587(Pt 7):1 385-1 386.
[10] Diness JG,Sorensen US,Nissen JD,et al.Inhibition of smallconductance Ca2+-activated K+channels terminates and protects against atrial fibrillation[J].Circ Arrhythm Electrophysiol,2010,3(4):380-390.
[11] Nattel S,Frelin Y,Gaborit N,et al.Ion-channel mRNA-expression profiling:Insights into cardiac remodeling and arrhythmic substrates[J].J Mol Cell Cardiol,2010,48(1):96-105.
[12] Lai LP,Su MJ,Lin JL,et al.Down-regulation of L-type calcium channel and sarcoplasmic reticular Ca(2+)-ATPase mRNA in human atrial fibrillation without significant change in the mRNA of ryanodine receptor,calsequestrin and phospholamban:an insight into the mechanism of atrial electrical remodeling[J].J Am Coll Cardiol,1999,33(5):1 231-1 237.
[13] Li GR,Nattel S.Properties of human atrial ICa at physiological temperatures and relevance to action potential[J].Am J Physiol,1997,272(1Pt 2):H227-235.
[14] Brandt MC,Priebe L,Bohle T,et al.The ultrarapid and the transient outward K(+)current in human atrial fibrillation.Their possible role in postoperative atrial fibrillation[J].J Mol Cell Cardiol,2000,32(10):1 885-1 896.
