血清降钙素原在鉴别小儿不典型化脓性脑膜炎和病毒性脑炎的作用
2012-03-17马燕丽徐凯丽
马燕丽 徐凯丽
郑州市儿童医院神经内科 郑州 450053
临床常见的颅内感染为化脓性脑膜炎、结核性脑膜炎、病毒性脑炎、真菌性脑炎,以及其他病原学脑炎,但最常见的还是化脓性脑膜炎和病毒性脑炎。近年由于广谱抗生素的广泛应用,典型的化脓性脑膜炎已不多见,而不典型化脓性脑膜炎有明显增多趋势。及早诊断并规范治疗是降低病死率、减少并发症并改善预后的关键。由于不规范应用抗生素,加之不典型化脓性脑膜炎的脑脊液检查不典型,为诊断带来了很大困难,另外,因化脓性脑膜炎需要较长时间(至少2周)的治疗,因此,寻找一种特异性较强且敏感的指标来鉴别病毒性脑炎和不典型化脓性脑膜炎非常重要。
PCT在生理情况下由甲状腺C细胞产生,量很少,在健康人群中很难测到,当细菌感染时,PCT即可由甲状腺以外的组织产生,血清中水平明显升高,但在病毒感染时,血清水平轻度升高或正常,所以可鉴别细菌性感染和病毒性感染。本实验目的为研究PCT在鉴别病毒性脑炎和不典型化脓性脑膜炎中的价值。
1 对象和方法
1.1 研究对象 回顾性分析2010-01-2010-12我院收治的31例不典型化脓性脑膜炎,21例典型化脓性脑膜炎和54例典型病毒性脑炎患者的临床资料,5例未予完善PCT检查,排出实验,所有入选患者均排除中枢神经系统外感染。另选20名正常儿童为正常对照组。所有不典型化脓性脑膜炎均符合如下条件:(1)有发热、头痛、呕吐或脑膜刺激征等轻重不等的神经系统症状和体征;(2)脑脊液的白细胞数、蛋白、糖或氯化物有不同程度改变,但未达到典型化脓性脑膜炎的诊断标准;(3)除外结核性脑膜炎、真菌性脑膜炎及寄生虫颅内感染等;(4)影像学检查无脑脓肿、硬模下积液或脱髓鞘病变等化脓性脑膜炎或病毒性脑炎的特征性病变;(5)停抗生素病情有反复,或加用有效抗生素后72h内病情减轻;(6)单个抗生素治疗无效,需联合抗生素治疗;(7)抗生素治疗有效,症状体征均正常,但治疗4周后复查脑脊液仍不正常,换用或加用有效抗生素后脑脊液恢复正常。(8)其中1、2、3、4是必须条件,并具备5、6、7三项条件中至少一项。所有病毒性脑(膜)炎符合如下诊断标准:(1)病前1~3周内有呼吸道或消化道等前驱感染史;(2)起病急,有不同程度的头痛、呕吐、抽搐、意识障碍、肢体活动障碍等中枢神经系统的症状和体征;(3)脑脊液检查示压力增高,细胞数、蛋白正常或轻度增高,糖和氯化物正常;(4)脑电图(EEG)呈不同程度的节律减慢;(5)排除颅内其他非病毒性感染[1]。所有典型化脓性脑膜炎符合如下诊断标准:有发热、头痛、呕吐及精神症状改变,脑膜刺激征阳性,脑脊液外观浑浊,白细胞总数多>1 000×106/L,蛋白含量多>1 000mg/L,糖含量降低[2]。各组间年龄、性别比较差异无统计学意义(P>0.05)。见表1。
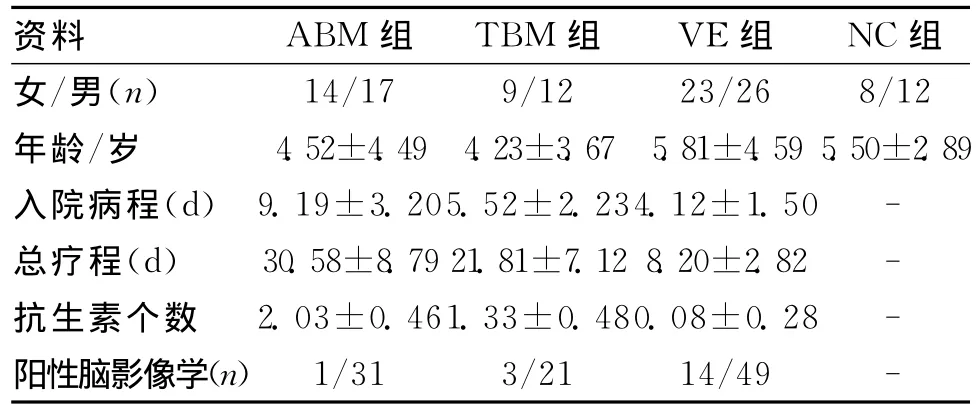
表1 各组一般资料比较
1.2 方法 均在患者入院当天采集血清并完成PCT、CRP和WBC的检查。PCT采用用双抗夹心免疫发光测量法。应用德国BAHMS Diagnostica公司生产的LUM test PCT试剂盒。血清PCT正常值0~0.5μg/L,>0.5μg/L定位异常界值。血清CRP的异常界值为>8mg/L,WBC的异常界值为>10×109/L或<4×109/L。
2 结果
2.1 各组指标的检验结果 见表2。t检验分析结果:PCT:ABM组与VE组比较差异有统计学意义(P=1.80× 10-5),VE组与NC组比较差异无统计学意义(P=0.65),TBM组与VE组比较差异有统计学意义(P=4.72×10-4),ABM与NC组比较差异有统计学意义(P=4.31×10-4),ABM组与TBM组比较差异无统计学意义(P=0.69),ABM与NC组比较差异有统计学意义(P=1.55×10-5)。
CRP:ABM组与VE组比较差异无统计学意义(P=0.60),VE组与TBM组比较差异有统计学意义(P=0.003),ABM组与TBM组比较差异有统计学意义(P=2.44×10-4),VE组与NC组比较差异有统计学意义(P=2.59×10-9),ABM与NC组比较差异有统计学意义(P=5.21×10-9)。
WBC:ABM组与VE组比较差异无统计学意义(P=0.09),VE组与NC组比较差异有统计学意义(P=2.04× 10-7),TBM组与VE组比较差异有统计学意义(P=2.90× 10-5),ABM与NC组比较差异有统计学意义(P=7.15× 10-9),ABM组与TBM组比较差异有统计学意义(P=0.004)。
表2 各组指标的计量资料 (±s)
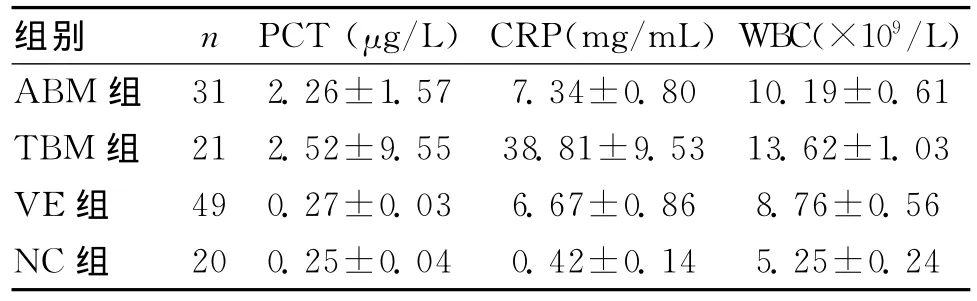
表2 各组指标的计量资料 (±s)
?
2.2 各组指标的阳性率 见表3。组间各指标卡方检验(χ2-test)结果如下:ABM组与VE组间比较:PCT差异有统计学意义(χ2=60.25,P=8.34×10-15),CRP差异无统计学意义(χ2=0.06,P=0.80),WBC差异无统计学意义(χ2=2.69,P=0.14)。ABM组与TBM组比较:PCT差异无统计学意义(Fisher精确检验,P=0.26),CRP差异有统计学意义(χ2=19.02,P=1.29×10-5),WBC差异无统计学意义(χ2=3.07,P=0.08)。ABM组与NC组比较:PCT差异有统计学意义(χ2=40.06,P=2.47×10-10),CRP差异有统计学意义(Fisher精确检验,P=0.008),WBC差异有统计学意义(χ2=11.26,P=0.001)。VE组与NC组比较:PCT差异无统计学意义(Fisher精确检验,P=1.00),CRP差异有统计学意义(Fisher精确检验,P=0.014),WBC差异有统计学意义(Fisher精确检验,P=0.014)。

表3 各组指标的阳性率 (%)
2.3 各指标对不典型化脓性脑膜炎的诊断结果 见图1。鉴别不典型化脓性脑膜炎和病毒性脑炎,应用ROC曲线,PCT、CRP和WBC三者的曲线下面积(AUC)分别为:0.939、0.558、0.644。
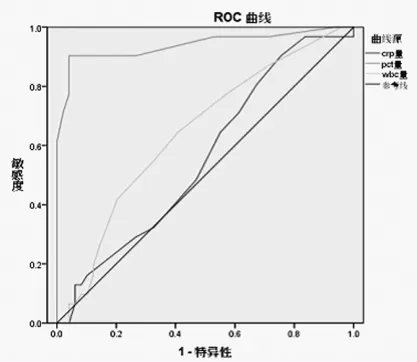
图1 各指标对不典型化脓性脑膜炎和病毒性脑炎的鉴别
3 讨论
化脓性脑膜炎在小儿发病率较高,有一定的致死率和致残率,及早诊断及早治疗是预后关键。化脓性脑膜炎根据临床症状和体征,以及典型脑脊液检查结果,很容易确诊。但经抗生素不规则治疗后的患者或小婴儿,症状和脑脊液检查往往不典型,可能将化脓性脑膜炎误诊为病毒性脑炎而延误病情,将病毒性脑炎误诊为化脓性脑膜炎而滥用抗生素造成经济损失和健康损害。寻找敏感性和特异性均较强的指标来鉴别化脓性脑膜炎和病毒性脑炎近年成为研究热点。PCT是一种含116个氨基酸的蛋白质,分子量约13kD。在正常代谢情况下,PCT在甲状腺的C细胞中生成并裂解出具有激素活性的降钙素,故而正常情况下血清中PCT极微量。而在细菌感染或脓毒症时,PCT即可能由甲状腺C细胞外的其他器官(特别是肝脏)的单核细胞和巨噬细胞等产生,故而血清中PCT浓度会不同程度的升高[3]。有研究表明[4],全身细菌感染时,PCT明显升高,而病毒感染时或严重全身炎反应综合征的患者,PCT也正常或轻微升高,且与CRP不同,在某些自身免疫性疾病引起的发热,PCT无明显升高,这点特异性优于CRP。另有研究表明[5-7],PCT在鉴别病毒性脑炎和化脓性脑膜炎时,其特异性和敏感性优于ESR、CRP和白细胞分类。PCT的排出途径尚不明确,但肾衰竭患者血清PCT浓度并不升高,故而肾功能不影响PCT结果[8]。
该试验中,不典型化脓性脑膜炎组31例患者,只有3例患儿PCT低于0.5μg/L,其余PCT值均高于0.5μg/L。病毒性脑炎组49例患者3例PCT升高,其余均≤0.5μg/L,但因3例患儿脑实质有明显脱髓鞘病变,脑脊液检查细胞数轻度升高,糖和氯化物均正常,且经抗病毒,未予抗生素治疗而治愈,故诊断为病毒性脑炎,目前其PCT升高原因不明(已除外神经系统外细菌感染)。不典型化脓性脑膜炎组和病毒性脑炎组PCT差异显著,与以往研究细菌感染和病毒性感染的PCT变化结果相符[5-7]。化脓性脑膜炎组与病毒性脑膜炎组结果差异显著,与刘春峰等[6]的研究结果相符。典型化脓性脑膜炎组和不典型化脓性脑膜炎组的PCT值差异无统计学意义,这说明细菌感染时会升高,具体升高幅度原因较多,有待进一步研究。CRP和WBC在不典型化脓性脑膜炎组和病毒性脑膜炎组之间均无显著差异,而在典型化脓性脑膜炎组和病毒性脑炎组之间,两者差异有统计学意义,不典型和典型化脓性脑膜炎之间,两者差异有统计学意义,这可能与不典型化脓性脑膜炎组入院时平均病程相对较长有关,也与CRP和WBC的诱导和消除动力学有关。Monneret等[9]也发现CRP在感染起病初期较敏感,但随着病情进展,即使病情加重,CRP也无法继续升高。在评价各指标对不典型化脓性脑膜炎的诊断价值时,PCT的AUC>0.9,有高度诊断价值,而CRP和WBC均<0.7,具有低度诊断价值。
由于该试验为临床回顾性病例分析,有很多不足之处,如未能动态监测PCT,以了解PCT在监测病情严重程度的价值。总结该试验中不典型化脓性脑膜炎特点如下:(1)神经系统症状及体征,如头痛、呕吐及脑膜刺激征等可有,也可不明显,发热可能断断续续,但病史中必须有发热;(2)有应用能透过血脑屏障的抗生素或糖皮质激素史;(3)病史往往相对较长;(4)治疗过程中大多需要联合抗生素治疗,疗程相对较长。
综上,PCT检查作为一项简便易行的检测手段,可作为鉴别病毒性脑炎和不典型化脓性脑膜炎的一种参考指标。
[1] 杨锡强,易著文 .儿科学[M].6版 .北京:人民卫生出版社,2004:463-465.
[2] 樊寻梅,周永涛 .化脓性脑膜炎[M]//胡亚美,江载芳 .诸福堂实用儿科学.7版.北京:人民卫生出版社,2002:912-926.
[3] Oberhoffer M,Vogelsang H,Jager L,et al.Katacalcin and calcitonin immunoreactivity in different types of leukocytes indicate intracellular procalcitonin content[J].J Crit Care,1999,14(1):29-33.
[4] Tamaki K,Kogata Y,Sugiyama D,et al.Diagnostic accuracy of serum procalcitonin concentrations for detecting systemic bacterial infection in patients with systemic autoimmune diseases[J].Rheumato,2008,35(1):114-119.
[5] Gendrel D,Raymond J,Assicot M,et al.Procalcitonin,C-re-active protein and interleukin 6in bacterial and viral meningitis in children[J].Presse Med,1998,27(23):1 135-1 139.
[6] 刘春峰,蔡栩栩,许巍,等.血降钙素原在儿童化脓性脑膜炎与病毒性脑膜炎中的变化[J].中国当代儿科学杂志,2006,8(1):17-20.
[7] Gendrel D,Raymond J,Assicot M,et al.Measurement of procalcintonin levels in children with bacterial or viral meningitis[J].Clin Infect Dis,1997,24(6):1 240-l 242.
[8] Level C,Chauveau P,Guisset O,et al.Mass transfer,clearance and plasma concentration of procalcitonin during continuous venovenous hemofiltration in patients with septic shock and acute oliguric renal failure[J].Crit Care,2003,7(6):415-416.
[9] Monneret G,Labaune JM,Isaac C,et al.Procalcitonin and C-reactive protein levels in neonatal infections[J].Acta Paediatr,1997,86(2):209-212.
