夹竹桃麻素对高肺血流肺动脉高压大鼠的治疗作用*
2012-03-06黄维佳覃家锦
黄维佳 ,覃家锦 ,何 巍 ,戴 霞
(1.广西壮族自治区柳州市人民医院心胸外科,广西 柳州 545001; 2广西医科大学第一附属医院心胸外科,广西 南宁 530021)
研究发现,活性氧(ROS)及氧化应激在缺氧性肺动脉高压和新生儿持续性肺动脉高压的发病机制中有着重要的作用,但关于活性氧对其他类型肺动脉高压的影响报道甚少。从理论上讲,如果肺动脉内皮细胞活性氧的生成明显减少,内皮细胞氧化应激得到缓解,或者肺血管内皮细胞中产生活性氧的还原型辅酶Ⅱ(NADPH)氧化酶被抑制,就能达到缓解肺血管重构和治疗肺动脉高压的目的。本研究中,拟用NADPH氧化酶抑制剂夹竹桃麻素(apocynin)干预左向右分流肺动脉高压模型大鼠,观察其对大鼠肺动脉内皮细胞NADPH氧化酶4(NOX4)表达和细胞内活性氧水平的影响,探讨夹竹桃麻素对左向右分流肺动脉高压的保护作用。
1 材料与方法
1.1 材料
SD大鼠,雄性,7周龄,体重180~200 g,广西医科大学实验动物中心提供。RM-6000型多通道生理记录仪(日本);双目显微镜(Olympus);电泳仪(美国Bio-Rad公司);Q550CW计算机图像分析系统(德国Leica公司);凝胶成像系统(美国Bio-Rad公司);2,7-二氢二氯荧光黄双乙酸钠(DCFH-DA)荧光探针(江苏碧云天公司);夹竹桃麻素(美国Calbiochem公司)。
1.2 试验方法
分组与给药:将30只SD大鼠随机分为3组,每组10只。分流给药组于分流手术后第2天给予夹竹桃麻素0.2 g/kg灌胃,分流组于分流手术后第2天给予等体积的0.9%氯化钠注射液灌胃,对照组开腹但不做分流,于手术后第2天给予等体积的0.9%氯化钠注射液灌胃,3组均每日给药1次,连续11周。3组大鼠均在实验动物中心饲养,饲养条件相同。
分流建立:取大鼠,以戊巴比妥钠40 mg/kg腹腔内注射麻醉,取腹部正中切口,用棉签游离后腹膜,显露腹主动脉及下腔静脉,于腹主动脉左肾动脉起始部下方及髂总动脉上方,分别用小动脉夹将腹主动脉夹闭,在腹主动脉左侧壁拟切开处,用手术尖刀片划出1 mm长的切口,通过该切口用20 G套管针以45度角穿透腹主动脉壁进入相邻下腔静脉内(以不刺破下腔静脉对侧管壁为度)。造成腹主动脉与下腔静脉的瘘道后,拔出针头,再用7-0线缝合腹主动脉壁切口。移走小动脉夹,观察到大鼠下腔静脉变粗、颜色由暗变红,或下腔静脉出现微弱搏动,提示分流存在。
平均肺动脉压(mPAP)测定:于术后11周末处死大鼠,处死前均经腹腔注射戊巴比妥钠40 mg/kg麻醉,分离右颈外静脉,用聚乙烯导管经右颈外静脉进行右心插管,导管另一端经压力换能器与多通道生理记录仪连接并记录mPAP。
肺小动脉HE染色:开胸取大鼠部分肺组织,经4%多聚甲醛溶液固定,常规石蜡包埋、切片、HE染色。应用Olympus双目显微镜观察染色情况,每只大鼠选取1张切片,每张切片中随机选择肺小动脉15条,使用Q550CW计算机图像分析系统进行血管形态计量,测量平均血管总面积(TA)和血管腔面积(IA)、管壁厚度(WT)、血管外径(ED),计算出血管管壁厚度占外径的百分比(WT%)、管壁面积占血管总面积的百分比(WA%),以此反映肺血管重建的程度。WT%=(2×WT/ED)×100%,WA%=(TAIA)/TA×100%。
肺动脉内皮细胞分离、培养与鉴定:处死大鼠,完整取出大鼠肺动脉,按王琪等[1]介绍的方法分离、培养大鼠肺动脉内皮细胞,用第2~4代细胞进行试验。在倒置显微镜下观察所培养细胞的形态学特征,用免疫荧光法检测所培养细胞中Ⅷ因子相关抗原的表达,以此鉴定是否为肺动脉内皮细胞。
肺动脉内皮细胞中活性氧水平测定:将培养的大鼠肺动脉内皮细胞用无血清培养基洗2次,加5 mL无血清培养基和7 μL DCFH-DA到培养瓶中,在37℃下培养箱中孵育30 min,磷酸盐缓冲液洗3次,用胰酶消化,加血清终止反应,用无血清培养基洗2次,用3 mL无血清培养基重悬细胞。其中阳性对照组加阳性药物rosup(试剂盒提供)3 μL,常温下孵育1 h,磷酸盐缓冲液洗2次,用流式细胞仪检测每组细胞内的平均荧光强度。将未加DCFH-DA的阴性对照组的自发荧光值定为1,而其他各组的荧光值均为相对于阴性对照的比值。
大鼠肺动脉内皮NOX4蛋白检测:采用Western Blot法。倾去培养液,用4℃的磷酸盐缓冲液洗涤细胞2次,加入预冷裂解液200 μL,冰上孵育20 min,收集细胞裂片及裂解缓冲液,于4℃下离心10 min,收集上清液,测定蛋白浓度。将蛋白样品与上样缓冲液混合后,100℃下煮沸5 min。将样品放在10%的十二烷基硫酸钠(SDS)-聚丙烯凝胶中电泳,后转印至聚偏氟乙烯(PVDF)膜上。用5%脱脂牛奶封闭1 h后,分别加入NOX4抗体(1∶800)及β-actin抗体(1∶10 000)并常温下过夜。以洗膜液洗膜3次后,加入二抗并作用1 h,二氨基联苯胺(DAB)显色,并曝光于X光胶片上,凝胶成像系统进行灰度扫描并测定表达强度,以目的蛋白与β-actin的IOD值之比作为目的蛋白表达的相对水平,结果以IOD比值表示。
1.3 统计学处理
2 结果
2.1 平均肺动脉压变化
结果见表1。与分流组比较,分流给药组大鼠平均肺动脉压明显降低,差异有统计学意义(P<0.05)。
2.2 肺小动脉形态变化
结果见表1。HE染色显示,与对照组比较,分流组、分流给药组大鼠出现肺小动脉壁增厚、血管壁平滑肌细胞肥大增生、管壁面积增加、管腔狭窄等病理改变,但分流给药组大鼠改变程度明显较分流组轻;从表现肺血管重构的指标上看,分流给药组较分流组肺血管重构明显改善(P<0.05)。
2.3 肺动脉内皮细胞鉴定
倒置显微镜下可见,所培养细胞单层贴壁生长,呈鹅卵石样排列;同时免疫荧光法检测结果显示,细胞内Ⅷ因子相关抗原(内皮细胞Ⅷ因子相关抗原是内皮细胞所特有)阳性,胞内可见绿色荧光,证实分离培养得到的细胞是肺动脉内皮细胞。
2.4 肺动脉内皮细胞中活性氧水平
结果见表1。流式细胞仪检测结果显示,与分流组比较,分流给药组大鼠肺动脉内皮细胞中活性氧的水平明显降低(P <0.05)。
2.5 肺动脉内皮中NOX4蛋白表达情况
结果见表1和图1。与分流组比较,分流给药组大鼠肺动脉内皮细胞中NOX4蛋白的表达虽有减少,但差异无统计学意义(P>0.05);与对照组比较,分流给药组、分流组的差异均有统计学意义(P <0.05)。

图1 肺动脉内皮中NOX4蛋白表达情况
表1 各组大鼠mPAP,WT%,WA%,活性氧水平、IDO值比较(±s,n=10)
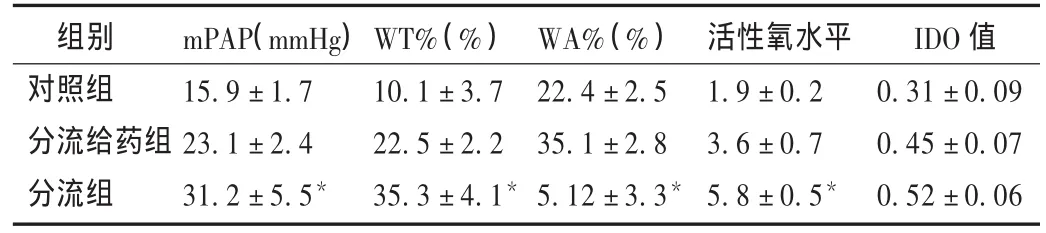
表1 各组大鼠mPAP,WT%,WA%,活性氧水平、IDO值比较(±s,n=10)
注:与分流给药组比较,*P <0.05。
对照组分流给药组分流组15.9 ± 1.7 23.1 ± 2.4 31.2 ± 5.5*10.1 ± 3.7 22.5 ± 2.2 35.3 ± 4.1*22.4 ± 2.5 35.1 ± 2.8 5.12 ± 3.3*1.9 ± 0.2 3.6 ± 0.7 5.8 ± 0.5*0.31 ± 0.09 0.45 ± 0.07 0.52 ± 0.06
3 讨论
活性氧是体内一类含氧单电子还原产物的总称,其造成的氧化应激是许多心血管疾病的病理机制之一。越来越多的研究结果表明,内皮素、转化生长因子等细胞因子可以通过活性氧信号通路影响肺动脉的舒缩反应和肺血管重塑过程,参与肺动脉高压的形成[2-3]。因此,通过抑制NADPH氧化酶而阻断活性氧产生[4],或直接降低活性氧的水平,从而抑制肺血管平滑肌细胞的增殖,可能会成为治疗肺动脉高压的有效手段。
夹竹桃麻素即4-羟基-3-甲氧基-苯乙酮,最初从夹竹桃科植物中被提取,可降低肺血管通透性,减轻肺动脉压力,降低体内环氧化酶代谢产物浓度,改善体外循环(CPB)后的低氧血症以及肺缺血-再灌注损伤导致的肺渗出性病变[5-7]。目前,对于夹竹桃麻素抗氧化应激的具体机制,学者们有着不同的看法。Holland等[8]报道,夹竹桃麻素可能通过抑制NADPH氧化酶的组装而影响其产生及活性,从而阻断继发的活性氧产生。而Vejrazka等[9]发现,夹竹桃麻素在吞噬细胞中以二聚体形式抑制NADPH氧化酶的作用,而在非吞噬细胞(如血管内皮或平滑肌细胞)中则不具有抑制NADPH氧化酶的作用,在体外试验中甚至有刺激活性氧生成的作用。因此在血管系统中不应该把夹竹桃麻素单纯当作NADPH氧化酶抑制剂。在本试验中,通过左向右分流肺动脉高压大鼠模型,以主要在血管内皮细胞表达的NOX4[10]和活性氧为观察指标进行研究,结果证明,夹竹桃麻素是以抗氧化剂的形式直接影响肺动脉内皮活性氧水平,产生缓解肺血管重构及肺动脉高压的作用,而对NADPH氧化酶的影响很小。此结论与Vejrazka等[9]的研究发现相似。笔者认为,夹竹桃麻素通过清除高肺血流肺动脉高压大鼠肺动脉内皮中的活性氧,降低了肺血管内氧化应激的程度,进而影响了活性氧在肺动脉高压发病机制中的第二信使作用,可能阻断了转化生长因子(TGF)的过度表达、磷脂肌醇信号途径(PKC)激活、核转录因子NF-κB的激活等信号途径,最终缓解了肺动脉平滑肌细胞的过度增殖及迁移,拮抗了肺血管重构及肺动脉高压的形成。
夹竹桃麻素作为一种抗氧化剂,能有效缓解大鼠左向右分流导致的肺血管重构和肺动脉高压形成,其通过影响活性氧水平来拮抗肺动脉高压的具体信号途径值得进一步研究。
[1]王 琪,吴中立,郑 尊,等.肺动脉内皮细胞的分离、培养和鉴定[J].细胞生物学杂志,1991,13(1):31-34.
[2]Fike CD,Slaughter JC,Kaplowitz MR,et al.Reactive oxygen species from NADPH oxidase contribute to altered pulmonary vascular responses in piglets with chronic hypoxia-induced pulmonary hypertension[J].Am J Physiol Lung Cell Mol Physiol,2008,295(5):L881-L888.
[3]Clempus RE,Griendling KK.Reactive oxygen species signaling in vascular smooth muscle cells[J].Cardiovasc Res,2006,71(2):216-225.
[4]Shaw S,Wang X,Redd H,et al.High glucose augments the angiotensin Ⅱ-induced activation of JAK2 in vascular smooth muscle cells via the polyol pathway[J].J Biol Chem,2003,278(33):30 634-30 641.
[5]Dodd-oJM,Pearse DB.Effect of NADPH oxidase inhibitor apocynin on ischemia-reperfusion lung injury[J].Am J Physiol Heart Circ Physiol,2000,279(1):H303-H312.
[6]Dodd-o JM,Welsh LE,Salazar JD,et al.Effect of NADPH oxidase inhibition on cardiopulmonary bypass-induced lung injury[J].Am J Physiol Heart Circ Physiol,2004,287(2):H927-H936.
[7]Pearse DB,Dodd-oJM.Ischemia-reperfusion lung injury is prevented by apocynin,a novel inhibitor of leukocyte NADPH oxidase[J].Chest,1999,116:55-56.
[8]Holland JA,Meyer JW,Schmitt ME,et al.Low-density lipoprotein stimulated peroxide production and endocytosis in cultured human endothelial cells:mechanisms of action[J].Endothelium,1997,5(3):191-207.
[9]Vejrazka M,Micek R,Stipek S.Apocynin inhibits NADPH oxidase in phagocytes but stimulates ROS production in non-phagocytic cells[J].Biochim Biophys Acta,2005,1 722(2):143-147.
[10]Geiszt M,Kopp JB,Varnai P,et a1.Identification of Renox,an NADPH oxidase in kidney[J].Proc Natl Acad Sic USA,2000,97(14):8 010-8 014.
