调节性树突状细胞对哮喘小鼠气道炎症及白介素12和IgE表达的影响
2012-02-27刘焕星
刘焕星,曹 平
哮喘是一种慢性呼吸系统疾病,它以加剧的气道炎症、气道高反应性及氧化应激为特点[1]。哮喘的发生与炎性细胞,包括嗜酸粒细胞、肥大细胞、巨噬细胞和辅助性T细胞的浸润有关[2]。已有研究表明,2型辅助性T淋巴细胞通过产生细胞因子介导炎症的级联反应,包括嗜酸粒细胞的募集、IgE和活化氧的产生以及肥大细胞的激活,共同构成气道高反应性的必要递质[3-5]。建立机体对过敏原的特异性耐受,可抑制哮喘的发生与发展。
树突状细胞 (dendritic cells,DC)是专职的骨髓来源抗原提呈细胞,是一群异源性、异质性的细胞群体。尽管DC是在Steinman[6]研究免疫原性时发现的,这些细胞在维持免疫耐受方面同样发挥了重要作用[7]。新近提出的调节性树突状细胞 (regulatory dendritic cells,rDC)具有负向调节免疫反应的功能,在体内外诱导T细胞低反应性及耐受性。
我们前期的研究已经证实,肺脏基质细胞培养上清液可以诱导成熟树突状细胞 (mature dendritic cells,mDC)分化发育成一种rDC,其细胞形态学、免疫分子表型表达、细胞因子分泌都不同于mDC,缺乏活化T细胞的重要信号[8]。本实验利用这种rDC的致耐受能力,通过诱导小鼠过敏性哮喘模型,研究其对卵清蛋白 (OVA)激发的气道过敏性炎症的影响及白介素12(IL-12)、IgE表达的变化,探讨其在哮喘中的作用。
1 材料与方法
1.1 rDC的制备 简要的说用含重组小鼠粒细胞巨噬细胞集落刺激因子 (rmGM-CSF)(10 ng/ml)、重组小鼠细胞因子白介素4(rmIL-4)(1 ng/ml)的RPMI1640完全培养基与小鼠骨髓细胞共培养8 d,用CD11c磁珠阳性选择CD11c+细胞,脂多糖 (LPS) (1 ng/ml)刺激24 h使其成为mDC,然后用含有50%肺脏基质细胞培养的上清液作为完全培养基共培养1周,得到免疫表型为CD11clowIalowCD11bhigh的rDC[8]。
1.2 主要试剂及仪器 OVA、LPS等购自Sigma公司;IL-12、IgE ELISA试剂盒购自R&D公司;rmIL-4、rmGM-CSF购自美国Peprotech公司;普通倒置光学显微镜 (Olympus IX70),普通光学显微镜 (OlympusCH20),BIO-RAD 680酶标仪,鱼跃牌超声雾化器。
1.3 哮喘小鼠模型的建立 除正常组小鼠外,其余各组均经如下处理诱导哮喘样症状:以首次注射OVA抗原当日为第0天 (Day0)计,于Day0和Day9分别予0.1%OVA的氢氧化铝〔Al(OH)3〕溶液 (0.1 ml/只)腹腔注射,进行初次致敏和加强致敏。Day14~20:连续7 d予2%OVA的0.9%氯化钠溶液进行雾化攻击,1次/d,30 min/次。抗原激发后观察小鼠反应,表现为呼吸加深加快,头面部瘙痒,安静少动,弓背,二便失禁为阳性反应,表明哮喘模型建立成功。
1.4 实验动物与分组 40只6~8周龄的C57BL/6近交系小鼠,雌性,购自北京维通利华实验动物技术有限公司。动物分组及rDC的免疫如下:按随机数字表法分成A、B、C、D组,每组10只。A组:正常组,分别在Day0、Day7、Day14,按0.1 ml/只的量腹腔注射磷酸盐缓冲液 (PBS)。B组:OVA组,未做处理的哮喘组。C组:mDC组,分别在Day0、Day7、Day14,按5×106/鼠的细胞量腹腔注射mDC。D组:rDC组,分别在Day0、Day7、Day14,按5×106/鼠的细胞量腹腔注射rDC。
1.5 观察指标及检测方法
1.5.1 取材 末次雾化激发24 h后 (第21天),采用摘除眼球取血的方法收集标本。取血静置1 h,经离心机分离血清。-20℃保存,待测细胞因子。脱颈处死小鼠,暴露胸腔和气管,分离气管,结扎右主支气管,向左肺内灌注1 ml的PBS,停留片刻后回吸,获得肺泡灌洗液。常规留取右肺中叶,行病理学观察。
1.5.2 肺部标本的制备 取右肺中叶,用4%多聚甲醛固定48 h后石蜡包埋,切成4 μm厚切片,行苏木素-伊红 (HE)染色制片。观察肺部的炎症病理改变。
1.5.3 ELISA法检测小鼠血清中IL-12、IgE及肺泡灌洗液中IL-12的表达水平 按照R&D公司ELISA试剂盒操作,在BIO-RAD 680酶标仪上读取结果。
1.6 统计学方法 用SPSS 13.0统计软件进行处理分析,计量资料以 ()表示,两组间比较采用t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 肺组织病理学观察 (HE染色) 正常组小鼠支气管黏膜上皮、肌层及肺泡壁完整。支气管管腔和肺泡腔规则,结构正常,无炎性细胞浸润。支气管管腔、肺泡腔内无分泌物潴留(见图1)。OVA组哮喘小鼠 (见图2)与mDC组哮喘小鼠(见图3)的病理学表现相似。支气管管壁增厚,管腔狭窄,支气管上皮细胞增生明显,可见较多炎性细胞浸润 (以嗜酸粒细胞和中性粒细胞为主),支气管周围小血管扩张、充血,肺泡壁增厚且明显塌陷,肺泡腔明显减少,其内可见较多炎性细胞浸润,支气管管腔、肺泡腔内可见分泌物潴留。rDC组哮喘小鼠支气管壁明显变薄,小血管轻度扩张、充血,炎性细胞浸润较前两组明显减少,肺泡壁塌陷较前两组减轻 (见图4)。
2.2 血清中IL-12、IgE水平的比较 4组小鼠血清中IL-12、IgE比较,差异均有统计学意义 (P<0.01)。其中rDC组血清中IL-12的水平高于OVA组,IgE低于OVA组,差异均有统计学意义 (P<0.01)。mDC组血清中IL-12、IgE水平与OVA组比较,差异均无统计学意义 (P>0.05,见表1)。
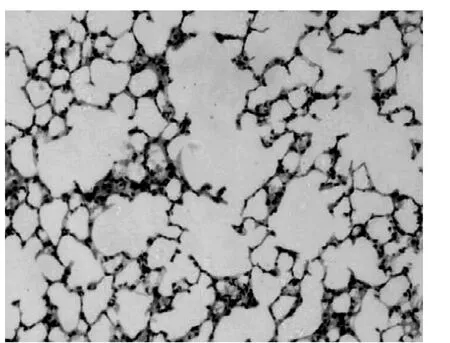
图1 正常组小鼠肺组织 (HE,×100)Figure 1 Lung tissues of normal group mice(HE, ×100)
表1 4组小鼠血清中IL-12及IgE水平的比较 (,pg/ml)Table 1 Comparison of IL-12 and IgE levels between four groups
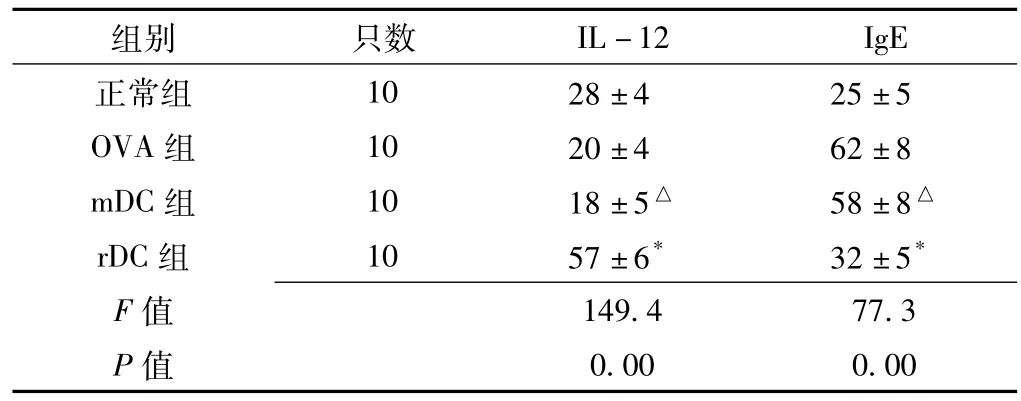
表1 4组小鼠血清中IL-12及IgE水平的比较 (,pg/ml)Table 1 Comparison of IL-12 and IgE levels between four groups
注:与OVA组比较,*P<0.01,△P>0.05
组别 只数IL-12 IgE正常组 10 28±4 25±5 OVA组 10 20±4 62±8 mDC组 10 18±5△ 58±8△rDC组 10 57±6* 32±5*F 值0.00 0.00 149.4 77.3 P值
2.3 肺泡灌洗液中IL-12水平的比较 4组小鼠肺泡灌洗液中IL-12水平比较,差异有统计学意义 (F=81.2,P<0.01)。其中rDC组肺泡灌洗液中IL-12水平高于OVA组,差异有统计学意义 (P<0.01);mDC组肺泡灌洗液中IL-12水平与OVA组比较,差异无统计学意义 (P>0.05,见表2)。
表2 4组肺泡灌洗液中IL-12水平的比较 (,pg/ml)Table 2 Comparison of IL-12 level in lavage fluid between four groups
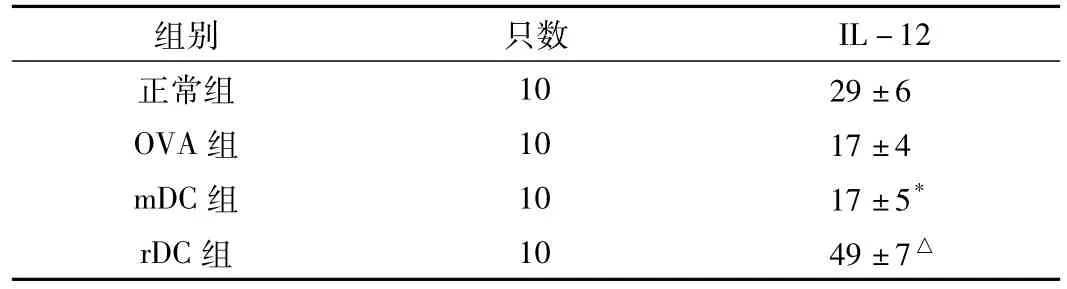
表2 4组肺泡灌洗液中IL-12水平的比较 (,pg/ml)Table 2 Comparison of IL-12 level in lavage fluid between four groups
注:与OVA组比较,*P>0.05,△P<0.01
组别 只数IL-12正常组 10 29±6 OVA组 10 17±4 mDC组 10 17±5*rDC组 10 49±7△
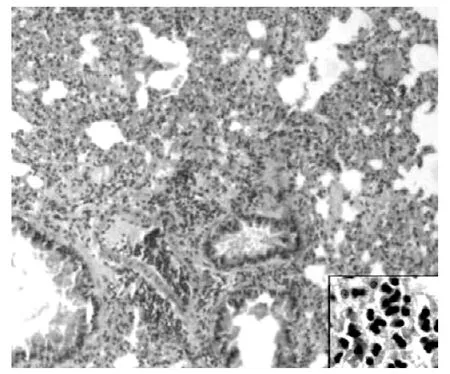
图2 OVA组小鼠肺组织 (HE,×100,右下角×400)Figure 2 Lung tissues of OVA group mice(HE, ×100,the lower right corner×400)
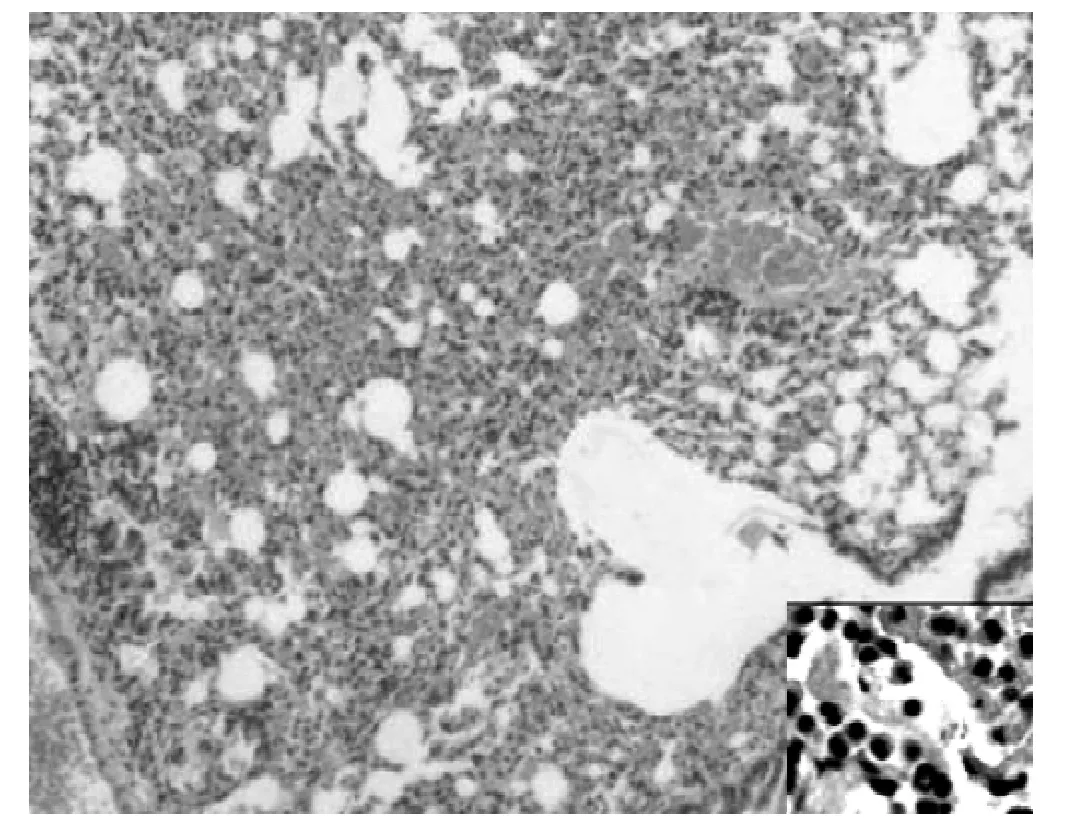
图3 mDC组小鼠肺组织 (HE,×100,右下角×400)Figure 3 Lung tissues of mDC group mice(HE, ×100,the lower right corner×400)
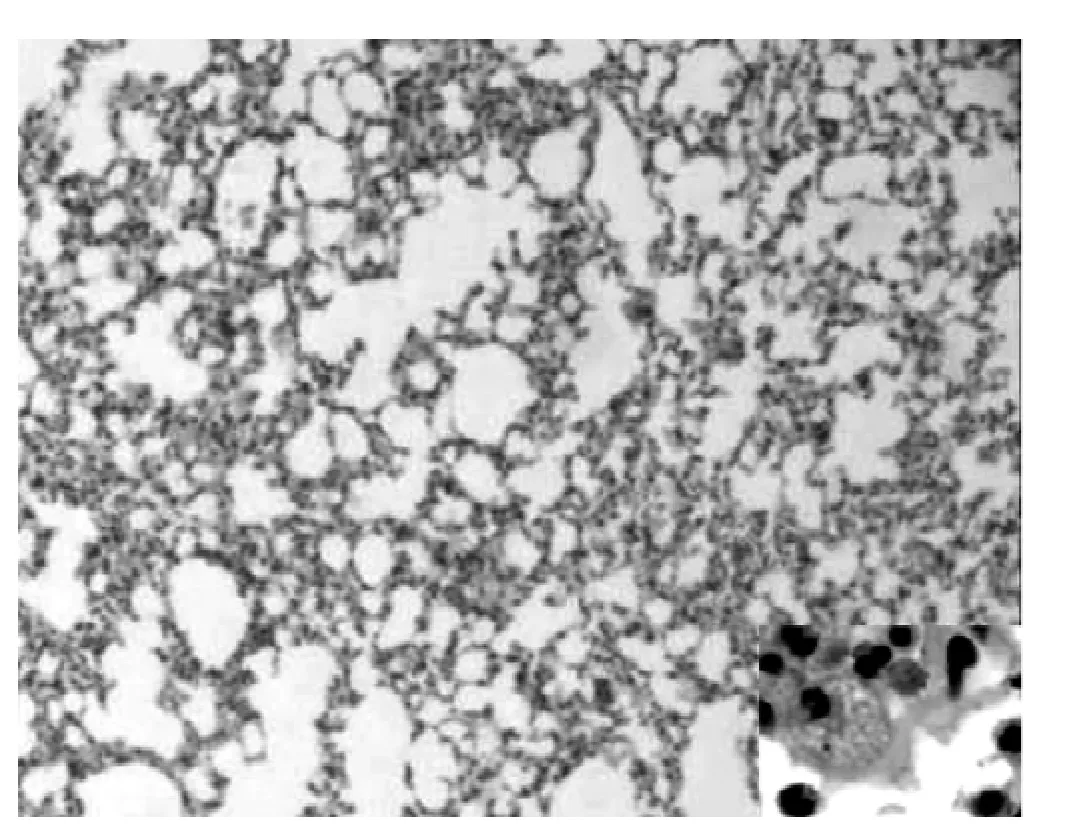
图4 rDC组小鼠肺组织 (HE,×100,右下角×400)Figure 4 Lung tissues of rDC group mice(HE, ×100,the lower right corner×400)
3 讨论
本研究利用mDC与肺基质细胞上清液共培养获得的rDC具有诱导免疫耐受的特性,接种至用OVA激发的哮喘小鼠。本研究结果显示,这种rDC可减轻小鼠肺部炎症表现,上调Th1型细胞因子IL-12水平并下调IgE水平。
哮喘是一种由多种细胞和细胞组分参与的气道慢性非特异性炎症。许多研究已证实T1亚群辅助细胞/T2亚群辅助细胞(Th1/Th2)平衡失调、Th2细胞活化亢进是哮喘发病机制中的关键环节[9]。IL-12在Th1型细胞因子免疫调节中起决定因素,并有研究表明IL-12不足时Th1反应低下而Th2反应增强。Zedan等[10]研究发现,哮喘儿童与正常儿童相比,血清IL-12水平明显下降,并提出IL-12的产生不足可能是哮喘发病机制中的重要组分。IL-12可有效地促进Th1型细胞因子如干扰素γ(IFN-γ)的产生,抑制IgE的合成,抑制过敏原诱导的气道高反应性及嗜酸粒细胞的浸润[11]。而IFN-γ又可反过来加强IL-12的作用,这样便形成了一个正反馈循环,加强了Th1的应答反应。另一方面又可抑制Th2型细胞因子如IL-13、IL-4的产生,抑制Th2的应答反应,降低B淋巴细胞合成过多的IgE,减轻气道炎症反应,降低气道阻力,改善肺功能。IgE是一种反应抗体,通常情况下,主要由鼻咽部、扁桃体、支气管等黏膜固有层的浆细胞产生,IgE水平的降低意味着IgE介导超敏反应的降低,血清中IgE水平取决于疾病炎症反应的程度。
通过rDC干预后,IL-12的表达水平较哮喘小鼠高,且肺泡灌洗液和血清中IL-12的变化一致,而且IL-12能抑制过敏原诱导的气道高反应性及嗜酸粒细胞在气道聚集,使rDC组病理切片及灌洗液中的嗜酸粒细胞浸润减少,炎症减轻。提示rDC抑制哮喘气道炎症的作用可能与上调IL-12的表达,并抑制IgE产生有关。从而既纠正了Th1及Th2型细胞因子失衡又减轻了哮喘的气道高反应性。
综上所述,经诱导产生的rDC对哮喘小鼠气道炎症有治疗作用。rDC应用于哮喘治疗具有良好的前景。
1 Choi JH,Hwang YP,Lee HS,et al.Inhibitory effect of Platycodi Radix on ovalbumin-induced airway inflammation in a murine model of asthma[J].Food Chem Toxicol,2009,47(6):1272-1279.
2 Arima M,Eukuda T.Prostaglandin D2and T(H)2 inflammation in the pathogenesisof bronchial asthma[J].Korean J Intern Med,2011,26(1):8-18.
3 Lee CC,Huang HY,Chiang BL.Lentiviral-mediated interleukin-4 and interleukin-13 RNA interference decrease airway inflammation and hyperresponsiveness[J].Hum Ther,2011,22(5):577-586.
4 Mehta AK,Arora N,Gaur SN,et al.Choline supplementation reduces oxidative stress in mouse model of allergic airway disease[J].Eur J Clin Invest,2009,39(10):934 -941.
5 Wills-Karp M.Immunologic basis of antigen-induced airway hyperresponsiveness[J].Annu Rev Immunol,1999,17:255 -281.
6 Steinman RM.Dendritic cells:understanding immunogenicity[J].Eur J Immunol,2007,37(Suppl 1):53 -60.
7 Steinman RM,Hawiger D,Nussenzweig MC.Tolerogenic dendritic cells[J].Annu Rev Immunol,2003,21:685 -711.
8 刘焕星,赵琴,宋文刚,等.肺脏基质细胞培养上清液对成熟树突状细胞分化发育的影响 [J].中华老年医学杂志,2010,29(10):854-857.
9 Ngoc PL,Gold DR,Tzianabos AO,et al.Cytokines,allergy,and asthma [J].Curr Opin Allergy Clin Immunol,2005,5(2):161 -166.
10 Zedan MM,Chenna EL,wi FA,et al.Interleukin-12 and peripheral blood invariant natural killer T cells as an axis in childhood asthma pathogenesis [J].Allergy Asthma Immunol,2010,9(1):43 -48.
11 Ye YL,Huang WC,Lee YL,et al.Interleukin-12 inhibits eotaxin secretion of cultured primary lung cells and alleviates airway inflammation in vivo[J].Cytokine,2002,19(2):76-84.
