氧化苦参碱对局灶性脑缺血小鼠脑保护机制的研究
2012-02-27李俐涛孟笑梅王建华
李俐涛,孟笑梅,尹 昱,李 哲,杨 蕊,王建华
缺血性脑血管病是临床常见病、多发病之一,根据国际卫生组织统计,在全球范围内平均每400人中就有一个缺血性脑血管病患者,缺血性脑血管病造成的死亡率仅次于心脏疾病,在所有的缺血性脑血管病患者中大约有30%的患者由于溶栓治疗或栓子自发向远端推移而出现血管再通,发生缺血再灌注损伤。其中过度的氧化应激反应存在于脑梗死后坏死及缺血区域,导致氧化损伤,此结论已成为共识,因此,减轻氧化损伤成为治疗急性脑梗死的主要途径之一。Nrf2/ARE通路激活具有神经保护作用,逐渐引起科学家们的关注。最新研究表明,缺血再灌注后过氧化氢酶、谷胱甘肽过氧化物酶 (GSHPx)、超氧化物歧化酶 (SOD)的活性降低[1],Ⅱ相酶诱导剂sulforaphene的确能够减小脑梗死的面积[2]。通过提高SOD和GSH-Px的表达和酶活性,能够减少多发性脑梗死大鼠的记忆损害[3]。因此,本研究设想Nrf2/ARE通路与缺血性卒中病理机制具有相关性,且在临床治疗中具有开发的潜力。
氧化苦参碱 (oxymatrine,OMT)是从苦参 (Sophora flavescens Ait)等豆科槐属植物中提取的生物碱,分子式为C15H24N2O,具有四环的喹嗪啶类结构。文献报道OMT具有抗炎、抗氧化、抗病毒及免疫调节等多方面的药理作用[4-5]。近几年对OMT的研究有很多,多集中在抗肝炎及抗肿瘤方面,但关于OMT对脑血管疾病的研究鲜有报道。本实验采用行为学评分及TTC染色评价了OMT的脑保护作用,应用激光共聚焦显微镜 (Confocal)及Western blot方法观察了OMT对局灶性脑梗死小鼠脑组织Nrf2核转位的形态学改变及核蛋白表达的影响,旨在从Nrf2蛋白水平探讨OMT抗氧化的脑保护作用机制。
1 材料与方法
1.1 动物与试剂 健康雄性C57小鼠36只,体质量24~26 g,由河北医科大学基础医学院动物实验中心提供 (许可证号DK0403-007),清洁级。OMT(购自陕西慧科植物开发有限公司,纯度98%,生产批号SF20061215),临用时以蒸馏水制成混悬液 (40 g/L)。电子天平 (日本AND HR-120,精确度为0.1 mg);低温离心机 (德国eppendorf,Centrifuge 5417R),凝胶成像分析系统 (SYNGENE)。
1.2 实验方法
1.2.1 模型制作 参照Longa等[6]和Koizumi等[7]的线栓法制作小鼠左侧大脑中动脉闭塞的动物模型,用10%水合氯醛(350 mg/kg)腹腔注射麻醉后,做颈前皮肤正中切口,分离暴露右侧颈三角,仔细分离右侧颈总动脉 (CCA)、颈外动脉(ECA)和颈内动脉 (ICA),用微动脉夹夹闭CCA,之后用双极电凝笔电凝ECA的分支,并将分支结扎、断离;游离ECA主干,在距CCA分叉3~4 mm处结扎、离断;沿ICA分离暴露翼腭动脉;微动脉夹夹闭ICA;ECA残端剪一0.2 mm小口,将制备好的栓线 (直径0.18~0.20 mm,长约1.5 cm的尼龙鱼线,头端呈球形,距头端1.1 cm处做一标记)插入,在ECA剪口处打一松结以阻断ICA的血液反流,去除ICA的微动脉夹,将线从ECA插入,进入ICA的颅内段,进线长度为距CCA分叉处 (1.1±0.05)cm,此时进线有轻微阻力,栓线正好插至颅内大脑前动脉,堵住大脑中动脉的开口。结扎、切断游离的ECA和栓线,去除CCA的微动脉夹,消毒缝合颈部皮肤。术中及术后用白炽灯照射动物以维持其肛温在(37±1)℃。缺血60 min后拔出线栓,实现大脑中动脉缺血/再灌注模型。
1.2.2 动物分组 将小鼠随机分为3组:假手术组 (Sham组)、局灶性大脑中动脉缺血/再灌注组 (MCAO组)、OMT(120 mg/kg)治疗组。其中Sham组不插线栓,其余均同MCAO组,MCAO组及OMT组均给予腹腔注射给药,将药物以0.9%氯化钠溶液制成相同浓度混悬液 (40 g/L),OMT组给予OMT 120 mg/kg,Sham组给予1 ml 0.9%氯化钠溶液,于手术完毕后即刻腹腔注射给药,24 h后进行神经功能缺损评分及各项指标观察。
1.2.3 神经功能缺损评分 参考Longa等[6]的5级4分法,在动物麻醉清醒后24 h进行评分并记录神经功能缺损症状,评分标准如下:0分:无神经损伤症状;1分:提尾时病灶对侧前肢不能完全伸直;2分:行走时向瘫痪侧转圈;3分:行走时向病灶对侧跌倒;4分:不能自发行走,意识丧失。
1.2.4 脑梗死体积测定 各实验组分别取5只小鼠进行TTC染色,缺血/再灌注术后24 h,相应实验组小鼠断头处死,完整取出脑组织,将大脑均匀切成5片冠状切片。脑片浸入2%TTC溶液,37℃恒温水浴中孵育30 min染色,染色后于4%多聚甲醛中固定24 h,数码相机摄像,利用图像分析软件Image J(ver1.37c,NIH)测定脑梗死面积和脑梗死体积 (红色区域为正常脑组织,苍白色区域为梗死区)。应用 Belayev等[8]的计算公式纠正水肿:矫正梗死体积百分比= (矫正梗死体积/非缺血侧半球体积) ×100%。
1.2.5 组织荧光化学染色 各实验组分别取3只小鼠进行形态学观察,缺血/再灌注24 h后,以10%水合氯醛 (350 mg/kg)麻醉,剪开胸腔,暴露心脏,从心尖处插入灌注针至左心室,并剪开右心耳形成灌注液排出通道,从左心室快速灌注0.9%氯化钠溶液100 ml,然后以4%多聚甲醛约200 ml灌注固定,于30 min左右灌注完毕,迅速取脑置于20%多聚蔗糖溶液中固定24 h以上,切片前浸泡于4%多聚甲醛溶液直至下沉,切片厚约45 μm,磷酸盐缓冲液 (PBS)冲洗3次,10%马血清/TBS 60 min阻断非特异性染色,兔多克隆抗Nrf2(1∶200)抗体,含0.5%TritonX-100在4℃摇床过夜,次日TBS洗10 min×3,加入荧光二抗 (1∶1 000) 和4,6-二脒基-2-苯基吲哚 (4,6-diamidino-2-phenylindole,DAPI)染料以标记细胞核37℃ 30 min,避光TBS洗10 min×3,激光共聚焦显微镜观察、照相。
1.2.6 Western blot法检测蛋白表达 每组分别取4只小鼠用于核蛋白提取,小鼠于术后24 h断头取脑,于冰上分离缺血侧皮层脑组织,置冻存管中放入液氮,再转移到-80℃冰箱保存,用于提取总蛋白。将样本剪碎,按7倍体积加入总蛋白提取液,如样本50 mg配制350 μl蛋白提取液。组织经超声匀浆破碎,4℃放置1 h,4℃ 12 000 r/min离心30 min,取上清,分装后-80℃冻存,待实验用,用试剂盒测定蛋白浓度。制备不连续SDS-聚丙烯酰胺凝胶 (4%浓缩胶和10%分离胶),灌满后将梳子插入浓缩胶中,待浓缩胶凝固后,两手分别捏住梳子的两边竖直向上轻轻将其拔出,用水冲洗浓缩胶,将其放入电泳槽中。取各组总蛋白40 μg,与等体积上样缓冲液 (Buffer B)混合,煮沸10 min,使蛋白充分变性,4℃12 000 r/min离心2 min,将提取的蛋白加于凝胶加样孔内。浓缩胶上所加电压为80 V,当染料前沿进入分离胶后电压改为100 V,溴酚兰移动至胶底部时终止电泳,时间约为100 min。电泳完毕,剥胶,按蛋白Marker切胶,将3层滤纸、PVDF膜、胶及另外3层滤纸在转膜缓冲液中浸泡10 min后并依次从正极向负极叠放,在4℃条件下100 V恒压转膜2 h,将凝胶上的蛋白质转移至PVDF膜。用丽春红S染PVDF膜2~5 min,去离子水漂洗脱色,鉴定转膜效果。5%脱脂奶粉室温封闭PVDF膜1 h,同时加入兔多克隆抗Nrf2抗体 (1∶400,封闭液稀释)4℃孵育过夜,TPBS洗膜5次,每次5 min,同时加入羊抗兔IgG荧光抗体 (1∶3 000,封闭液稀释),37℃孵育1 h,TPBS洗膜4次,每次5min,PBS洗膜5 min。Odyssey远红外荧光扫描成像系统扫描并测定目标带单位密度。扫描完毕后,用洗膜液洗膜3次,每次10 min,加入鼠抗β-actin多克隆抗体 (1∶400,封闭液稀释)4℃孵育过夜,TPBS洗膜5次,每次5 min,加入羊抗鼠IgG荧光抗体 (1∶3 000,封闭液稀释),37℃孵育1.5 h,TPBS洗膜4次,每次5min,PBS洗膜5 min。化学发光,显影,定影后Odyssey远红外荧光扫描成像系统扫描并测定目标带单位密度,检测β-actin(1∶500,封闭液稀释)的表达作为参照,Nrf2/β-actin的比值代表各组的蛋白相对表达水平。
1.3 统计学方法 采用SPSS 11.0统计软件进行统计学分析。各项检测结果均以 ()表示,当方差齐时多组数据比较采用方差分析 (ANOVA),两两比较采用q检验;当方差不齐时采用秩和检验。检验水准α=0.05。
2 结果
2.1 OMT对局灶性脑缺血再灌注小鼠神经功能缺失的影响MCAO组神经功能缺损评分明显高于Sham组〔Sham组:0分,MCAO组: (3.27±0.46) 分,q=8.46,P<0.05〕;OMT组神经功能缺损评分明显低于MCAO组〔MCAO组:(3.27±0.46)分,OMT组:(2.11±0.30)分,q=5.04,P<0.05,见图1〕。
2.2 OMT对局灶性脑缺血再灌注小鼠脑梗死体积的影响Sham组小鼠脑组织TTC染色表现为均匀一致的红色,而MCAO组缺血再灌注侧脑组织TTC染色出现大范围苍白色梗死区域。与MCAO组比较,OMT组梗死体积明显缩小,差异有统计学意义〔MCAO组:(0.48±0.04)%,OMT组:(0.30±0.02)%,q=3.46,P <0.05,见图2〕。
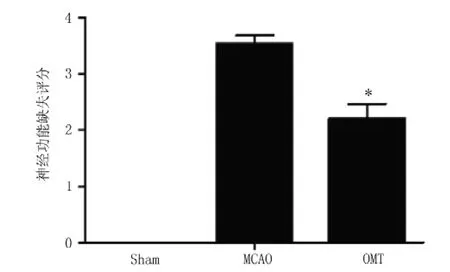
图1 OMT对局灶性脑缺血后神经功能缺失评分的影响Figure 1 Bar graph showing the effect of OMT on neurological deficit
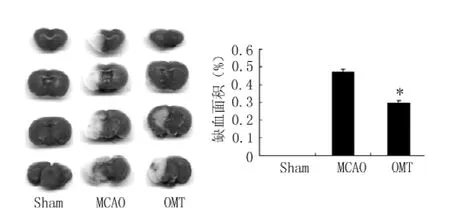
图2 OMT对局灶性脑缺血后脑梗死体积的影响Figure 2 Effects of OMT on cerebral infarction volume in MCAO mice
2.3 激光共聚焦显微镜观察OMT对Nrf2核转位影响 MCAO组可观察到部分Nrf2核转位,OMT治疗后诱导Nrf2核转位明显增加 (见图3)。
2.4 OMT治疗后Nrf2核蛋白水平变化 再灌注24 h后,Western blot检测结果显示,OMT治疗后能够明显诱导Nrf2核转位,增加Nrf2的核蛋白表达,且OMT组与MCAO组比较,Nrf2核蛋白表达明显增加 (MCAO组:0.82±0.47,OMT组:0.53±0.06,q=4.23,P <0.05,见图4)。
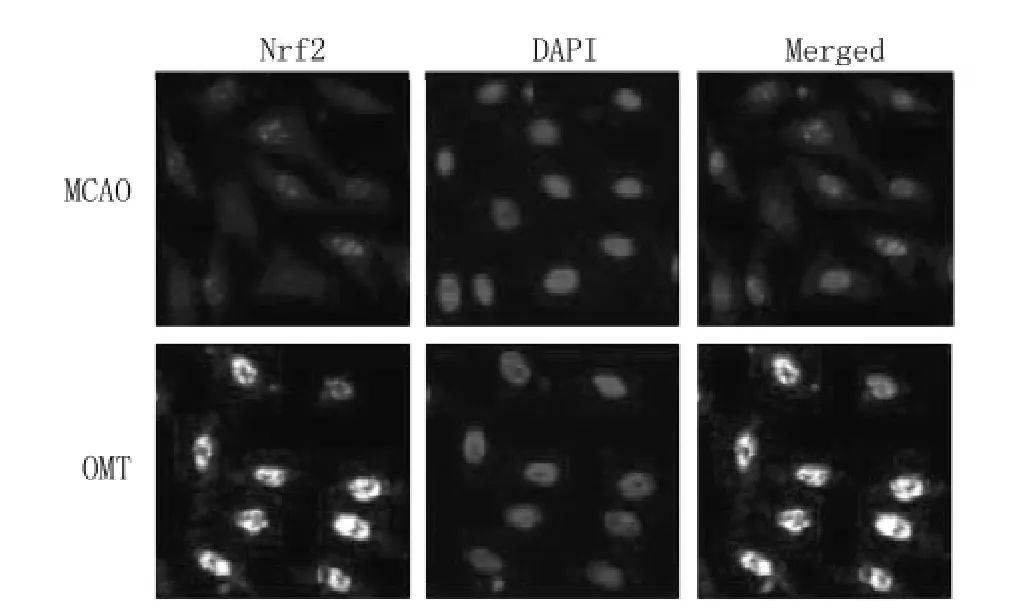
图3 OMT对局灶性脑梗死后脑组织的Nrf2核转位影响Figure 3 Effects of OMT on nuclear translocation of Nrf2 in MCAO mice
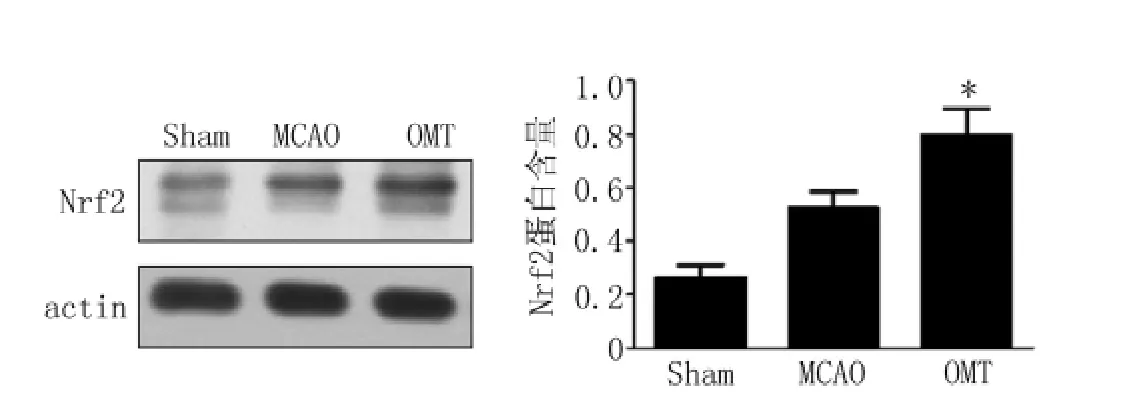
图4 OMT对局灶性脑梗死后Nrf2核蛋白表达的影响Figure 4 Graphs showing the nucleoprotein expression level of Nrf2 in Sham,MCAO and OMT groups
3 讨论
OMT抗氧化、抗炎及免疫调节作用正逐渐受到重视,研究表明OMT具有抗氧化、抗肿瘤、抗炎、抗凋亡、增强免疫功能等多种生物学作用,并且毒副作用低,具有良好的临床应用潜力[9]。OMT组织分布以肝脏最高,依次为脾、肺、脑、心、血。脏器药物浓度约在0.5 h达峰值,与血药浓度一致,易通过血-脑脊液屏障,OMT吸收完全而迅速,长期给药不积蓄。
脑缺血损伤见于许多临床病理过程,影响这一过程的因素是多方面的。一般认为,脑缺血损伤是典型的氧化应激损伤,氧自由基产生、炎症递质释放是其重要机制。然而,在临床实验中抗氧化治疗并没有效果,或许这些药物抗氧化通路的效果有限。长期以来对氧化应激发生机制缺乏清晰的认识,妨碍了人们对抗氧化物质在脑缺血损伤中的作用给出合理的解释。近年来认为Nrf2在氧化应激损伤中起重要作用[10]。
Nrf2于1994年由Moi等[11]作为结合在 β2珠蛋白基因启动子NF-E2重复序列的因子被克隆出,它是包括NF-F2、Nrf1、Nrf2、Nrf3、Bach1和Bach2碱性亮氨酸拉链 (basic leucine zipper,bZIP)蛋白家族中的一员,并且是活力最强的一个,具有高度保守的CNC(“cap'n'collar”) 结构区域[12]。正常情况下,Nrf2和细胞骨架蛋白Keap1以N端的Neh2区域结合成二聚体的形式存在于细胞质中,从而使保护细胞的酶类和抗氧化物处于基础表达水平,细胞处于稳定状态。Nrf2与Keap1解离可在以下两种情况下发生:一是当外界氧化应激因子或亲核物质刺激后,Keap1中的巯基改变;二是通过蛋白激酶C(PKC)途径使Nrf2磷酸化。Nrf2和Keap1解离后,Nrf2转位进入细胞核,与Maf、JunD、cJun、ATF4等形成杂化二聚体,然后与ARE启动子部位结合,ARE可介导细胞内参与氧化应激的基因转录水平的激活,Nrf2/ARE信号的表达增强,可以上调多种抗氧化酶、解毒酶的表达,提高细胞的抗氧化和解毒能力。
脑缺血/再灌注后进行神经功能缺损评分,测定梗死体积是评价脑缺血损伤程度的常用手段。由于大脑中动脉供应支配运动的脑组织,因此短暂性脑缺血术后的动物,麻醉清醒后即可观察到神经功能缺损症状。与人类类似,小鼠肢体同样受对侧大脑皮质交叉性支配,右侧中动脉缺血/再灌注后,导致左侧肢体肌无力,故动物运动时向左侧打圈,表现出典型的追尾征,严重时向左侧倾倒,甚至发生昏迷、死亡。在本实验中OMT治疗后,小鼠神经功能缺损评分较MCAO组降低,脑梗死体积减小,表明OMT可改善局灶性脑缺血/再灌注损伤后小鼠的神经功能缺损,降低脑梗死体积,从而发挥脑保护作用。
为进一步评价Nrf2在OMT的脑保护作用中的重要地位,本研究采用Confocal及Western blot技术检测了各实验组Nrf2核定位及核蛋白的表达。本研究中Sham组可见少量Nrf2核蛋白表达,于缺血/再灌注24 h后MCAO组Nrf2核转位增加,同时核蛋白含量较Sham组增加,与MCAO组比较,OMT组能显著上调缺血侧脑组织中Nrf2形态学核转位及核蛋白的表达量。由此可以推断,局灶性脑缺血后损伤组织释放的内源性激活物被Nrf2识别后,启动了Nrf2的信号传导通路,并进一步激活Nrf2转位进入细胞核,从而释放一系列抗氧化酶以稀释减弱因脑缺血产生的脑损伤。而OMT可以促进Nrf2的核转位,增加Nrf2的核蛋白表达,从而抑制之后一系列氧化损伤,并最终减轻脑损伤。二者之间又是通过怎样的方式、途经、环节发挥对氧化应激的调控作用等,尚需要进一步的实验研究证实。
目前有关中药对Nrf2在抗氧化方面的作用机制研究尚处于起步阶段,已有的资料不多,因此,对Nrf2在脑缺血氧化应激损伤中作用机制的进一步研究,将有助于阐明氧化应激与机体损伤之间的联系,并可能从氧化应激反应起点控制的角度揭开抗氧化因子参与脑缺血损伤发生、发展的机制。相信随着对Nrf2研究的不断深入,会为临床疾病的治疗带来新的思路。
1 Choi-Kwon S,Park KA,Lee HJ,et al.Temporal changes in cerebral antioxidant enzyme activities after ischemia and reperfusion in a rat focal brain ischemia model:effect of dietary fish oil[J] .Brain Res Dev Brain Res,2004,152(1):11 -18.
2 Zhao J,Kobori N,Aronowski J,et al.Dasha,Sulforaphane reduces infarct volume following focalcerebral ischemia in rodents[J].Neurosci Lett,2006,393(2-3):108-112.
3 Liu CZ,Yu JC,Zhang XZ,et al.Acupuncture prevents cognitive deficits and oxidative stress in cerebral multi-infarction rats[J] .Neurosci Lett,2006,393(1):45 -50.
4 Lu LG,Zeng MD,Mao YM,et al.Oxymatrine therapyfor chronic hepatitis B:a randomized double-blind and placebo-controlled multicenter trial[J] .World J Gastroenterol,2003,9(11):2480 -2483.
5 Zheng P,Niu FL,Liu WZ,et al.Anti- inflammatory mechanism of oxymatrine in dextran sulfate sodium -induced colitis of rats[J].World J Gastroenterol,2005,11(31):4912 -4915.
6 Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in Rats [J] .Stroke,1989,20(1):84-91.
7 Laing RJ,Jakubowski J,Laing RW,et al.Middle cerebral artery occlusion without craniectomy in rats.Which method works best?[J].Stroke,1993,24(2):294-297.
8 Tatlisumak T,Carano RA,Takano K,et al.A novel endothelin antagonist,A -127722,attenuates ischemic lesion size in rats with temporary middle cerebral 24 artery occlusion:a diffusion and perfusion MRI study[J] .Stroke,1998,29(4):850 -857.
9 Li M,Zhang X,Cui L,et al.The neuroprotection of oxymatrine in cerebral ischemia/reperfusion is related to nuclear factor erythroid 2-related factor 2(nrf2) -mediated antioxidant response:role of nrf2 and hemeoxygenase-1 expression [J] .Biol Pharm Bull,2011,34(5):595-601.
10 Nguyen T,Sherratt PJ,Pickett CB.Regulatory mechanisms controlling gene expression mediated by the antioxidant response element[J].Annu Rev Pharmacol Toxicol,2003,43:233 -260.
11 Moi P,Chan K,Asunis I,et al.Isolation of NF-E2-related factor 2(Nrf2),a NF-E2-like basic leucine zipper transcriptional activator that binds to the tandem NF-E2/AP1 repeat of the beta-globin locus control region [J] .Proc Natl Acad Sci U S A,1994,91(21):9926-9930.
12 Jain AK,Bloom DA,Jaiswal AK,et al.Nuclear import and export signal s in cont rol of Nrf2 [J] .J Biol Chem,2005,280(32):29158-29168.
