氟西汀和碳酸锂对慢性应激抑郁模型大鼠海马脑源性神经营养因子表达的影响
2012-02-27孔令韬汤艳清
吴 枫,孔令韬,汤艳清
抑郁症是一种以情绪低落、思维迟缓、行为迟滞为主要表现的常见精神疾病,并伴有食欲减退和睡眠障碍等躯体症状,给患者本人、家庭、社会带来了极大的危害和沉重的负担[1]。但到目前为止,人们对抑郁症的了解仍然很不完善,其病因、发病机制、治疗等方面都存在巨大空白。应激被认为是导致抑郁症发病的重要因素,近年来神经生物学研究也表明,应激事件等因素导致的大脑神经元可塑性改变及神经元功能受损可能是抑郁症的重要发病机制之一。脑源性神经营养因子 (brain-derived neurotrophic factor,BDNF)是神经营养因子 (neurotrophins,NTs)家族的成员之一,NTs家族是调节神经应答的一个分泌蛋白质家族,BDNF是NTs家族中表达最充分的一个,它不仅对神经元的分化极为重要,而且对成年大脑神经元的可塑性和存活具有重要意义。此外,当面临缺氧、缺血、接触神经毒物、应激等可能导致神经元损伤的情况时,BDNF还能提供神经保护作用[2]。临床研究表明,抑郁症患者的血清BDNF水平下降,而抗抑郁治疗能够提高血清BDNF水平[3-5],但在抑郁症发病过程中,BDNF在中枢神经系统的地位和作用尚不清楚。海马是介导应激反应的重要脑区之一,与抑郁症的发病关系密切[6],也是大脑内BDNF表达的重要场所。国内外研究均表明慢性应激所致抑郁能导致海马BDNF表达降低[7-8],提示海马BDNF表达减少可能在抑郁症的发病过程中起关键作用。本研究通过观察两种不同作用机制抗抑郁药物氟西汀和碳酸锂对慢性应激抑郁模型大鼠海马BDNF表达的影响,进一步探讨BDNF在抑郁症发病中的作用及抗抑郁药物的部分作用机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 雄性Wistar大鼠60只,体质量180~220 g,由中国医科大学实验动物中心提供,自由饮食水,光暗周期为12 h/12 h,实验前适应性饲养1周。用随机排列表法将大鼠分为4组:抑郁模型组、氟西汀组、碳酸锂组和对照组,各15只。
1.1.2 主要试剂 兔抗大鼠BDNF抗体 (武汉博士德生物工程有限公司),生物素标记的山羊抗兔 IgG,ECL试剂盒(Santa Cruz Co.)。
1.2 方法
1.2.1 动物模型制备 第1~21天,对照组大鼠正常饲养;抑郁模型组、氟西汀组和碳酸锂组大鼠随机接受7种不同的刺激:电击足底 (30~40 V,20 s/次,间隔1 min,共20次)、强迫游泳 (水温20℃,5 min)、夹尾 (1 min)、摇晃 (水平往复,1次/s,共15 min)、热应激 (45℃温箱,5 min)、禁食 (48 h)、禁水 (24 h)。每天随机给予一种刺激,每种刺激累计使用2 ~3次[7]。
1.2.2 行为学指标观察 制备模型前后,对各组动物进行开场法测定大鼠5 min内的行为表现,包括水平穿越格数、竖立次数、修饰次数等。制备模型前后,对各组大鼠进行液体消耗实验,计算24 h内蔗糖水消耗百分比 (糖水消耗/总液体消耗×100%)。
1.2.3 药物干预 氟西汀片剂 (20 mg/片)、碳酸锂片剂(250 mg/片)分别研磨成粉,溶于蒸馏水。第1~21天,每天应激前,氟西汀组大鼠灌胃氟西汀10 mg/kg,碳酸锂组大鼠灌胃碳酸锂60 mg/kg,抑郁模型组和对照组大鼠灌胃等体积的0.9%氯化钠注射液。
1.2.4 脑组织处理及Western blot测定 第22天,将大鼠断头处死,迅速取脑剥离海马组织,置于4℃环境中,加入300 μl裂解液匀浆并离心1 h,吸取上清液,进行免疫印迹测定。具体步骤如下:考马斯亮蓝G250法测定蛋白浓度后加入样品缓冲液调节样品蛋白浓度;灌胶,加样,电泳,转膜,5%脱脂奶粉封闭液中4℃过夜;加入按1∶250比例稀释的BDNF抗体,摇床上室温孵育2 h;加入按1∶400稀释的辣根过氧化物酶结合的山羊抗兔IgG,摇床上室温孵育2 h;ECL法显色;曝光,显影,定影。Western blot结果用 Chemi Imager 5500 V2.03软件扫描,再用Fluor Chen2.0软件定量分析测得IDV值。
1.3 统计学方法 采用SPSS 13.0统计学软件对数据进行分析。计量资料以 ()表示,多组间均数比较采用方差分析,对P<0.05的指标再用q检验进行组间两两比较,P<0.05为差异有统计学意义。
2 结果
2.1 4组大鼠慢性应激前后行为学指标的变化 慢性应激前,4组大鼠的水平穿越格数、竖立次数、修饰次数和糖水消耗百分比间差异无统计学意义 (P>0.05)。慢性应激21 d后:抑郁模型组大鼠水平穿越格数、竖立次数、修饰次数、糖水消耗百分比均显著低于对照组 (P<0.01);碳酸锂组大鼠水平穿越格数、竖立次数、修饰次数和糖水消耗百分比均显著低于对照组 (P<0.05);氟西汀组大鼠水平穿越格数、竖立次数、修饰次数和糖水消耗百分比均显著高于抑郁模型组 (P<0.05),水平穿越格数和竖立次数显著低于对照组 (P<0.05),而修饰次数和糖水消耗百分比与对照组比较差异无统计学意义 (P>0.05,见表1)。
表1 慢性应激前后4组大鼠开场行为及糖水消耗的比较 ()Table 1 Comparison of rat behaviors and sucrose consumption among four groups before and after stress stimulation
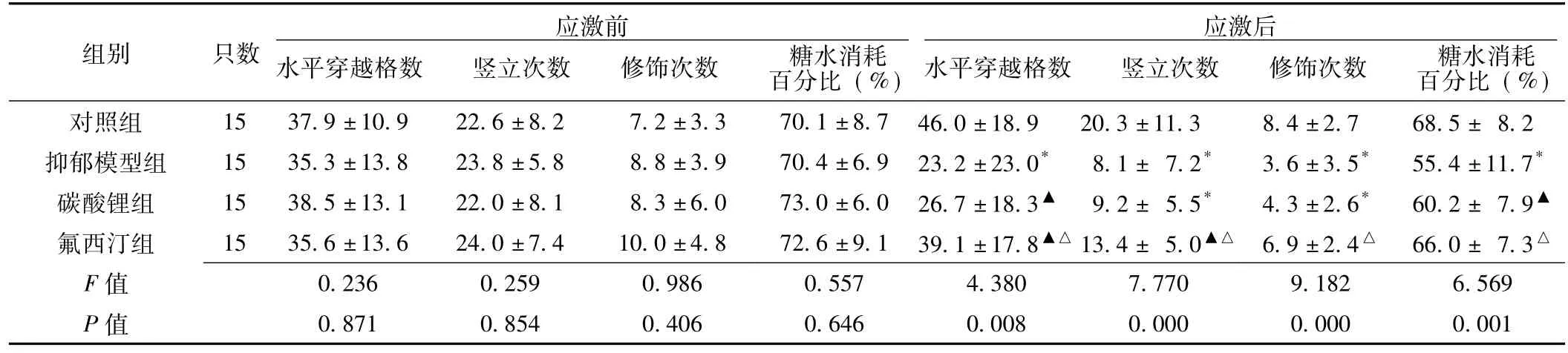
表1 慢性应激前后4组大鼠开场行为及糖水消耗的比较 ()Table 1 Comparison of rat behaviors and sucrose consumption among four groups before and after stress stimulation
注: 与对照组比较,*P <0.01,▲P <0.05; 与抑郁模型组比较,△P <0.05
组别 只数应激前水平穿越格数 竖立次数 修饰次数 糖水消耗百分比 (%)应激后水平穿越格数 竖立次数 修饰次数 糖水消耗百分比 (%)对照组 15 37.9 ±10.9 22.6 ±8.2 7.2 ±3.3 70.1 ±8.7 46.0 ±18.9 20.3 ±11.3 8.4 ±2.7 68.5 ± 8.2抑郁模型组 15 35.3 ±13.8 23.8 ±5.8 8.8 ±3.9 70.4 ±6.9 23.2 ±23.0* 8.1 ± 7.2* 3.6 ±3.5* 55.4 ±11.7*碳酸锂组 15 38.5 ±13.1 22.0 ±8.1 8.3 ±6.0 73.0 ±6.0 26.7 ±18.3▲ 9.2 ± 5.5* 4.3 ±2.6* 60.2 ± 7.9▲氟西汀组 15 35.6 ±13.6 24.0 ±7.4 10.0 ±4.8 72.6 ±9.1 39.1 ±17.8▲△ 13.4 ± 5.0▲△ 6.9 ±2.4△ 66.0 ± 7.3△F 0.236 0.259 0.986 0.557 4.380 7.770 9.182 6.569 P 值 0.871 0.854 0.406 0.646 0.008 0.000 0.000 0.001值
2.2 免疫印迹法测定海马BDNF表达 慢性应激后4组大鼠海马BDNF表达水平比较,差异有统计学意义 (P<0.01);其中抑郁模型组大鼠海马BDNF表达水平显著低于对照组 (P<0.01);碳酸锂组大鼠海马BDNF表达水平显著高于抑郁模型组 (P<0.01),但仍显著低于对照组 (P<0.01);氟西汀组大鼠海马BDNF表达水平显著高于抑郁模型组 (P<0.01),与对照组比较差异无统计学意义 (P>0.05,见表2)。
表2 免疫印迹法检测4组大鼠海马BDNF表达的比较 ()Table 2 Comparison of BDNF expression levels in hippocampus of rats in four groups by Western blotting method

表2 免疫印迹法检测4组大鼠海马BDNF表达的比较 ()Table 2 Comparison of BDNF expression levels in hippocampus of rats in four groups by Western blotting method
注:与对照组比较,*P<0.01;与抑郁模型组比较,△P<0.01
组别 只数 BDNF的表达水平 (IDV值)对照组 15 35 437±2 096抑郁模型组 15 22 796±7 392*碳酸锂组 15 29 761±3 125*△氟西汀组 15 32 659±3 359△F 值0.000 22.090 P值
3 讨论
慢性不可预见性应激 (CUMS)抑郁模型[9]采用轻度、不可预见的应激因子模拟人类生活事件和环境应激刺激等心理社会因素,其理论依据与人类抑郁症中慢性、低水平的应激原促进疾病发生、加速疾病发展的机制更接近,是近年来国内外广泛应用的探讨抑郁症发病机制及抗抑郁药物的药理学研究的动物模型之一。本研究中,抑郁模型组大鼠经过21 d的慢性综合应激,与对照组大鼠相比活动能力降低、探究行为减少、修饰次数减少以及糖水消耗百分比下降,这些表现与临床抑郁症患者所表现的精神运动改变、兴趣或快感的丧失有很大程度的相似性,说明本研究中大鼠抑郁症模型的制作是成功的[7]。
本研究结果表明,经过21 d的慢性综合应激,抑郁模型组大鼠海马BDNF表达较对照组显著降低,这提示抑郁症的发病可能与BDNF表达降低有关。海马是介导应激反应的重要脑区,也是大脑具有可塑性和极易受损的一个脑区,因而在对抑郁症发病机制的研究中备受关注。研究表明,慢性应激可导致海马出现体积减小、细胞数目减少、细胞萎缩及增生抑制等多种神经元可塑性受损的表现,同时伴有学习、记忆和情绪反应的缺陷[10]。大脑内的BDNF主要由海马和大脑皮质合成,在对正常神经元的营养及损伤神经元的再生和功能重建方面发挥重要作用。本研究结果中慢性应激导致大鼠海马BDNF表达明显减低,这与国外类似研究结果是一致的[11-12],说明慢性应激导致的海马神经元可塑性和功能受损可能与海马BDNF表达降低有关,应激导致的大脑内BDNF水平下降可能是抑郁症发病的内在病理生理机制之一。但也有研究得出了相反的结论[13],这可能与不同研究采用的动物模型和应激强度的差异有关。
本研究还发现氟西汀组和碳酸锂组大鼠在经过21 d的慢性综合应激后,其行为学表现好于抑郁模型组大鼠,说明这两种药物都能改善抑郁行为,而且氟西汀的效果要好于碳酸锂;氟西汀组和碳酸锂组大鼠海马BDNF表达均显著高于抑郁模型组,氟西汀组的BDNF表达与对照组无显著差异,但碳酸锂组则显著低于对照组。氟西汀是5-羟色胺再摄取抑制剂 (serotonin reuptake inhibitors,SSRIs)类抗抑郁药物的代表药物,是目前临床上治疗抑郁症的一线药物之一,具有良好的抗抑郁作用。以往SSRIs类药物被认为主要是通过调整突触间隙5-羟色胺的浓度来起到抗抑郁作用,但近年来人们发现,包括氟西汀在内的SSRIs能够逆转慢性应激导致的BDNF的mRNA表达水平下降[13-14],这与本研究结果是一致的。碳酸锂作为最早应用于临床治疗的情感稳定剂,是治疗急性双相抑郁障碍的一线药物,同时也被作为抗抑郁药物的增效剂用于单相抑郁发作的治疗,能够增强抗抑郁药物的治疗效果。有研究报道碳酸锂能增加大鼠海马BDNF水平[15],但另外的研究则不支持这一结论[16]。本研究结果显示,碳酸锂能够上调大鼠海马BDNF表达水平,但效果弱于氟西汀,也无法使其回到正常水平,这一结果一方面说明其抗抑郁疗效的有限性,同时也提示其作用机制有待于进一步研究。综合本研究结果,我们推测抗抑郁药物通过上调海马BDNF的表达,增强BDNF对神经元的营养、保护作用,可能是抗抑郁药物发挥疗效的重要中间环节。
综上所述,慢性应激导致海马BDNF水平的变化可能是抑郁症发病的内在病理生理机制,抗抑郁药物对BDNF水平的调控可能是其发挥抗抑郁疗效的靶点之一,故提高脑内BDNF水平以增强对神经元损伤的保护也可能对抑郁症的治疗起到积极效果。不同种类的抗抑郁药物疗效不同,他们的作用机制也有差异,联合应用多种不同机制的抗抑郁药物治疗是否能够通过他们各自作用机制的特异性影响起到联合增效作用将是下一步的研究方向。
1 Saraceno B.The WHO World Health Report 2001 on mental health [J].Epidemiol Psichiatr Soc,2002,11(2):83-87.
2 Duman RS,Monteggia LM.A neurotrophic model for stress-related mood disorders [J].Biol Psychiatry,2006,59(12):1116-1127.
3 Aydemir O,Deveci A,Taneli F.The effect of chronic antidepressant treatment on serum brain-derived neurotrophic factor levels in depressed patients:a preliminary study[J].Prog Neuropsychopharmacol Biol Psychiatry,2005,29(2):261-265.
4 Aydemir C,Yalcin ES,Aksaray S,et al.Brain-derived neurotrophic factor(BDNF)changes in the serum of depressed women[J].Prog Neuropsychopharmacol Biol Psychiatry,2006,30(7):1256-1260.
5 Brunoni AR,Lopes M,Fregni F.A systematic review and meta-analysis of clinical studies on major depression and BDNF levels:implications for the role of neuroplasticity in depression[J].Int J Neuropsychopharmacol,2008,11(8):1169-1180.
6 Drevets WC,Price JL,Furey ML.Brain structural and functional abnormalities in mood disorders:implications for neurocircuitry models of depression [J].Brain Struct Funct,2008,213(1/2):93-118.
7 朱宇章,彭淼,丁宝坤,等.慢性应激对大鼠外显行为及海马亚区脑源性神经营养因子表达差异性的影响[J].中国行为医学科学,2004,13(5):481-483.
8 Rasmusson AM,Shi L,Duman R.Downregulation of BDNF mRNA in the hippocampal dentate gyrus after re-exposure to cues previously associated with footshock [J]. Neuropsychopharmacology,2002,27(2):133-142.
9 Willner P,Towell A,Sampson D,et al.Reduction of sucrose preference by chronic unpredictable mild stress,and its restoration by a tricyclic antidepressant[J].Psychopharmacology(Berl),1987,93(3):358-364.
10 Jayatissa MN,Bisgaard CF,West MJ,et al.The number of granule cells in rat hippocampus is reduced after chronic mild stress and reestablished after chronic escitalopram treatment[J].Neuropharmacology,2008,54(3):530-541.
11 Song L,Che W,Min-Wei W,et al.Impairment of the spatial learning and memory induced by learned helplessness and chronic mild stress[J].Pharmacol Biochem Behav,2006,83(2):186-193.
12 Grønli J,Bramham C,Murison R,et al.Chronic mild stress inhibits BDNF protein expression and CREB activation in the dentate gyrus but not in the hippocampus proper [J].Pharmacol Biochem Behav,2006,85(4):842-849.
13 Larsen MH,Mikkelsen JD,Hay-Schmidt A,et al.Regulation of brain-derived neurotrophic factor(BDNF)in the chronic unpredictable stress rat model and the effects of chronic antidepressant treatment[J].J Psychiatr Res,2010,44(13):808-816.
14 Zhang Y,Gu F,Chen J,et al.Chronic antidepressant administration alleviates frontal and hippocampal BDNF deficits in CUMS rat [J].Brain Res,2010,1366:141-148.
15 Jacobsen JP,Mørk A.The effect of escitalopram,desipramine,electroconvulsive seizures and lithium on brain-derived neurotrophic factor mRNA and protein expression in the rat brain and the correlation to 5-HT and 5-HIAA levels[J].Brain Res,2004,1024(1/2):183-192.
16 Hammonds MD,Shim SS,Feng P,et al.Effects of subchronic lithium treatment on levels of BDNF,Bcl-2 and phospho-CREB in the rat hippocampus [J].Basic Clin Pharmacol Toxicol,2007,100(5):356-359.
