Negishi偶联反应在沙坦类药物联苯基合成中的应用
2012-02-25王晓东黄素萍郝卫强
王晓东, 黄素萍, 时 敏, 郝卫强, 陈 强
(1.常州四药制药有限公司,江苏常州213004;2.南京大学常州高新技术研究院,江苏常州213164)
血管紧张素Ⅱ(AngII)的Ⅰ型受体(AT1受体)拮抗剂是近年来上市的新一代抗高血压药物,其全球销售额已超过百亿美元,并逐步替代血管紧张素转换酶(ACE)抑制剂——普利类药物在降压药中的领先地位[1]。其中,缬沙坦(商品名:Diovan;代文)为沙坦类药物中的领头羊,该药由瑞士诺华公司于1996年研发上市,2010年销售额已达60亿美元。
针对传统的沙坦类药物合成路线[1],本文研究了一条简便易行的沙坦类药物合成方法,即先将2种化合物原料合成中间体,然后再与第3种化合物偶联。其中,该中间体与第3种化合物合成目标产物的过程充分利用了Negishi偶联反应的研究成果。值得一提的是,日本化学家根岸英一正是利用钯催化的交叉偶联反应技术,高效地将碳碳原子相连,减少大量无用的物质生成而获得2010年度诺贝尔化学奖。
Negishi偶联反应中具有催化活性的是零价的金属钯,该反应整体上经过了卤代烃对金属的氧化加成、金属转移与还原消除等3步,其反应机制如图1所示。

图1 Negishi偶联反应机制示意图Figure 1 Schematic diagram of Negishi coupling reaction mechanism
为了研究Negishi偶联反应在沙坦类药物联苯基形成过程中的应用,笔者以缬沙坦的合成为例展开了试验。以价廉易得的戊酰氯、L-缬氨酸甲酯、对溴苄溴、5-苯基四氮唑和三苯基氯甲烷为原料,通过对缬沙坦传统合成路线中关键中间步骤的研究和改进,避免了叠氮化钠和有机锡的使用,合成了目标化合物缬沙坦(7),其反应路线见图2。
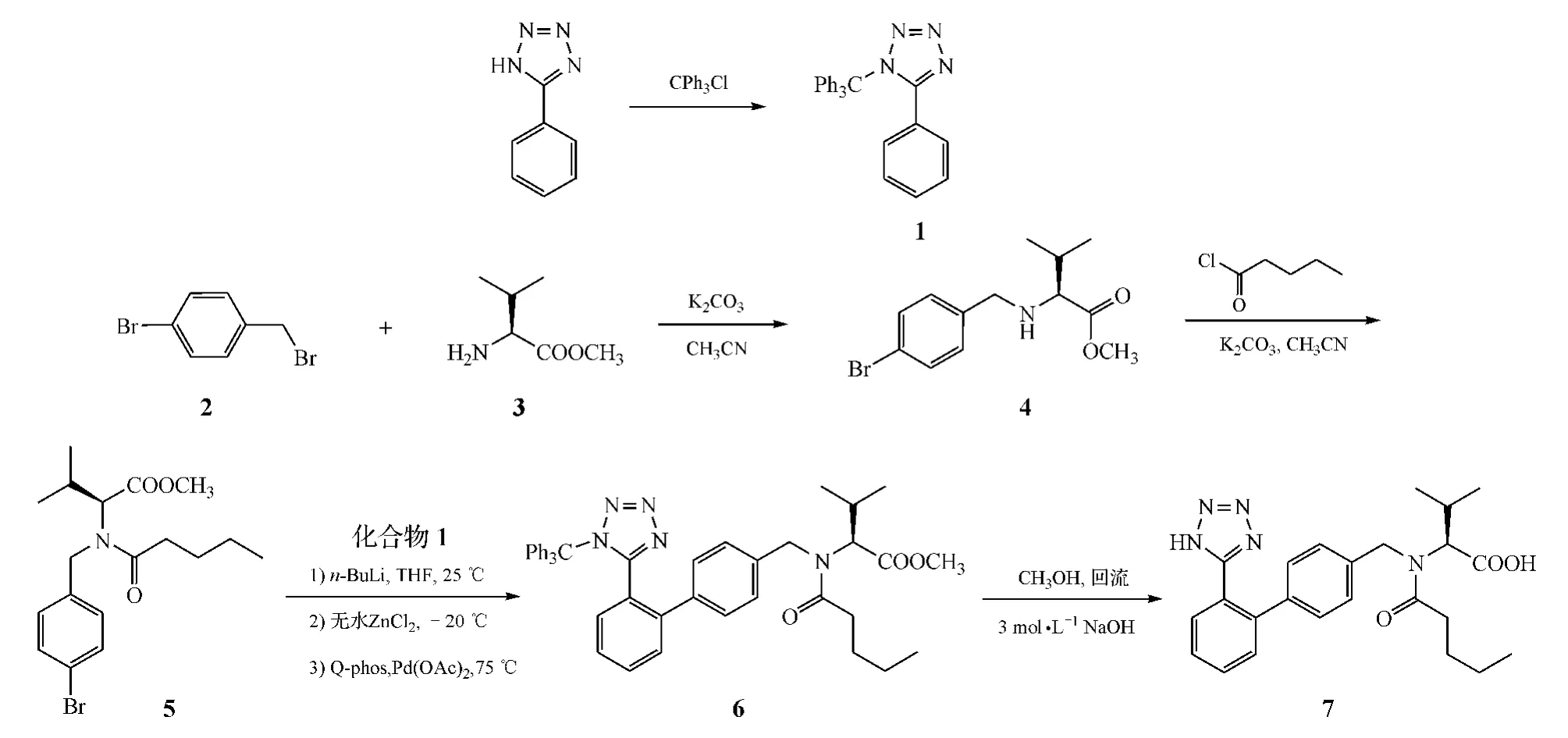
图2 缬沙坦的合成路线Figure 2 Scheme for the synthesis of valsartan
1 材料
1.1 试剂
所有溶剂和试剂均购自国药集团化学试剂有限公司,未经进一步纯化;有机溶剂在减压状态下浓缩。硅胶GF254薄层板(上海东方药品科技实业有限公司)。
1.2 仪器
YRT-3型熔点仪(天津大学精密仪器厂),温度未经校正;AM-400型核磁光谱仪(德国Bruker光谱仪器公司,TMS为内标,DMSO-d6(上海涞昂生物科技有限公司)为溶剂;MAT212型质谱仪(美国Vazian公司);FTS 185型红外光谱测定仪(美国Bio-Rad公司),KBr压片;1106型元素分析仪(意大利Carlo erba公司)。
2 方法与结果
2.1 5-苯基-1-三苯甲基四氮唑(1)的合成
在1 000 mL三颈瓶中加入5-苯基四氮唑21 g和二氯甲烷520 mL,溶解后加入三苯基氯甲烷42.4 g,边搅拌边滴加三乙胺24 mL,滴毕加热回流3 h,冷却至室温,水洗2次(100 mL×2),干燥,浓缩得白色固体65 g,再用甲苯140 mL重结晶,得白色粉末45 g,收率81%。
2.2 N-[(4-溴)-苯甲基]-L-缬氨酸甲酯(4)的合成
在1 000 mL三颈瓶中加入 L-缬氨酸甲酯(25 g,0.191 mol)、碳酸钾(175.9 g,1.27 mol)和乙腈400 mL,滴加溶于乙腈200 mL中的对溴苄溴(39.75 g,0.16 mol),滴毕将混合溶液加热至70℃反应2 h,然后冷却至0℃,过滤,用乙腈洗涤,得淡黄色固体47.5 g,收率99%。
2.3 N-戊酰基-N-[(4-溴)-苯甲基]-L-缬氨酸甲酯(5)的合成
在100 mL三颈瓶中加入化合物4(4.8 g,0.016 mol)、碳酸钾(6.9 g,0.05 mol)和乙腈 60 mL,于35℃以下滴加戊酰氯(5.04 g,0.042 mol),滴毕保温反应2 h,过滤,滤液用无水硫酸钠干燥,浓缩得棕色油状物7.8 g。
2.4 N-戊酰基-N-{[2'-(N'-三苯甲基-四氮唑-5-基)-(1,1'-二苯基)-4-基]-甲基}-L-缬氨酸甲酯(6)的合成
先对四氢呋喃(THF)进行无水处理:将THF 400 mL置于1 000 mL三颈瓶中,加入二苯甲酮2~3粒作为指示剂,将金属钠剪成钠丝投入THF中,抽冲氮气4~5次,在氮气保护下加热回流至溶液变为蓝色,常压蒸馏,收集65℃馏分,密封放干燥器中保存。
在250 mL三颈瓶中加入化合物1(2.0 g,5.15 mmol)和无水处理后的THF 20 mL,溶解后在25℃氮气保护条件下滴加溶于2 mol·L-1己烷的正丁基锂(3.2 mL,6.18 mmol),保温搅拌1 h,再冷却至-20℃。加入无水氯化锌(1.25 g,9.27 mmol),于-20℃下搅拌30 min。升温至25℃,依次投入化合物 5(2.37 g,6.18 mmol)、1,2,3,4,5-五苯基-1'-(二叔丁基磷基)-二茂铁(Q-phos)(0.182 g,0.25 mmol)和醋酸钯(0.06 g,0.25 mmol),加热至75℃回流2 h,用TLC检测反应进程直至起始原料全部消耗完。向反应液中加入水30 mL,用乙酸乙酯萃取3次(50 mL×3),分出有机相并干燥浓缩,所得剩余物过硅胶柱,以庚烷-乙酸乙酯(7∶3)洗脱,得白色固体2.72 g,熔点45~47℃,收率76%。
2.5 N-戊酰基-N-{[2'-(N'-四氮唑-5-基)-(1,1'-二苯基)-4-基]-甲基}-L-缬氨酸(7)的合成
在250 mL三颈瓶中加入化合物6(2 g,2.89 mmol)和甲醇 20 mL,溶解后加入 3 mol·L-1NaOH溶液2.85 mL,加热回流6 h,用TLC检测反应进程直至起始原料全部反应完。将反应混合液浓缩至干,向其中加入乙酸乙酯100 mL和水20 mL,用2 mol·L-1稀盐酸调 pH 至4.0,分出有机相,水相再用乙酸乙酯萃取3次(50 mL×3),合并有机相并用无水硫酸钠干燥,浓缩得粗品1.12 g(收率90%),用乙酸乙酯重结晶得终产物缬沙坦0.9 g(收率80%),熔点114~118 ℃。1H-NMR(DMSO-d6)δ:12.8(brs,1H),7.70 ~ 7.61(m,2H),7.59 ~ 7.49(m,2H),7.21(d,1H),7.11(m,1H),7.08(m,1H),6.98(d,1H),4.64(s,1H),4.48(s,1H),4.10(m,1H),2.47(m,2H),2.02 ~ 2.23(m,1H),1.55(m,2H),1.31 ~ 1.15(m,2H),0.94(m,3H),0.88(m,3H),0.74(m,3H);13C-NMR(DMSO-d6)δ:173.5,171.9,141.3,138.3,137.8,137.2,131.1,130.7,130.6,128.9,128.4,127.7,127.0,126.3,123.4,63.0,48.8,32.6,27.7,26.9,21.8,20.2,18.9,13.8。FAB-MS m/e:436(M+H),352,307,291,235,207,192,179。IR(cm-1):3 070,3 030,3 000 ~2 500,1 605,1 516,1 203。元素分析(C24H29N5O3)理论值(实测值):C 66.18%(66.45%),H 6.71%(6.93%),N 16.07%(15.98%)。
3 讨论
缬沙坦传统的合成路线是以氰基联苯为起始原料再合成四氮唑,该路线的缺点是:一方面,氰基联苯毒性强且成本高;另一方面,使用了毒性很强的三丁基叠氮化锡以及危险性高、易爆炸的叠氮化钠,因此,该工艺路线用于大规模工业化生产时易产生安全隐患、环境污染和药物金属残留物等难以处理的问题。
已有文献报道以芳基偶联的方法来合成沙坦类药物,如通过Negishi偶联或Ullmann偶联合成氯沙坦[2-5];通过 Suzuki-Miyaura 偶联合成缬沙坦等[6]。在这些偶联反应中,Negishi偶联表现得更加高效,原因在于其反应中使用无机锌试剂,基本不影响其他官能团的化学选择性,且催化剂的用量相对较少,偶联反应的收率高。
本文报道了一种全新的、简单有效的通过Negishi偶联合成缬沙坦的方法,避免了使用一些毒性较大、金属残留难处理(如有机锡类化合物)、易爆的化学试剂,且所用原料廉价易得、步骤较少、收率高,适合工业化生产。与 Ghosh等[7]报道的Negishi偶联合成缬沙坦的工艺相比,本法一方面在合成化合物5时避免了活性很高的强碱NaH的使用,操作条件更为简单温和,给工业化生产提供了安全性保障;另一方面,在偶联反应中对溶剂THF进行了无水处理,现制现用,不仅进一步提高了无机锌试剂的活性及正丁基锂的使用安全性,且在放大10倍试验时使偶联反应收率由原来的65%提高至76%,大大增加了催化剂的有效利用率,也为中试放大及工业大生产提供了有效保障。
[1] Bühlmayer P,Furet P,Criscione L,et al.Valsartan,a potent,orally active angiotensin II antagonist developed from the structurally new amino acid series[J].Bioorg Med Chem Lett,1994,4(1):29-34.
[2] Negishi E,King A O,Okukado N.Selective carbon-carbon bond formation via transition metal catalysis.3.A highly selective synthesis of unsymmetrical biaryls and diarymethanes by the nickel-or palladium-catalyzed reaction of aryl-and benzylzinc derivatives with aryl halides[J].J Org Chem,1977,42(10):1821-1823.
[3] Nicolaou K C,Bulger P G,Sarlah D.Palladium-catalyzed cross-coupling reactions in total synthesis[J].Angew Chem:Int Ed Engl,2005,44(29):4442-4489.
[4] Fanta P E.The Ullmann synthesis of biaryls[J].Chem Rev,1946,38:139-196.
[5] Carini D J,Duncia J V,Aldrich P E,et al.Nonpeptide angiotensin II receptor antagonists:the discovery of a series of N-(biphenylylmethyl)imidazoles as potent,orally active antihypertensives[J].J Med Chem,1991,34(8):2525-2547.
[6] Miyaura N,Suzuki A.Palladium-catalyzed cross-coupling reactions of organoboron compounds[J].Chem Rev,1995,95(7):2457-2483.
[7] Ghosh S,Kumar A S,Mehta G N.A short and efficient synthesis of valsartan via a Negishi reaction[J].Beilstein J Org Chem,2010,6:27.
