盐酸头孢吡肟的合成
2012-02-02王红波杨银萍赵荐飞
王红波,杨银萍,赵荐飞
(1.鲁南制药集团股份有限公司,山东临沂276006;2.临沂大学化学实验中心,山东临沂276003)
盐酸头孢吡肟(Cefepime Hydrochloride),化学名为:1-[[(6R,7R)-7-[(2Z)-(2-氨基-4-噻唑基)-(甲氧亚氨基)乙酰胺基]-2-羧基-8-氧代-5-硫杂-1-氮杂二环[4.2.0]辛-2-烯-3-基]甲基]-1-甲基吡咯烷鎓氯盐酸盐,是20世纪90年代由Bristol-Myers Squibb公司研发的第四代头孢类抗生素。1993年首次在瑞典上市,1998年获得我国进口批准,并于2000年开始在我国临床上使用。目前已用于多种细菌感染性疾病的治疗[1],其结构式如下:
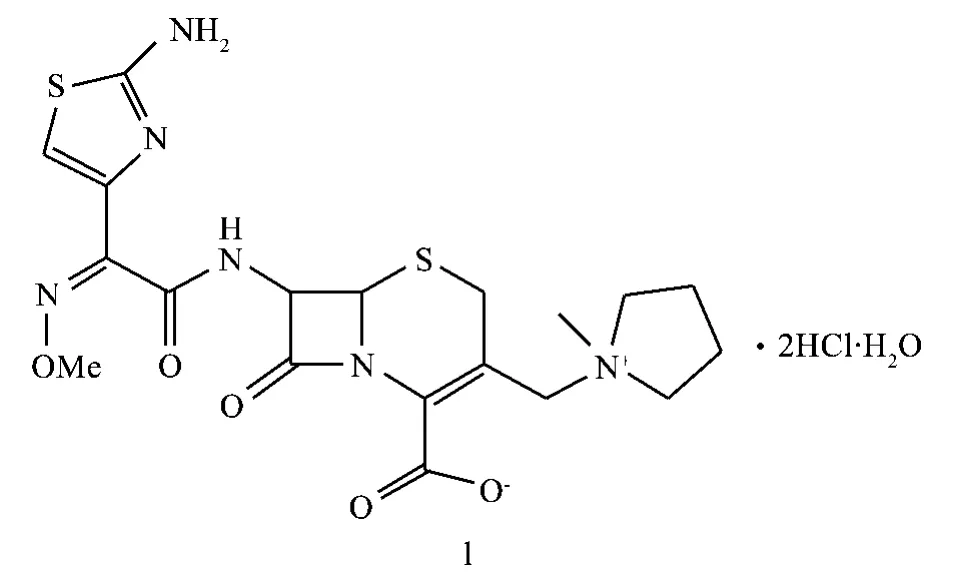
该化合物作为第四代头孢菌素,与第三代头孢菌素相比,抗菌谱更广,并增强了对革兰阳性菌的作用,特别是抗链球菌,肺炎链球菌的活性大大增强,显示了优良的广谱抗菌活性。同时对β内酰胺酶稳定,临床主要用于各种严重感染,如呼吸道感染、泌尿系统感染、胆道感染、败血症等[2,3]。
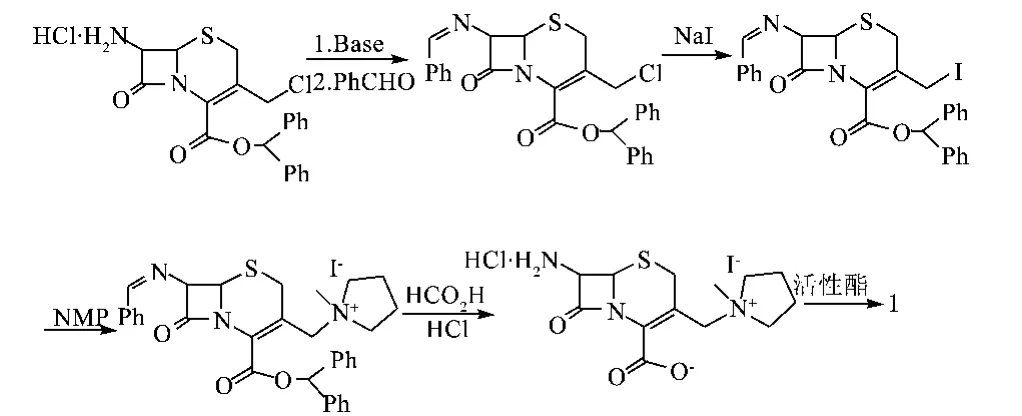
盐酸头孢吡肟的合成方法有多种,大部分以7-ACA及其衍生物为起始原料[4],如文献[5]报道:以保护羧基的7-ACA衍生物为起始原料,然后用苯甲醛保护分子中的氨基,再先后与NaI和N-甲基吡咯(NMP)反应,所得到的中间体用甲酸和盐酸脱保护,然后进一步与活性酯反应,得到盐酸头孢吡肟,反应式如下:
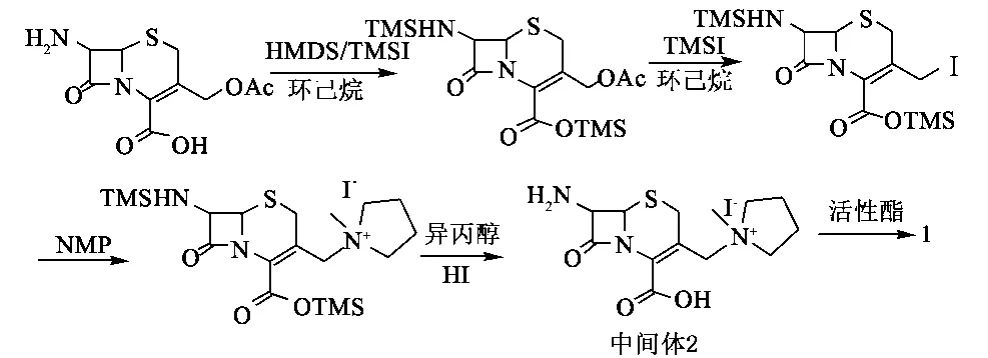
我们查阅了大量文献,并以实验为基础,选择以7-ACA为起始原料,在环己烷中,用六甲基二硅氨烷(HMDS)和三甲基碘硅烷(TMSI)将7-ACA中的氨基和羧基同时硅烷化,产物不需进一步分离,然后与NMP和TMSI的反应产物混合,在TMSI的作用下,生成重要的中间体2,所得中间体2在水和二甲基甲酰胺的混合溶剂中,与活性酯反应得到目标产物1,即盐酸头孢吡肟。该路线反应条件温和,原材料廉价易得,操作简单,收率、纯度高,且反应中所用溶剂毒性较小,可以回收套用,对环境污染小,有望成为工业生产头孢吡肟的主要方法,其反应式如下:
1 仪器和药品
1.1 仪器 Bruker-DRX500核磁共振仪,PerkinElmer 2400series型元素分析仪,LC-10AVP型高效液相色谱仪。
1.2 药品 7-ACA(工业级),AE活性酯(工业级),丙酮(工业级),环己烷(工业级),三乙胺(工业级),NaI(CP),六甲基二硅胺烷(工业级),三甲基碘硅烷(工业级),异丙醇(工业级),二甲基甲酰胺(工业级),二氯甲烷(工业级),氢碘酸(工业级),盐酸(工业级)。
2 实验部分
2.1 (6R,7R)-7-氨基-3-[(1-甲基-1-吡咯烷鎓盐)甲基]头孢-3-烯-4-羧酸氢碘酸盐(中间体2)的合成 40 g 7-ACA(147 mmol)、300 mL环己烷加入到1 000 mL三口瓶中,室温搅拌,滴加六甲基二硅胺烷37.2 mL(176 mmol),再加入三甲基碘硅烷0.8 mL(5.6 mmol),加热回流12 h,自然冷却到室温,得硅烷化的7-ACA,保存待用。
另取100 mL三口烧瓶,加入N-甲基吡咯21.36 mL (205.4 mmol)和环己烷80 mL,室温搅拌,缓慢滴加三甲基碘硅烷29.2 mL(205.4 mmol),搅拌10 min,保存待用。
将上面两份溶液充分混合,室温搅拌30 min,滴入三甲基碘硅烷8.4 mL(59 mmol),然后反应混合物缓慢升温到37℃反应40 h,反应混合物冷却到5℃,缓慢滴加异丙醇20 mL,充分搅拌,再滴加22.8%的氢碘酸溶液100 mL,搅拌15 min后静置分液,环己烷层用20 mL水洗涤,合并水相,先后用硅藻土和活性炭处理,过滤,固体用80 mL水洗涤,合并水相,加入异丙醇1 000 mL,0℃保温搅拌析晶1 h,过滤,真空干燥得中间体2 39 g(62.4%),经 HPLC测定,纯度为97.5%。1H-NMR(D2O,500 MHz)δ:2.14~2.33(m,4H),3.00(s,3H),3.46-3.67(m,5H),3.96(d,1H),4.09(d,1H),4.73(d,1H),5.21(d,1H),5.41(d,1H)。
2.2 盐酸头孢吡肟的合成 1 000 mL三口瓶中加入水550 mL、DMF 250 mL、中间体2 39 g和AE活性酯80 g,冷却至-5℃,充分搅拌,缓慢滴加三乙胺37 mL,控温0℃以下搅拌反应1 h,然后升至室温搅拌反应6 h,反应液用二氯甲烷萃取3次(200 mL×3),有机相再用300 mL水反萃一次,合并水相,水相活性炭和氧化铝处理,然后加入6 mol·L-1的盐酸40.6 mL,室温搅拌1 h,然后加入丙酮2.5 L,搅拌4 h,过滤,真空干燥,得盐酸头孢吡肟46.6 g,收率89%,经HPLC测定,纯度为99.5%。元素分析(C19H24N6O5S2·2HCl· H2O)测量值(计算值,%):C:39.3(39.9),H:4.7(4.9),O: 17.2(16.8),N:14.4(14.7),Cl:12.6(12.4),S:11.6(11.2);1H-NMR(DMSO,500 MHz)δ:2.09(m,4H),2.97(s,3H),3.46~3.64(m,4H),3.94(s,3H),4.11,3.71(dd,2H),4.61,4.41(dd,2H),5.38(d,1H),5.88(dd,1H),6.93 (s,1H),9.20(br s,4H),9.89(d,1H);13C-NMR(DMSO,500 MHz):δ:21.14,28.61,47.22,58.37,59.03,62.88,63.04,64.18,63.65,110.40,113.43,132.50,132.79,144.74,160.87,162.91,163.24,170.01。
[1] 梁月晴,尹文洁.头孢吡肟的药理作用及临床应用[J].中国全科医学,2000,3(4):313-314.
[2] 黎曙霞,任斌.头孢吡肟的临床应用[J].新医学,2004,35(1):49-50.
[3] 陈毓强,陈家璇.第四代头孢菌素——头孢吡肟[J].中国药业,1999,8(11):61.
[4] 郝军香,李谦和,彭东明.头孢吡肟的合成进展[J].合成化学,2004,12(1):43-48.
[5] Naito T,Aburaki S,Kamachi H,et al.Synthesis and structure-activity relationships of a new series of cephalosporins,BMY-28142 and related compounds[J].J Antibiot (Tokyo),1986,39(8):1092-1107.
