人骨髓胚胎样干细胞向多核肌纤维诱导分化的研究*
2012-01-30庞荣清张永云阮光萍朱向情王利民潘兴华
庞荣清, 张永云,2△, 阮光萍, 朱向情,2, 何 洁, 赵 晶, 王利民, 潘兴华, 张 成
(1成都军区昆明总医院干细胞与组织器官工程研究中心,云南昆明650032;2云南农业大学农科专业基础实验教学示范中心,云南昆明650201;3中山大学附属第一医院神经内科,广东广州510080)
肌营养不良症等肌病的治疗目前尚无有效手段。干细胞技术的发展虽然为此带来了新的希望,但疗效尚需进一步提高。其中,种子细胞的选择是影响干细胞治疗效果的关键因素之一[1]。
研究证实:成体骨髓中存在表达胚胎干细胞抗原标志的干细胞,如多潜能成体祖细胞(multipotential adult progenitor cells)[2]、骨髓来源成体多潜能诱导细胞(bone marrow-derived adult multilineage inducile cells)[3]和很小胚胎样干细胞(very small embryonic - like stem cells,VSELs)[4],在早期的文献中这类细胞的名称不同,近年来的文献[5-7]中逐渐使用胚胎样干细胞(embryonic-like stem cells,ELSCs)的命名。本研究根据Battula等[8]的方法,从骨髓中分离 ELSCs,然后开展了体外成肌分化实验研究,旨在为探索理想的肌病治疗种子细胞提供实验依据。

表1 引物序列Table 1.Sequences of the primers
材料和方法
1 主要试剂
成肌分化诱导试剂盒(SKGM-2 Kit,Lot No.CC-3245)购自 Lonza;明胶和2-mercaptoethanol购自 Sigma;DMEM/F12购自HyClone;Knockout-DMEM、血清替代物(serum replacement,SR)、glutamine、非必需氨基酸(non - essential amino acids,NEAA)、新生牛血清(newborn cattle serum,NCS)、FITC -goat-anti-rabbit IgG、FITC -rabbit-anti-goat IgG 和4',6-二脒基 -2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)均购自Invitrogen;碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)购自 Cell Systems;免疫染色用Ⅰ抗[rabbit-anti-human Oct-4、Nanog-3、MyoD,goat-anti-human Sox-2和mouse-anti-human成肌素(myogenin)、肌球蛋白重链(myosin heavy chain,MHC)]购自Santa Cruz;Ⅱ抗HRP-conjugated rabbit/mouse antibody购自Gene;所用引物(表1)和RT-PCR试剂盒为北京全式金生物技术有限公司产品。
2 主要方法
2.1 ELSCs和间充质干细胞(mesenchymal stem cells,MSCs)的分离培养 参照Battula等[8]的方法,密度梯度离心法分离骨髓单个核细胞,用无血清培养基重悬单个核细胞并转移到事先用明胶包被过的培养瓶中于37℃、5%CO2培养箱内静置培养以分离扩增ELSCs。无血清培养基是添加了20%SR、2 mmol/L L - glutamine、1%NEAA、0.1 mmol/L 2 - mercaptoethanol和5 μg/L bFGF的Knockout-DMEM培养液。培养瓶的包被:每个培养瓶中加入5 mL 0.1%明胶溶液室温条件下静置30 min,然后吸弃明胶溶液于室温条件下风干即可。作为对照,用含血清培养基重悬单个核细胞并转移到未包被的培养瓶中于37℃、5%CO2培养箱内静置培养以分离扩增MSCs。含血清培养基为含10%NCS的DMEM/F12培养液。倒置相差显微镜下观察细胞生长情况并拍照。每4 d换液,到细胞生长至80%融合状态时,用trypsin/EDTA消化传代细胞。取第2代细胞作细胞爬片行Oct-4、Nanog-3和Sox-2的免疫荧光染色。
2.2 体外成肌分化诱导实验 消化收集生长良好的第4代ELSCs,用无血清培养基重悬细胞,6孔板中事先放置明胶包被的盖玻片,按照2×104cells/well接种细胞到盖玻片上于37℃、5%CO2条件下培养24 h使其贴壁后,吸弃无血清培养基,换为试剂盒提供的成肌分化诱导培养液继续诱导培养。按照相应的培养方案和细胞密度,消化收集生长良好的第4代MSCs,用含血清培养基使其贴壁生长后,吸弃含血清培养基,换为上述成肌分化诱导培养液诱导培养。适时换液,取细胞爬片,用4%多聚甲醛固定后,免疫染色检测肌细胞抗原标志MHC、MyoD和myogenin的表达。采用相同的方法,第4代ELSCs和MSCs培养在细胞培养瓶中,细胞贴壁后,换为上述成肌分化诱导培养液诱导培养,消化收集细胞作RT-PCR分析。为了比较2种细胞的成肌分化效率,根据方法[9]计算样品的成肌分化效率,每个细胞爬片计数6个视野。计算公式:成肌分化效率=MHC阳性肌纤维数/计数的总细胞数目。
2.3 免疫细胞化学染色法 将各组细胞用PBS清洗之后,用4%甲醛固定10 min,再用0.5%Triton X-100破膜处理10 min。然后用PBS清洗3遍,加入封闭液室温条件下作用10 min,免疫荧光染色细胞滴加Ⅰ抗(rabbit-anti-human Oct-4、Nanog-3和 goat-anti-human Sox-2),4 ℃避光孵育10 h,PBS漂洗1次以去除未结合的Ⅰ抗,滴加Ⅱ抗(FITC-goat-anti-rabbit IgG或 FITC-rabbit-anti-goat IgG)于室温条件下避光孵育30 min,再滴加DAPI于室温条件下避光孵育5 min,PBS漂洗去除未结合的Ⅱ抗和DAPI。PBS替代Ⅰ抗染色作为阴性对照。荧光显微镜下观察拍照。非免疫荧光染色细胞滴加Ⅰ抗(rabbit-anti-human MyoD和mouse-anti-human myogenin、MHC),4 ℃孵育10 h,PBS漂洗1次以去除未结合的Ⅰ抗,滴加Ⅱ抗 HRP-conjugated rabbit/mouse antibody于室温条件下孵育30 min,PBS漂洗去除未结合的Ⅱ抗。PBS替代Ⅰ抗染色作为阴性对照。生物显微镜下观察并用 ×10或 ×20摄取。每组独立的实验都会采集超过30个区域的细胞。
2.4 RT-PCR 采用Trizol提取总RNA,分光光度法测定计算提取的总RNA含量及浓度,取5 μg RNA用于反转录合成互补DNA。参照RT-PCR试剂盒实验操作说明检测myogenin、MHC和MyoD mRNA的表达。扩增条件为:50℃逆转录30 min,94 ℃ 初始化 4 min,94 ℃ 30 s,60 ℃ 30 s,72 ℃ 1 min,45个循环,72℃ 7 min。GAPDH用作内参照控制。不加cDNA的反应设为对照。取扩增产物15 μL,加上样缓冲液2.0 μL,在1%琼脂糖凝胶上电泳,凝胶图像成像系统拍照。
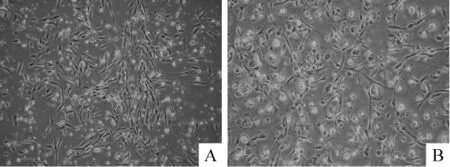
Figure 1.Morphological characterization of ELSCs and MSCs under light microscope(×40).A:primary ELSCs appeared small,morphologically slenderer and of homogeneous shape;B:primary MSCs showed different morphologies including spindle-shaped,epithelioid,polygonal or round shape.图1 ELSCs和MSCs的形态特征

Figure 2.Expression of multipotential markers ELSCs and MSCs.A:weak expression of Oct- 4 in ELSCs;A1:magnification of A;B:weak expression of Nanog-3 in ELSCs;B1:magnification of B;C:weak expression of Sox-2 in ELSCs;C1:magnification of C;D:no expression of Oct-4 in MSCs;E:no expression of Nanog-3 in MSCs;F:no expression of Sox - 2 in MSCs.A,B,C,D,E,F:× 100;A1,B1,C1:×200.图2 多潜能抗原标志在ELSCs和MSCs的表达
3 统计学处理
用SPSS 10.0统计软件进行分析,数据用均数±标准差(±s)表示,均数比较采用t检验,以P<0.05为差异有统计学意义。
结 果
1 ELSCs和MSCs的分离扩增
采用无血清培养基(含20%SR、2 mmol/L L-glutamine、1%NEAA、0.1 mmol/L 2 -mercaptoethanol和5 μg/L bFGF 的knockout-DMEM培养液)在明胶包被过的培养瓶中培养骨髓单个核细胞可以分离到ELSCs。采用有血清培养基(含10%NCS的DMEM/F12培养液)在未包被过的培养瓶中培养相同的骨髓单个核细胞可以分离到MSCs。在倒置相差显微镜下可见这2种细胞形态存在明显差别。ELSCs体积较小、形态纤细均一,见图1A。MSCs体积较大,常包括纺锤形、多边性和圆形等多种细胞形态,见图1B,传代后变得均一。免疫荧光染色显示:采用无血清培养基扩增的第2代ELSCs能检测到多潜能抗原标志Oct-4、Nanog-3和Sox-2的微弱表达,见图2A、A1、B、B1、C、C1,而采用经典方法扩增的 MSCs没有检测到这些抗原标志的表达,见图2D、E、F。
2 体外成肌诱导分化
由Lonza公司生产的成肌分化诱导培养液由100 mL skeletal muscle growth medium、10 mL fetal bovine serum、2 mL glutamine、0.1 mL重组人表皮生长因子(recombinant human epidermal growth factor,rhEGF)、0.1 mL dexamethasone 和 0.1 mL gentamicin sulfate amphotericin-B组成。贴壁生长的第4代ELSCs和MSCs在此诱导液中培养3 d即可检测到少量MHC蛋白阳性表达,10 d左右检测到大量MHC阳性细胞,第12 d后MHC阳性细胞减少。提示:10 d是最佳诱导培养时间。免疫染色结果显示:诱导培养10 d的第4代ELSCs和MSCs均可检测到大量MHC和mygenin阳性的多核肌纤维,见图3,形态特征非常典型。RT-PCR分析结果证实:诱导10 d的ELSCs和MSCs表达了MHC和myogenin mRNA,见图4。但没有检测到MyoD在蛋白和mRNA水平的表达。作为对照,不在成肌分化诱导培养基中培养的ELSCs和MSCs都检测不到肌细胞特异性标志抗原MHC、myogenin和MyoD的表达。统计分析结果显示:诱导培养10 d的ELSCs的成肌分化率为(25.7±4.1)%,明显高于MSCs(15.8±7.6)%,差异显著(P<0.05)。

Figure 3.Expression of muscle-specific markers in ELSCs and in MSCs cultured in myogenic differentiation medium for 10 d.A:expression of MHC in ELSCs;B:expression of MHC in MSCs;C:three nucleated fibers;D:multinucleated fibers;E:expression of myogenin in ELSCs;F:magnification of E;G:expression of myogenin in MSCs;H:magnification of G;I:no expression of MyoD in MSCs;J:no expression of MyoD in ELSCs.A,E,G,I,J:×40;B,F,H:×100;C,D:×400.图3 在成肌诱导液中培养10 d的ELSCs和MSCs肌细胞特异性抗原标志的表达

Figure 4.The RT-PCR results for mRNA expression of muscle-specific markers in ELSCs and in MSCs cultured in myogenic differentiation medium for 10 d.M:2 000 bp DNA marker;1:myogenin expression in MSCs;2:myogenin expression in ELSCs;3:negative control for myogenin;4:MHC expression in MSCs;5:MHC expression in ELSCs;6:negative control for MHC;7:no expression of MyoD in MSCs;8:no expression of MyoD in ELSCs;9:no expression of MHC in noninduced ELSCs;10:GAPDH expression in MSCs.图4 肌细胞特异性抗原标志基因在诱导培养10 d的ELSCs和MSCs表达的RT-PCR结果
讨 论
1 ELSCs的分离扩增
Battula等[8]采用胚胎干细胞的扩增培养方法从骨髓中分离到表达多潜能干细胞标志的细胞,并证明这些细胞可以在体外诱导向脂肪、骨、胰岛细胞分化。按照该方法,本研究采用无血清培养基(含20%SR、2 mmol/L L-glutamine、1%NEAA、0.1 mmol/L 2 - mercaptoethanol和 5 μg/L bFGF 的Knockout-DMEM培养液)从成体骨髓中分离到形态纤细均一的SLECs,与运用传统的含血清培养基分离到的MSCs在形态上具有明显区别,而且ELSCs微弱表达多潜能抗原标志Oct-4、Nanog-3和 Sox-2,与 Battula等[8]的结果一致。无血清培养基一直是用来扩增人胚胎干细胞的专用培养基,牛血清的加入将导致胚胎干细胞的分化[10]。运用胚胎干细胞的扩增方法来扩增骨髓干细胞是个很有创意的思路。其他学者的研究[5]也证明采用含EGF等细胞因子的无血清培养基可从脐血中分离到体积较小的ELSCs。这些研究均支持了成体组织中存在ELSCs的观点。成体组织中存在的ELSCs,多数学者[6,11-12]认为是胚胎发育过程中遗留下来的原始干细胞,这些干细胞因印记基因的表观遗传改变而处于静息状态,是组织器官再生的备份细胞,对维持机体内环境的稳定发挥着重要作用。bFGF是维持人胚胎干细胞自我更新而不分化的强刺激因子[13],也是维持造血干细胞长期保持增殖能力的重要因子[14]。本研究中ELSCs很可能就是骨髓中极少数原始干细胞扩增的结果。
2 ELSCs的成肌诱导分化
5-氮杂胞苷通常用作干细胞的成肌分化诱导剂[15-16],其作用机制一直被认为是由于DNA甲基化导致成肌调节因子的激活[17]。由于DNA的甲基化可能导致细胞癌变,因此,含有5-氮杂胞苷的培养液并不适于干细胞诱导。此外,有报道显示5-氮杂胞苷不能诱导人骨髓来源的MSCs分化形成肌管[9,18]。在本研究中,采用添加了rhEGF而不含有5-氮杂胞苷的成肌分化诱导液培养ELSCs和MSCs 3 d,即可将2种细胞诱导为多核肌纤维,细胞呈长条状,具有多个细胞核,完全符合肌纤维的典型特征,表明不含5-氮杂胞苷的肌细胞生长培养液是一种安全高效的成肌分化诱导液。诱导10 d的细胞MHC表达率最高,这个结果其实反映了肌管形成的规律,即肌细胞相互融合形成多核肌管,肌管具有自发收缩功能而从培养瓶中脱落,因此随着诱导培养时间延长,免疫染色就检测不到阳性表达的脱落细胞。有趣的是,有报道结果显示由于rhEGF具有促进细胞增殖的作用,因此rhEGF的存在会负调控干细胞的成肌分化[19]。很显然,本研究中rhEGF的存在并没有影响细胞的成肌分化,可能原因包括:(1)分离扩增的培养体系不同,导致不同实验中所用的干细胞生物学特性差异很大,其成肌分化结果自然也就不相同;(2)诱导培养体系组成成分不同,诱导结果可能就不相同;(3)rhEGF的作用机制复杂,不同时点加入,单独使用或与其它因子联合使用的结果不同甚至相反都是可能的。我们不知道为什么在本研究中没有检测到MyoD的表达,一个可能的解释就是由于rhEGF的存在影响了MyoD的表达。更重要的是在同等条件下,虽然MSCs也可被诱导为MHC和myogenin阳性的多核肌纤维,但ELSCs的成肌分化率显著高于MSCs,表明ELSCs具有更强的成肌分化能力。ELSCs的成肌分化能力优于MSCs的一个重要原因在于:无血清培养体系非常有利于骨髓中原始干细胞的增殖生长,最大程度地保持了多潜能干细胞的干性(stemness),即最大程度地保持了其原本就有的分化潜能。而来自于相同骨髓的MSCs,含血清的培养体系很容易促使多潜能干细胞的分化,很大程度上丢失了原始干细胞的干性。这个研究结果还提示:应该进一步思考什么样的细胞才是骨髓中的真正干细胞。最近Bhartiya等[20]提出:成体组织中真正的干细胞是VSELs这样的多潜能干细胞(pluripotent stem cells),MSCs和造血干细胞其实都是多潜能干细胞增殖分裂产生的祖干细胞(progenitor stem cells)。这里VSELs与本文中ELSCs本质上属于同一类细胞,只是命名不同罢了。他还认为:过去众多自体干细胞治疗试验效果欠佳的重要原因就是移植的是祖干细胞,而不是具有最大再生潜能的多潜能干细胞。有的学者[12]更进一步认为MSCs更恰当的名称是间充质基质细胞(mesenchymal stromal cells),因为其主要作用不是再生,而是其旁分泌机制发挥的免疫调节功能。尽管ELSCs与MSCs之间的关系尚需进一步深入研究,但本研究结果至少为肌营养不良症等肌病的干细胞治疗提供了种子细胞选择的思路,为这些疾病的治疗带来了新的希望。
[1]刘正山,张 成.Mdx小鼠细胞治疗的种子细胞及移植途径研究现状[J].国际遗传学杂志,2008,31(1):31-35.
[2]Reyes M,Lund T,Lenvik T,et al.Purification and exvivo expansion of postnatal human marrow mesodermal progenitor cells[J].Blood,2001,98(9):2615 -2625.
[3]D'Ippolito G,Diabira S,Howard GA,et al.Marrow -isolated adult multilineage inducible(MIAMI)cells,a unique population of postnatal young and old human cells with extensive expansion and differentiation potential[J].J Cell Sci,2004,117(14):2971 -2981.
[4]Kucia M,Reca R,Campbell FR,et al.A population of very small embryonic-like(VSEL)CXCR4+SSEA-1+Oct-4+stem cells identified in adult bone marrow[J].Leukemia,2006,20(5):857-869.
[5]McGuckin C,Jurga M,Ali H,et al.Culture of embryonic-like stem cells from human umbilical cord blood and onward differentiation to neural cells in vitro[J].Nat Protoc,2008,3(6):1046 -1055.
[6]Ratajczak MZ,Liu R,Ratajczak J,et al.The role of pluripotent embryonic-like stem cells residing in adult tissues in regeneration and longevity[J].Differentiation,2011,81(3):153-161.
[7]Watts AE,Yeager AE,Kopyov OV,et al.Fetal derived embryonic-like stem cells improve healing in a large animal flexor tendonitis model[J].Stem Cell Res Ther,2011,2(1):4-10.
[8]Battula VL,Bareiss PM,Treml S,et al.Human placenta and bone marrow derived MSC cultured in serum-free,b-FGF-containing medium express cell surface frizzled-9 and SSEA-4 and give rise to multilineage differentiation[J].Differentiation,2007,75(4):279-291.
[9]Chan J,O’Donoghue K,Gavina M,et al.Galectin-1 induces skeletal muscle differentiation in human fetal mesenchymal stem cells and increases muscle regeneration[J].Stem cells,2006,24(8):1879 -1891.
[10]胡智兴,耿菊敏,梁道明.肝细胞生长因子促进人胚胎干细胞向神经前体细胞分化[J].中国病理生理杂志,2010,26(4):730-736.
[11]Castro RF,Jackson KA,Goodell MA,et al.Failure of bone marrow cells to transdifferentiate into neural cells in vivo[J].Science,2002,297(5585):1299 -1303.
[12]Rodgerson DO,Harris AG.A comparison of stem cells for therapeutic use[J].Stem Cell Rev,2011,7(4):782 -796.
[13]Yeoh J,Os RV,Weersing E,et al.Fibroblast growth factor-1 and -2 preserve long-term repopulating ability of hematopoietic stem cells in serum - free cultures[J].Stem Cells,2006,24(6):1564 -1572.
[14]Solchaga LA,Penick K,Porter JD,et al.FGF-2 enhances the mitotic and chondrogenic potentials of human adult bone marrow - derived mesenchymal stem cells[J].J Cell Physiol,2005,203(2):398- 409.
[15]Wakitani S,Saito T,Caplan AI.Myogenic cells derived from rat bone marrow mesenchymal stem cells exposed to 5- azacytidine[J].Muscle Nerve,1995,18(12):1417-1426.
[16]Gang EJ,Jeong JA,Hong SH,et al.Skeletal myogenic differentiation of mesenchymal stem cells isolated from human umbilical cord blood[J].Stem Cells,2004,22(4):617- 624.
[17]Santi DV,Norment A,Garrett CE,et al.Covalent bond formation between a DNA-cytosine methyltransferase and DNA containing 5 - azacytosine[J].Proc Natl Acad Sci U S A,1984,81(22):6993- 6997.
[18]Martin RE,Sweeney D,Lu F,et al.5-Azacytidinetreated human mesenchymal stem/progenitor cells derived from umbilical cord,cord blood and bone marrow do not generate cardiomyocytes in vitro at high frequencies[J].Vox Sang,2008,95(2):137-148.
[19]Muguruma Y,Reyes M,Nakamura Y,et al.In vivo and in vitro differentiation of myocytes from human bone marrow -derived multipotent progenitor cells[J].Exp Hematol,2003,31(12):1323 -1330.
[20]Bhartiya D,Shaikh A,Nagvenkar P,et al.Very small embryonic-like stem cells with maximum regenerative potential get discarded during cord blood banking and bone marrow processing for autologous stem cell therapy[J].Stem Cells Dev,2012,21(1):1-6.
