抗坏血酸对癫痫大鼠海马分子伴侣介导的自噬激活的影响*
2012-01-30曹丽丽迟令懿张同霞王胜军赵秀鹤刘学伍迟兆富
曹丽丽, 迟令懿, 张同霞, 王胜军, 赵秀鹤, 刘学伍, 迟兆富
(山东大学齐鲁医院1神经内科,2神经外科,山东济南250012)
分子伴侣介导的自噬(chaperone-mediated autophagy,CMA)是特定的胞浆蛋白结合到分子伴侣后转运到溶酶体,然后被清除掉。胞质中有30%的蛋白质是通过CMA被溶酶体降解的。CMA的底物都是可溶的蛋白质分子,首先被胞浆中的包含hsc70的分子伴侣复合物识别,然后再与溶酶体膜上受体的2a型溶酶体相关膜蛋白(lysosome-associated mem-brane protein type 2a,LAMP2a)相互作用后被转运到溶酶体腔中被消化掉。CMA活性主要靠LAMP2a的水平来进行调节,CMA的活性与LAMP2a的水平直接相关[1-2]。CMA在多数细胞内都处于相当低的基础水平,多种应激压力可以激活CMA。饥饿可以最大限度地激活CMA。有研究证实氧化应激和毒性混合物暴露所诱导的应激也可激活CMA。氧化应激会上调LAMP2a受体转录水平,使其合成增加,从而提高CMA清除氧化损伤蛋白质的能力[3]。
研究发现氧化应激自由基和脂质过氧化与癫痫的发生、发展与治疗有着十分密切的关系,无论动物实验还是临床观察均表明癫痫时脑组织内伴有非常活跃的活性氧(reactive oxygen species,ROS)自由基活动。在癫痫反复发作时,ROS的生成和过氧化也许是造成细胞死亡的重要原因之一,通过保护自由基所造成的破坏就可以减少癫痫发作所致的细胞死亡。丙二醛(malondialdehyde,MDA)是脂质过氧化的最终产物,反映了组织自由基的水平。超氧化物歧化酶(superoxide dismutase,SOD)是机体内重要的自由基清除剂,保护脑组织免受过氧化损伤。抗坏血酸(ascorbic acid,AA)为是一种较强的抗氧化剂,研究证实AA可减轻癫痫海马组织损伤,具有抗癫痫作用,推测可能与其降低低密度脂蛋白的过氧化和氧化应激反应有关[4-5]。然而AA的神经保护作用的确切机制仍不清楚。
癫痫持续状态(status epilepticus,SE)的氧化应激损伤中是否存在CMA的激活现象,以及ROS对于CMA的激活是否是必需的,国内外均罕见相关的报道。本文利用匹罗卡品(pilocarpine,Pilo)诱导的癫痫动物模型来评价CMA在癫痫海马损伤中的作用,并从CMA的角度进一步探讨了抗氧化剂AA的神经保护作用。
材料和方法
1 材料
1.1 动物 6~8周龄健康雄性Wistar大鼠,体重220~250 g,由山东大学实验动物中心提供。
1.2 主要试剂 Pilo、丙烯酰胺和甲叉双丙烯酰胺购自Sigma,兔抗大鼠LAMP2a多克隆抗体购于Santa Cruz,过氧化物酶标记的山羊抗兔Ⅱ抗由北京中杉金桥生物技术公司提供,AA由Sigma提供。MDA和SOD试剂盒由南京建成生物工程有限公司提供。化学发光试剂盒购于北京中杉金桥生物技术公司。
2 方法
2.1 动物模型的建立和分组
2.1.1 动物模型的建立 健康雄性Wistar大鼠分笼饲养于恒温(20±2)℃、恒湿(50%~60%)、无特殊病原体条件下,饮用水和标准饲料均经灭菌后供动物自由食用。致痫步骤:首先皮下注射氢溴酸东莨菪碱1 mg/kg,用以拮抗Pilo的外周胆碱能反应,30 min后腹腔注射Pilo 340 mg/kg,然后密切观察大鼠的行为学变化,并按Racine标准判定癫痫发作的程度,达到3~5级的大鼠被认为Pilo模型制作成功,归入实验组。大鼠癫痫2 h后,腹腔注射地西泮4 mg/kg,以终止发作。对照组采用生理盐水代替Pilo。AA预处理组为Pilo注射前30 min腹腔注射WM(500 mg/kg)。
2.1.2 实验动物分组 60只大鼠随机分为空白对照组(control)、癫痫发作后24 h组Pilo、AA(500 mg/kg)预处理癫痫组(AA+Pilo)和AA对照组(AA),每组15只。各组动物分别在腹腔注射24 h后处死。
2.2 MDA和SOD检测
2.2.1 脑组织匀浆的制备 实验后将大鼠迅速断头取脑,在冰盘上分离海马,称重,制成脑组织匀浆。匀浆液离心(3 500 r/min,15 min),取上清液测定SOD或MDA。
2.2.2 MDA的检测 MDA是过氧化脂质降解产物之一,可与硫代巴比妥酸缩合,形成红色产物,在532 nm处有最大吸收峰,其吸光度(A)与MDA含量呈正比。
2.2.3 SOD的检测 超氧阴离子自由基与氧化羟胺形成亚硝酸盐,在显色剂的作用下呈紫红色,在550 nm处有最大吸收峰,其A值与SOD活性呈反比。
2.3 蛋白质的测定
2.3.1 海马总蛋白的提取 各实验组大鼠在相应时点快速断头处死,快速开颅分离出双侧海马,冰冷生理盐水冲洗;标本加入3倍体积的裂解缓冲液(210 mmol/L甘露醇,70 mmol/L蔗糖,10 mmol/L Tris-HCl,pH 7.5,10 mmol/L KCl,1.5 mmol/L MgCl2,5 mmol/L EDTA,0.5 mmol/L 二硫苏糖醇,1 mmol/L钒酸钠),冰浴中充分研磨,放置10 min;然后15 000×g、4℃离心10 min;加入蛋白上样液,沸水煮5 min,-20℃冰箱保存备用。
2.3.2 Western blotting法检测蛋白 样本(40 μg)经12%分离胶、5%浓缩胶SDS-聚丙烯酰胺凝胶电泳后,通过电转膜仪(Bio-Rad)90 mA恒流转膜2 h,转印蛋白至硝酸纤维素膜,用含5%脱脂奶粉的洗脱缓冲液室温封闭1 h,加入抗LAMP2a(1∶200)的兔抗溶液,4℃孵育过夜;洗后加过氧化物酶标记的山羊抗兔Ⅱ抗(1∶3 000~1∶5 000),37 ℃孵育1 h;洗后再移入显色液中,曝光后显影、定影,最后扫描并图像分析。
2.4 RT-PCR法测定LAMP2a mRNA水平 将实验大鼠断头处死,迅速取出大脑,在低温修块台上快速分离出双侧海马,放入焦碳酸二乙酯处理过的Eppendorf管内,置于-80℃冰箱内保存备用。按照Trizol试剂盒操作说明提取海马总RNA,逆转录反应成 cDNA后进行25 μL体系 PCR反应。LANP2a上游引物 5'- TACTACGACACTCACTCC -3',下游引物5'-CATGTTGACATTCACTTC -3',扩增片段 298 bp。内参照β-actin上游引物 5’-GACAGGATGCAGAAGGAGATTACT-3’,下游引物5’-TGATCCACATCTGCTGGAAGGT-3’,扩增片段142 bp。PCR反应条件为:LAMP2a:94℃预变性 5 min,94 ℃ 40 s,54 ℃ 40 s,72 ℃ 40 s,30 个循环后,72℃10 min;β-actin:94℃预变性5 min,94℃ 40 s,52℃ 40 s,72℃ 10 min,30个循环后,72℃ 10 min。PCR产物在1.5%琼脂糖凝胶电泳上观察拍照,并运用AlphaEase FC分析软件对条带进行吸光度扫描,检测各组LAMP2a mRNA扩增产物与其对应的内参照β-actin mRNA扩增产物A值,然后将LAMP2a/β-actin的值进行统计学分析。
3 统计学处理
结 果
1 癫痫大鼠海马氧化应激水平的测定
癫痫大鼠海马组织MDA明显高于对照组,SOD明显低于对照组;AA预处理癫痫组大鼠海马组织MDA的含量显著低于癫痫组,SOD的水平显著高于癫痫组。AA对照组与正常对照组之间MDA和SOD的水平无显著差异,见表1。
2 癫痫大鼠海马分子伴侣介导的自噬的变化
结果显示癫痫大鼠海马组织LAMP2a mRNA和蛋白的水平均显著高于对照组,AA预处理癫痫组海马LAMP2a mRNA和蛋白的水平显著低于癫痫组。AA对照组与正常对照组之间的LAMP2a mRNA和蛋白水平无显著差异,见图1。
表1AA对癫痫大鼠海马组织MDA和SOD的影响Table 1.Effect of AA on MDA and SOD in rat hippocampus after seizures(±s.n=5)
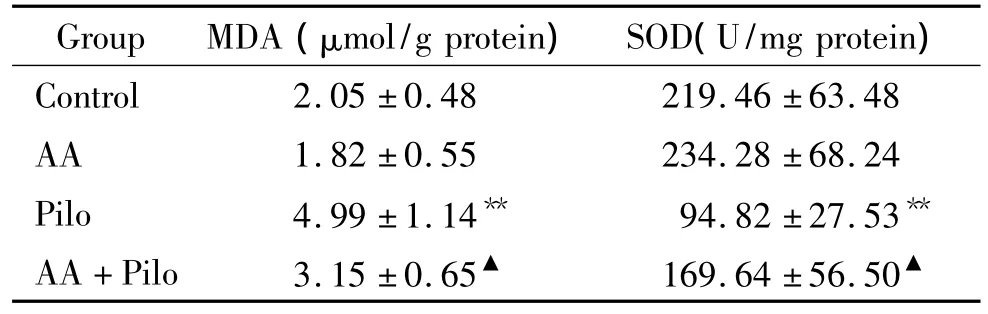
表1AA对癫痫大鼠海马组织MDA和SOD的影响Table 1.Effect of AA on MDA and SOD in rat hippocampus after seizures(±s.n=5)
Pilo:pilocarpine;AA:ascorbic acid.** P < 0.01 vs control group;▲P <0.05 vs Pilo group.
Group MDA(μmol/g protein) SOD(U/mg protein)Control 2.05 ±0.48 219.46 ±63.48 AA 1.82 ±0.55 234.28 ±68.24 Pilo 4.99 ±1.14** 94.82 ±27.53**AA+Pilo 3.15 ±0.65▲ 169.64 ±56.50▲
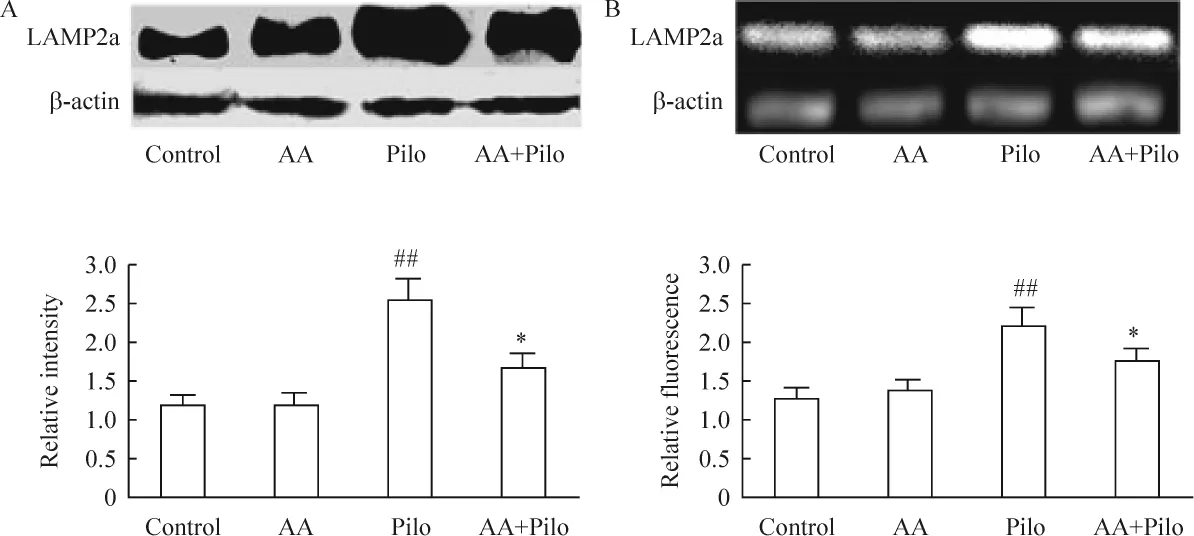
Figure 1.LAMP2a protein(A)and mRNA(B)levels in hippocampus of rats.Pilo:pilocarpine;AA:ascorbic acid.±s.n=5.##P<0.01 vs control group;*P <0.05 vs Pilo group.图1 癫痫大鼠海马LAMP2a mRNA和蛋白的变化以及AA对LAMP2a的影响
讨 论
本研究发现癫痫发作脑组织抗氧化能力下降,脂质过氧化和自由基损伤等氧化应激反应参与了癫痫的病理过程。另外,通过检测LAMP2a的转录和合成水平,我们发现Pilo诱导的癫痫持续状态大鼠海马CMA激活,CMA的激活是通过LAMP2a的体内合成增加来实现的。另外,抗氧化剂AA可部分地抑制激活的CMA。本研究证实癫痫发作可激活CMA,以及抗氧化剂AA降低氧化应激反应可抑制CMA的活性。总之,本研究结果提示氧化应激在SE的神经病理过程中的作用至少部分与CMA有关。
自噬是胞浆大分子物质和细胞器在膜包囊泡中大量降解的生物学过程。根据细胞物质运到溶酶体内的途径不同自噬分为:(1)大自噬:即通常所说的自噬,由内质网来源的单层膜凹陷形成杯状双层膜样的分隔膜,进而完全包绕待降解物形成自噬体,接着与溶酶体融合,自噬体内细胞物质如细胞器被溶酶体酶溶解;(2)小自噬:是溶酶体的膜直接包裹如长寿命蛋白并在溶酶体内降解;(3)分子伴侣介导的自噬(CMA):胞浆内蛋白结合到分子伴侣后被转运到溶酶体腔中被溶酶体酶消化。CMA的底物是可溶的蛋白分子,所以CMA降解途径在清除蛋白质时有选择性,而前两者无明显选择性[1-2,6]。在饥饿状态下,大自噬首先被激活,这时大自噬是蛋白降解的主要方式,但大自噬很快就进行性衰退。巨自噬激活后数小时CMA的活性才明显升高,但CMA的激活持续时间明显延长,此时溶酶体蛋白降解主要是通过CMA来完成[7]。在应激的初始阶段,大自噬激活为细胞持续合成必需的大分子提供必需的物质(氨基酸、脂质、缩水甘油和核苷酸),并且清除细胞受损的结构。然而,如果应激持续存在,仅仅依靠非选择性的降解细胞浆成分是不够的,也不再是细胞所想要的,因为非选择性的清除降解可能也同时降解了细胞原有的一些必需物质和细胞新合成的对抗氧化应激的蛋白、生物大分子等。在这种情况下,对底物进行适当的选择更有利于细胞的生存。而对于氧化蛋白而言,CMA具有选择性清除作用。CMA所具有的选择性清除某些蛋白而不影响其它蛋白和结构式的特点使得CMA较其它非选择性溶酶体途径更合适[8]。我们既往的研究发现大鼠致痫后大自噬激活[9],本次研究发现癫痫发作24 h LAMP2a mRNA和蛋白均明显增高,CMA处于激活状态;我们认为在癫痫发作的氧化应激状态下巨自噬和CMA同时被激活,可以更加有效地清除不需要的、损伤的或多余的细胞器或其它结构比如氧化应激蛋白和损伤的线粒体,减轻癫痫发作的神经损伤,具有保护作用。
自由基与癫痫发病中痫性活动的产生与神经细胞死亡息息相关。癫痛发作后产生大量ROS作用于线粒体,产生细胞毒性作用,一方面加重癫痫发作,另一方面促进神经元死亡。自由基可产生大量的过氧化脂质(peroxidation,LPO),LPO和其代谢产物具有潜在的神经毒性。我们发现癫痫发作24 h海马MDA(LPO的产物)的含量明显升高,与既往的报道一致[10-11]。升高的MDA参与了癫痫的神经损伤。脑组织存在多种的抗氧化机制,其中自由基清除剂SOD是主要的抗氧化系统,尤其在神经元抗氧化应激反应中发挥重要作用。有研究发现线粒体MnSOD表达下调的转基因动物SOD2-/+小鼠在10~18月出现自发性癫痛发作[12]。本研究发现,癫痫发作24 h海马SOD的水平显著下降。一方面自由基和脂质过氧化抑制SOD的活性,另一方面SOD下降,细胞清除自由基的能力下降,对神经元的保护作用减弱,形成恶性循环,进一步加重脑损伤。
CMA是在多种不同的细胞类型和组织中普遍存在的一种类型的自噬。细胞浆内可溶性的蛋白,特别是氧化蛋白,主要是通过 CMA来降解。Kiffin等[3]发现就 CMA而言,CMA底物轻度的氧化应激不仅可以促进底物的溶酶体降解过程,而且促进底物和溶酶体膜的结合以及加速底物通过溶酶体膜的转运过程。我们推测癫痫发作脑组织内存在显著的过氧化反应,产生大量的氧化损伤蛋白,CMA的激活可以加快异常蛋白的清除,发挥神经保护作用。
维生素C(抗坏血酸)和维生素E是外源性的强抗氧化剂,与组织细胞内内源性抗氧化剂相互协同共同清除 ROS。抗坏血酸通过葡萄糖转运体进入线粒体,在许多水平发挥抗氧化作用,它可以直接代谢ROS,维持维生素E的还原状态,介导过氧化物酶的电子传递过程。我们既往的实验已经证实了维生素E对癫痫动物海马的神经保护作用。本次研究发现,抗坏血酸预处理可显著降低癫痫大鼠海马MDA的水平,抑制脂质过氧化反应,并且抗坏血酸通过提高SOD的水平增加海马神经元的抗氧化能力。通过减轻氧化应激反应,抗坏血酸可减轻成年癫痫大鼠的脑损伤,从而发挥神经保护作用[4-5]。
氧化应激是非饥饿诱导的CMA激活的重要机制,并且研究表明ROS是自噬激活所必需的[13-14]。本文进一步研究了抗氧化剂抗坏血酸是否可减轻CMA的活性。抗坏血酸预处理可减少LAMP2a的水平从而部分抑制CMA的活性,这一点与氧化应激在上游启动或者调解CMA的观点一致。需要注意的两点是,首先抗坏血酸仅仅是部分地抑制CMA;其次,抗坏血酸并非直接抑制自噬,可能是通过清除CMA的激活调节物质ROS后来实现。因为抗坏血酸具有多种生物学功能,抗坏血酸是胶原、单胺、氨基酸、肽激素和肉碱合成过程中辅酶的辅助因子,因此关于抗坏血酸抑制癫痫大鼠海马CMA的激活以及神经保护作用的确切机制需要进一步研究。
[1]Cuervo AM,Dice JF.Regulation of lamp2a levels in the lysosomal membrane[J].Traffic,2000,1(7):570 -583.
[2]Cuervo AM,Dice JF.Unique properties of lamp2a compared to other lamp2 isoforms[J].J Cell Sci,2000,113(Pt 24):4441-4450.
[3]Kiffin R,Christian C,Knecht E,et al.Activation of chaperone - mediated autophagy during oxidative stress[J].Mol Biol Cell,2004,15(11):4829 -4840.
[4]Santos IM,Tomé Ada R,Saldanha GB,et al.Oxidative stress in the hippocampus during experimental seizures can be ameliorated with the antioxidant ascorbic acid[J].Oxid Med Cell Longev,2009,2(4):214 -221.
[5]Tomé Ada R,Ferreira PM,Freitas RM.Inhibitory action of antioxidants(ascorbic acid or alpha-tocopherol)on seizures and brain damage induced by pilocarpine in rats[J].Arq Neuropsiquiatr,2010,68(3):355 -361.
[6]Yang YP,Liang ZQ,Gu ZL,et al.Molecular mechanism and regulation of autophagy[J].Acta Pharmacol Sin,2005,26(12):1421 -1434.
[7]Cuervo AM,Palmer A,Rivett AJ,et al.Degradation of proteasomes by lysosomes in rat liver[J].Eur J Biochem,1995,227(3):792 -800.
[8]Massey A,Kiffin R,Cuervo AM.Pathophysiology of chaperone - mediated autophagy[J].Int J Biochem Cell Biol,2004,36(12):2420-2434.
[9]曹丽丽,董 艳,徐婧婧,等.Wortmannin通过抑制癫痫大鼠海马自噬活性发挥神经保护作用[J].中国病理生理杂志,2010,26(8):1584 -1588.
[10]Freitas RM.Investigation of oxidative stress involvement in hippocampus in epilepsy model induced by pilocarpine[J].Neurosci Lett,2009,462(3):225 -229.
[11]Freitas RM,Sousa FC,Vasconcelos SM,et al.Pilocarpine-induced status epilepticus in rats:lipid peroxidation level,nitrite formation,GABAergic and glutamatergic receptor alterations in the hippocampus,striatum and frontal cortex[J].Pharmacol Biochem Behav,2004,78(2):327-332.
[12]Liang LP,Patel M.Mitochondrial oxidative stress and increased seizure susceptibility in Sod2-/+mice[J].Free Radic Biol Med,2004,36(5):542 -554.
[13]Scherz- Shouval R,Shvets E,Elazar Z.Oxidation as a post-translational modification that regulates autophagy[J].Autophagy,2007,3(4):371 -373.
[14]Scherz-Shouval R,Shvets E,Fass E,et al.Reactive oxygen species are essential for autophagy and specifically regulate the activity of Atg4[J].EMBO J,2007,26(7):1749-1760.
