乙肝病毒X蛋白相互作用蛋白促进HepG2细胞迁移并调节β-catenin表达*
2012-01-30崔利园张钊瑞费洪荣姚树桐李晓倩王凤泽
崔利园, 张钊瑞, 费洪荣, 姚树桐, 李晓倩, 王凤泽△
(泰山医学院1生物科学学院,2药学院,3基础医学院,山东 泰安271016)
原发性肝细胞癌是我国常见的高发性恶性肿瘤之一,其发生转移和侵袭是术后复发和导致患者死亡的主要原因[1-2]。乙肝病毒X蛋白相互作用蛋白(hepatitis B virus X-interacting protein,HBXIP)由于能够与乙肝病毒 X蛋白(hepatitis B virus X protein,HBx)的C末端结合而被命名,其在肿瘤组织中高表达,参与调控乙肝病毒的复制、细胞增殖、细胞凋亡及有丝分裂等生命过程[3-5]。本实验旨在研究HBXIP与肝细胞癌转移的相关性,并对其作用机制进行初步探讨,为临床上有效地治疗肝细胞癌提供理论指导。
材料和方法
1 主要材料
人肝癌细胞系HepG2购自中国科学院上海生命科学研究院细胞资源中心;稳定高表达HBXIP的HepG2细胞系由本室保存[5]。RPMI-1640培养基和胎牛血清购于Gibco;Transwell小室购自BD;明胶购自Sigma;G418购自Merck;ECL显色试剂盒购自Pierce;β-actin抗体购自Sigma;基质金属蛋白酶9(matrix metalloproteinases 9,MMP-9)抗体购自Santa Cruz;磷酸化糖原合成酶激酶3β(phosphorylated glycogen synthase kinase 3β,p-GSK-3β)(Thr216)抗体购自 BD;β -连环蛋白(β-catenin)抗体、p-β-catenin(Thr41/Ser45)抗体和p-GSK-3β(Ser9)抗体购自Cell Signaling;兔抗小鼠IgG和山羊抗兔IgG购自北京中杉金桥生物公司。
2 方法
2.1 细胞培养 HepG2细胞用RPMI-1640培养基,含有10%胎牛血清、1×105U·L-1青霉素和100 mg·L-1硫酸链霉素,37℃、5%CO2条件下孵箱培养。
2.2 细胞迁移实验 细胞无血清培养24 h后,胰酶消化并计数。将Transwell小室(8.0 μm聚碳酸酯微孔膜)放入24孔培养板中,上室加入适量细胞,用含0.1% 胎牛血清的培养基培养,下室培养基含2.5 mg/L的纤维黏连蛋白。37℃培养24 h后,取出微孔膜并用90% 乙醇固定15 min,弃去固定液,然后用棉球擦去膜上层细胞,台盼蓝染色后计数膜下层附着的细胞数。实验重复3次。
2.3 明胶酶谱分析法检测MMP-9的酶活性 无血清培养液处理细胞24 h后收集培养液并于4℃离心10 min(12 000 r/min),0.22 μm滤器过滤制备成条件培养上清液,测定蛋白总量并进行酶谱分析。将条件培养液与不含还原剂的上样缓冲液混匀上样于含1 g/L明胶的SDS-PAGE,然后进行电泳。电泳结束后将胶体置于洗脱液(含2.5%Triton X-100)中轻摇洗涤;然后放置于明胶缓冲液中37℃孵育30 h,接着加入考马斯亮蓝溶液染色2 h后,加入脱色液脱色至蓝色背景上显现负染条带。凝胶中由于含有底物蛋白而染色较深,在有蛋白酶条带的位置,蛋白酶将降解底物蛋白而不被染色,进而形成透明区域(负染),MMP-9的酶活性与负染条带的透明度与范围呈正相关。
2.4 免疫印迹分析 细胞用预冷的PBS洗2次后加入细胞裂解液(10 mmol·L-1Tris-HCl,pH 8.0,1 mmol·L-1EDTA,150 mmol·L-1NaCl,1%NP-40,1 mmol·L-1PMSF,1%SDS,protease inhibitor cocktails),冰上放置20 min后4℃13 000×g离心20 min,收集上清定量分析。取40μg总蛋白进行SDS-PAGE实验,接着电转移至PVDF膜上,5% 脱脂奶粉封闭过夜,然后分别与MMP-9抗体(1∶300)、β-catenin抗体(1∶800)、p-β -catenin(Thr41/Ser45)抗体(1∶500)、p-GSK-3β(Ser9)抗体(1∶1 000)和 p-GSK-3β(Thr 216)抗体(1∶400)室温孵育3 h;PBST洗膜3次,每次10 min;接着分别加入相应的兔抗小鼠IgG(1∶4 000)和山羊抗兔IgG(1∶3 000)室温孵育 1.5 h,PBST洗膜 3次,每次 10 min;最后用 ECL显色试剂盒于暗室曝光显影。以β-actin作为内参照,实验重复3次。
3 统计学处理
结 果
1 Transwell法检测HBXIP对HepG2肝癌细胞迁移的影响
镜下计数Transwell小室滤膜下的细胞数,结果如图1所示。迁移24 h后台盼蓝染色发现,HBXIP高表达组(HepG2-HBXIP)细胞数量明显多于空载体对照组细胞(pCMV-tag2B)(P<0.05),表明 HBXIP的高水平表达可明显促进HepG2细胞的迁移。

Figure 1.Overexpression of HBXIP enhanced HepG2 cell migration(trypan blue staining,×100).±s.n=6.*P<0.05 vs pCMV-tag2B.图1 HBXIP对HepG2细胞迁移的诱导作用
2 HBXIP对MMP-9活性及表达的影响
HBXIP 可明显上调MMP-9的活性,见图2;HBXIP同时上调HepG2细胞中MMP-9蛋白表达水平,见图3。
3 HBXIP 对β-catenin及GSK-3β表达水平的影响
HBXIP可促进HepG2细胞中β-catenin的表达,并抑制β-catenin的磷酸化,从而有利于 β-catenin的稳定性。HBXIP抑制GSK-3β丝氨酸磷酸化,而促进其苏氨酸的磷酸化形式,见图4。

Figure 2.Activity of MMP-9 in HepG2 cells induced by HBXIP.图2 明胶酶谱法检测HBXIP对MMP-9活性的影响
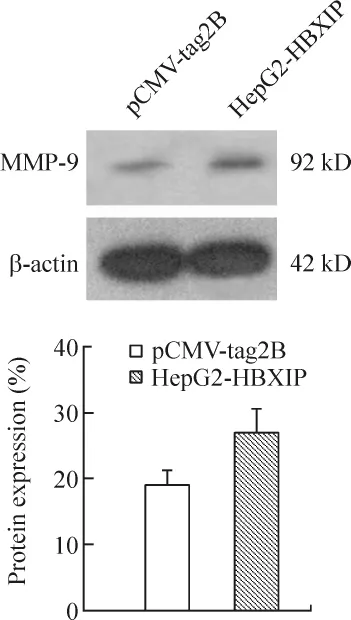
Figure 3.Overexpression of MMP-9 induced by HBXIP in HepG2 cells.±s.n=3.*P<0.05 vs pCMV-tag2B.图3 免疫印迹检测HBXIP对MMP-9表达水平的影响
讨 论
HBXIP基因由Melegari等[3]于1998年首次从 HepG2细胞中克隆获得。作为HBx的结合蛋白,HBXIP能特异地结合HBx的C末端,通过降低HBx活性而改变乙型肝炎病毒的复制周期;HBXIP还能与生存素(survivin)形成复合物并结合pro-caspase-9,使survivin通过细胞色素C介导的凋亡途径抑制细胞凋亡。我们前期的研究结果显示,HBXIP对肝癌细胞的增殖具有促进作用,且在肝癌组织中高表达[6],因此推测HBXIP与肝癌的发生发展密切相关。
本研究以HepG2细胞为实验材料,在建立稳定高表达HBXIP蛋白细胞系的基础上,初步探讨了HBXIP与肝细胞癌迁移的相关性及可能的分子机制。实验结果表明,HBXIP的高水平表达促进了HepG2细胞的迁移能力,增强了细胞中MMP-9的活性。MMPs是以Ca2+、Zn2+等金属离子为辅助因子的蛋白质,与细胞外基质(extracellular matrix,ECM)的降解关系密切[7]。根据作用底物以及片段同源性,将MMPs分为:胶原酶、明胶酶(IV型胶原酶)、基质溶酶等几大类。明胶酶为其中重要的一类,主要有2种形式:分子量为92 kD的MMP-9和分子量为72 kD的MMP-2,两者均与多种肿瘤的侵袭转移密切相关[8-9]。MMP-9在肿瘤组织中以活性形式(81 kD)和非活性形式pro-MMP-9(92 kD)2种形式存在,由于在病理生理过程中起作用的主要是活化型MMPs,因此本研究主要通过明胶酶谱实验检测HepG2细胞中MMP-9的活性形式。
β-catenin是经典Wnt信号通路的下游因子,与肿瘤的增殖、迁移侵袭及凋亡均相关,其表达水平的升高是Wnt信号通路致癌的关键[10]。免疫印迹结果表明,HBXIP参与调节β-catenin的表达,HBXIP的高表达抑制了β-catenin的磷酸化,从而有利于保持细胞内β-catenin蛋白的稳定性,激活相关基因的转录。GSK-3β是一种蛋白激酶,其不同的磷酸化方式(丝氨酸/苏氨酸)对其催化活性有着不同的影响[11-13]。当HBXIP在肝癌细胞中的高水平表达时,促进了GSK-3β上Ser9的磷酸化而抑制了其Thr216的磷酸化。GSK-3β的Ser9磷酸化对GSK-3β的活性起抑制作用,而Thr216的磷酸化则激活GSK-3β的活性,因此HBXIP能够通过抑制GSK-3β的激酶活性来增加β-catenin的稳定性。
综上所述,HBXIP具有促进肝癌细胞迁移的作用,其分子机制可能与HBXIP调节MMP-9的活性及β-catenin的稳定表达有关。
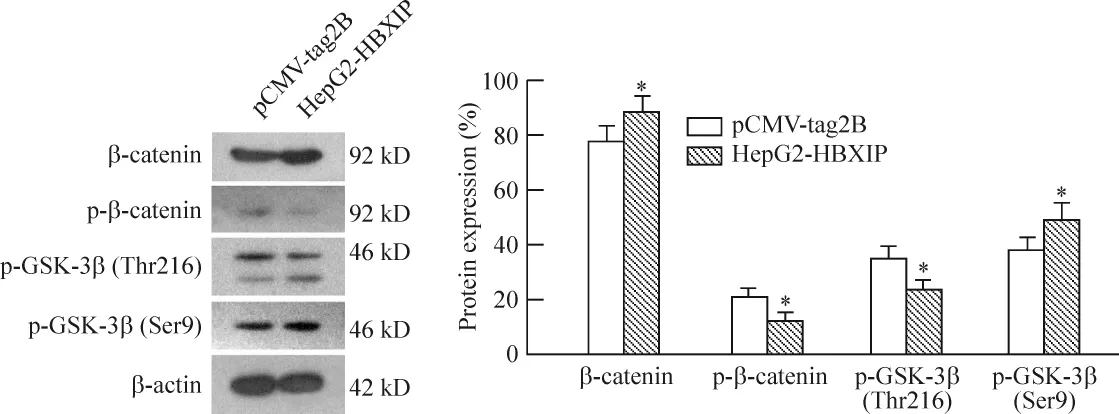
Figure 4.HBXIP increased β -catenin level and inhibited the phosphorylation of β -catenin by regulating the phosphorylation of GSK-3β.±s.n=3.*P<0.05 vs pCMV-tag2B.图4 免疫印迹检测 HepG2细胞中β-catenin、p-β-catenin和p-GSK-3β表达水平
[1]Mak GW,Chan MM,Leong VY,et al.Overexpression of a novel activator of PAK4,the CDK5 kinase-associated protein CDK5RAP3,promotes hepatocellular carcinoma metastasis[J].Cancer Res,2011,71(8):2949-2958.
[2]Ren N,Wu JC,Dong QZ,et al.Association of specific genotypes in metastatic suppressor HTPAP with tumor metastasis and clinical prognosis in hepatocellular carcinoma[J].Cancer Res,2011,71(9):3278-3286.
[3]Melegari M,Scaglioni PP,Wands JR.Cloning and characterization of a novel hepatitis B virus x binding protein that inhibits viral replication [J].J Virol,1998,72(3):1737-1743.
[4]Marusawa H,Matsuzawa S,Welsh K,et al.HBXIP functions as a cofactor of surviving in apoptosis suppression[J].EMBO J,2003,22(11):2729-2740.
[5]Wang FZ,Fei HR,Lian LH,et al.Hepatitis B x-interacting protein induces HepG2 cell proliferation through activation of the phosphatidylinositol 3-kinase/Akt pathway[J].Exp Biol Med,2011,236(1):62-69.
[6]Wang FZ,Sha L,Zhang WY,et al.Involvement of hepatitis B X-interacting protein(HBXIP)in proliferation regulation of cells[J].Acta Pharmacol Sin,2007,28(3):431-438.
[7]李明意,姚金科,周晓华,等.MKK-4、MMP-9基因的表达与原发性肝癌肿瘤侵袭转移的关系[J].中国病理生理杂志,2006,22(8):1480-1483.
[8]Krüger A,Kates RE,Edwards DR.Avoiding spam in the proteolytic internet:future strategies for anti-metastatic MMP inhibition[J].Biochim Biophys Acta,2010,1803(1):95-102.
[9]Wågsäter D,Zhu C,Björkegren J,et al.MMP-2 and MMP-9 are prominent matrix metalloproteinases during atherosclerosis development in the Ldlr(-/-)Apob(100/100)mouse[J].Int J Mol Med,2011,28(2):247-253.
[10]Nejak-Bowen KN,Monga SP.Beta-catenin signaling,liver regeneration and hepatocellular cancer:sorting the good from the bad[J].Semin Cancer Biol,2011,21(1):44-58.
[11]Liang MH,Chuang DM.Regulation and function of glycogen synthase kinase-3 isoforms in neuronal survival[J].J Biol Chem,2007,282(6):3904-3917.
[12]Lin CL,Tseng HC,Chen WP,et al.Intracellular zinc release-activated ERK-dependent GSK-3β-p53 and Noxa-Mcl-1 signaling are both involved in cardiac ischemic-reperfusion injury[J].Cell Death Differ,2011,18(10):1651-1663.
[13]高 明,龚 瑾,吕永添,等.β-连环素在结肠腺癌中的异常表达及其与预后的关系[J].中国病理生理杂志,2010,26(5):928-930.
