Rho激酶在糖尿病血管内皮功能改变中的作用*
2012-01-30吴健美陈晓娜郭正祥纪晓微施巧雅尹洪萍汝海龙林国华刘传飞刘翠清
吴健美, 陈晓娜, 郭正祥, 纪晓微, 施巧雅,尹洪萍, 沈 礼, 汝海龙, 林国华, 刘传飞, 刘翠清
(杭州师范大学基础医学部生理教研室,浙江杭州310036)
Rho激酶广泛分布在哺乳类动物的组织细胞中,是具有信号转导和分子开关等重要功能的分子多肽。近年的研究表明,Rho激酶是血栓烷受体(thromboxane receptor,TP受体)的主要效应器酶,通过与血管紧张素II、内皮素、血小板源生长因子、5-羟色胺等多种血管活性物质相互调控而影响平滑肌细胞的活动,并参与心脏病的病理过程,与动脉粥样硬化、高血压、冠脉痉挛、心肌缺血等主要心血管疾病的发生发展关系密切[1-5]。我们前期结果表明Rho激酶可以抑制异丙肾上腺素(isoprenaline)的舒张血管作用,并通过抑制血管内皮细胞钙离子内流从而降低内皮型一氧化氮合酶(endothelium nitric oxidase synthase,eNOS)活性导致内皮功能紊乱[6]。业已表明,内皮功能失调是糖尿病血管并发症的始动环节,也是糖尿病患者致残致死的一个主要因素。但是,Rho激酶在糖尿病血管内皮损伤中的作用如何,尚缺乏系统研究。本实验旨在观察Rho激酶激活对血管内皮依赖性舒张的影响以及在糖尿病血管损伤中的作用,为糖尿病血管并发症的防治提供理论依据。
材料和方法
1 仪器和药品
Myograph血管张力系统 (DMT 610)、PowerLab(AD仪器设备有限公司)、MedLab生物信号处理系统、张力换能器系统和恒温恒速灌流系统、酶标仪。法舒地尔购自天津红日药业股份有限公司,去氧肾上腺素(phenylephrine,Phe)、乙酰胆碱(acetylcholine,ACh)和硝普钠(sodium nitroprusside,SNP)购自Sigma,U46619(TP受体激动剂)和Y27632(Rho激酶抑制剂)为香港中文大学黄聿教授所赠。抗体peNOS和eNOS购自Cell Signaling Technology。血栓烷 B2(thromboxane B2,TXB2)和前列腺素 F2α(prostaglandin F2α,PGF2α)ELISA 试剂盒购自 R&D。
2 动物
本实验选用3种动物:雄性SD大鼠(260~280 g)、高脂饮食6个月的雄性C57BL/6小鼠以及雄性db/db基因型糖尿病小鼠。
3 方法
3.1 离体血管准备 动物吸入纯CO2处死后,迅速取出胸主动脉,并置于充有95%O2、5%CO2混合气的低温Krebs液(NaCl 119.0 mmol/L,NaHCO325.0 mmol/L,KCl 4.7 mmol/L,KH2PO41.2 mmol/L,MgCl2·6H2O 1.0 mmol/L,CaCl2·2H2O 2.5 mmol/L和葡萄糖11.0 mmol/L,pH7.4)液中,分离并去除血管周围的结缔组织及脂肪。将分离好的动脉剪成约2 mm长的血管环,将大鼠血管环通过2根细不锈钢丝悬挂于器官浴槽(organ bath)内,槽内已预先放置10 mL Krebs液,持续通混合气,并通过循环加热系统使槽内溶液温度维持在37℃。将一根钢丝固定于标本架上,另一根钢丝与张力换能器连接,平衡90 min后,调节基础张力为2 g。将小鼠血管环轻轻移至Myograph系统的腔里,预先已放置5 mL Krebs液,持续通混合气,并通过内置加热系统控制槽内溶液温度为37℃。血管环中穿入2根直径为40 μm的不锈钢丝,一根钢丝固定于标本架上,另一根与张力换能器连接,平衡90 min后调节基础张力为5 mN。待血管平衡后,将Krebs液更换为6×10-2mol/L高钾溶液,引发血管收缩以检测血管收缩功能,然后冲洗、平衡3次。加入去氧肾上腺素 (3×10-7mol/L),引发血管收缩,然后加入乙酰胆碱 (10-6mol/L),血管舒张达到80%者,说明内皮功能完好,否则弃之不用。然后用新鲜Krebs液冲洗5次。
3.2 离体血管张力测定 待血管重新稳定后给予血管收缩药物去氧肾上腺素或者去氧肾上腺素加U46619引发血管收缩,进行正式实验。拮抗剂均在血管收缩药物加入前30 min加入预孵。
3.3 免疫印迹 将血管组织匀浆,提取蛋白后用Lawry法测量蛋白浓度。取100 μg蛋白样品上样经8%变性聚丙烯酰胺凝胶电泳后,电转膜至硝酸纤维膜,先加入鼠抗p-eNOSser11774℃ 孵育过夜;PBST清洗后在室温下用辣根过氧化物酶标记的兔抗鼠IgGⅡ抗孵育2 h;ECL化学发光法显影,冲片。将同一张膜用stripping buffer(抗体去除液)孵育去除结合的抗体后,同法再检测eNOS表达。
3.4 ELISA 将血管组织匀浆,按照试剂盒说明检测血管组织中PGF2α和TXB2的水平。
4 统计学处理
结 果
1 Rho激酶在血管内皮依赖性舒张中的作用
在具备内皮功能的离体大鼠主动脉环,用去氧肾上腺素(1×10-6mol/L)预收缩血管后,加入乙酰胆碱(10-8.5mol/L~10-5.5mol/L)引发剂量依赖性的血管舒张,见图1A、E和表1。用去氧肾上腺素和U46619共同诱发血管收缩,待收缩达到平台后,加入不同浓度的乙酰胆碱。与单独去氧肾上腺素引起收缩时相比,乙酰胆碱的舒张血管作用大大减弱,与单独去氧肾上腺素收缩组比较,P<0.01,见图1B、E和表1。但是,在本实验中我们没有观察到U46619明显改变硝普钠引起的血管舒张反应,见图1G。用Rho激酶抑制剂法舒地尔(1×10-5mol/L)预处理血管30 min后,再加入去氧肾上腺素和U46619引发血管收缩。待收缩稳定后,加入不同浓度的乙酰胆碱,结果显示,法舒地尔虽然未能显著改变pD2值,却有效地改善了乙酰胆碱的舒血管作用,最大舒张反应(maximal effect,Emax)显著增加(P <0.01),见图1C、F和表1。我们将NO通路用N-硝基-L-精氨酸甲酯(NG-nitro-L-arginine methyl ester,LNAME)阻断后,再用法舒地尔预孵,观察到法舒地尔改善血管舒张功能的作用消失,见图1D、F和表1。

Figure 1.Effect of Rho kinase on endothelium-dependent vasorelaxation.A:acetylcholine(ACh)-induced relaxation in rat aortic rings pre-constricted by phenylephrine(Phe)as control;B:ACh-induced relaxation in rat aortic rings pre-constricted by Phe+U46619;C:the reduced ACh-induced relaxation in the presence of 100 nmol/L U46619 was partially reversed by treatment with 10 μmol/L fasudil;D:the reversed ACh - induced relaxation by fasudil was abolished by treatment with 100 μmol/L NG-nitro-L-arginine methyl ester(L-NAME);E:concentration-response curves for ACh in the absence and presence of 100 nmol/L U46619;F:concentration-response curves for ACh in rings with endothelium treated by fasudil or fasudil+L-NAME;G:concentration-response curves for sodium nitroprusside(SNP)in rings without endothelium.±sE.n=5~9.**P<0.01 vs control.图1 Rho激酶对正常血管内皮依赖性舒张的影响
2 Rho激酶对eNOS活性改变的影响
免疫印迹法对eNOS活性(eNOSser1177位点的磷酸化水平)的检测结果见图2。将大鼠主动脉血管环在含有去氧肾上腺素的Krebs中预处理20 min后,加入乙酰胆碱孵育3 min,观察到eNOS磷酸化程度均明显增强,与单独去氧肾上腺素处理的对照组相比差异显著(P<0.05)。根据血管功能实验的结果,同时用U46619和去氧肾上腺素预处理血管20 min后,再用乙酰胆碱刺激,则磷酸化eNOS的水平大大降低,与仅用去氧肾上腺素和乙酰胆碱的处理组相比差异显著(P<0.05)。这提示U46619对乙酰胆碱引起的eNOS磷酸化有抑制作用。图2还显示,U46619对eNOS磷酸化的这种抑制作用被提前30 min加入Rho激酶抑制剂Y27632部分翻转。这些结果说明在正常的大鼠血管,Rho激酶通过抑制eNOS磷酸化参与了血管的内皮依赖性舒张功能的调节。

表1 乙酰胆碱诱发的血管最大舒张反应和pD2值Table 1.pD2and Emaxvalues for acetylcholine-induced relaxation
3 Rho激酶对糖尿病血管舒张功能的影响
对db/db基因型糖尿病小鼠和高脂饮食小鼠血糖进行测量,空腹血糖值均明显升高(数据未显示)。在db/db基因型糖尿病小鼠主动脉血管环,我们观察到乙酰胆碱引发的血管舒张作用受到明显抑制,与C57BL/6的对照组相比差异显著(P<0.05),提示内皮功能紊乱,见图3A。用Rho激酶抑制剂法舒地尔或Y27632预处理血管30 min后血管舒张功能明显改善。因为样本数有限,统计无显著差异,但结果表明药物敏感性有所增强,最大舒张反应也明显增加,见图3A、表1。在高脂饮食诱发的肥胖小鼠模型,我们也观察到血管的内皮依赖性舒张功能明显减弱,最大舒张反应显著降低,与正常饮食的小鼠血管舒张反应相比较差异显著。Y27632预孵使血管舒张作用得到改善,见图3B、表1,与高脂饮食组相比P<0.01。
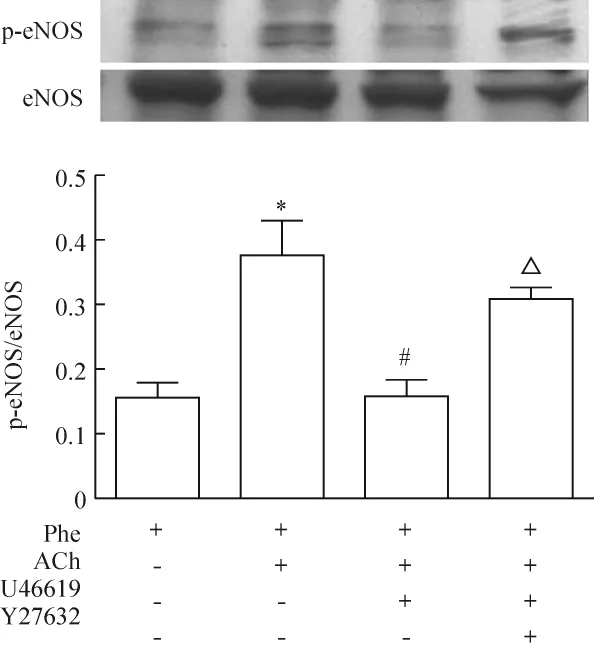
Figure 2.Effect of Rho kinase on phosphorylation of eNOS at Ser1177 in rat aortas.Aortic tissues were stimulated with phenylephrine(Phe),Phe+acetylcholine(ACh),U46619+Phe+ACh and Y27632+U46619+Phe+ACh in normal Krebs solution.±sE.n=3.*P <0.05 vs Phe;#P <0.05 vs Phe+ACh;△P <0.05 vs U46619+Phe+ACh.图2 Rho激酶对正常血管eNOS磷酸化水平的影响

Figure 3.Effects of Rho kinase inhibitors(fasudil and Y27632)on endothelium-dependent vascular relaxation in diabetic db/db mice(A)and mice fed with high-fat diet(HFD)(B).Phe:phenylephrine.±sE.n=5~9.*P<0.05,**P<0.01 vs control.图3 Rho激酶抑制剂对基因型糖尿病小鼠和高脂饮食肥胖小鼠血管内皮依赖性舒张的影响
4 血管组织中PGF2α和TXB2水平测定
用ELISA试剂盒对基因型糖尿病小鼠血管组织中TP受体激活物(PGF2α和TXB2)进行测量,二者水平比对照组(C57BL/6小鼠)明显升高(均 P<0.05),见图 4。

Figure 4.Levels of PGF2α(A)and TXB2(B)in aortas of diabetic db/db mice.±sE.n=4.*P<0.05 vs non-diabetic vessels.图4 糖尿病小鼠血管组织中TP受体激活物的水平
讨 论
TXA2是一类前列腺素类的代谢产物,由花生四烯酸在环氧合酶的作用下生成。在诸多生理和病理性的刺激下,TXA2生成增多,通过TP受体激活Rho激酶。本研究表明,Rho激酶激活可以降低正常血管eNOS的活性进而抑制血管的内皮依赖性舒张;抑制Rho激酶可以改善糖尿病动物的血管内皮功能紊乱。
Rho激酶以2种异构体形式存在:ROKα和ROKβ,也称作 ROCK - II和 ROCK - I[1],广泛存在于各种组织中。近年来的研究发现,Rho激酶的激活介导了多种血管功能发生异常改变的机制,不仅引起“钙敏感化”使平滑肌收缩[2,7-8],还可以抑制NO 的产生[6,9-10],从而影响血管的功能。U46619 是TXA2的拟似物,是用来激活TP受体的常用工具药。Y27632和法舒地尔(fasudil,HA1077)是最常用的Rho激酶抑制剂。前者为吡啶类衍生物的二盐酸盐,以载体介导的易化扩散方式被细胞摄取,在细胞中作用于Rho激酶催化结构域的ATP结合位点,从而抑制Rho激酶,对ROCK I和 ROCK II抑制的Ki值分别为0.22 μmol/L 和0.30 μmol/L。后者是一种新型异喹啉磺酰胺衍生物类药物,已经作为Rho激酶抑制剂广泛用于改善和预防蛛网膜下腔出血后脑血管痉挛及引起的脑缺血症状[11]。本研究结果表明,U46619明显抑制血管的内皮依赖性舒张。Rho激酶是TP受体下游的主要靶点,我们考虑U46619对血管功能的抑制作用可能与Rho激酶激活有关。如果是的话,用Rho激酶抑制剂阻断该通路应该能有效地改善血管的舒张功能;因为在啮齿类动物的主动脉,乙酰胆碱的血管内皮依赖性舒张作用主要是通过NO介导的,那么,在阻断NO产生的情况下,Rho激酶抑制剂将不能改善血管舒张。本实验结果验证了我们的假设:在用Y27632和法舒地尔抑制Rho激酶激活的情况下,血管的内皮依赖性舒张作用得到明显改善;但是,这一作用被L-NAME(eNOS抑制剂)所抵消。这与我们前期对cAMP介导的内皮依赖性血管舒张作用进行研究的结果相一致[6]。U46619抑制了乙酰胆碱引起的eNOS磷酸化,这一作用被抑制Rho激酶所翻转。这些结果进一步表明,U46619减弱乙酰胆碱舒张血管的作用很可能与Rho激酶激活抑制eNOS的磷酸化从而降低eNOS活性使NO生成减少有关。
大量资料都表明Rho激酶激活在高血压、动脉粥样硬化等心血管疾病中起着重要作用[12-13]。因为内皮功能损伤被认为是糖尿病血管功能发生改变的一个主要环节,我们选用了基因型和肥胖型糖尿病疾病模型,对糖尿病状态下Rho激酶是否影响血管内皮功能进行研究。发现在血管离体状态下,抑制Rho激酶改善了糖尿病动物血管的内皮功能。这提示糖尿病血管病变可能与Rho激酶激活有关。考虑到Rho激酶是TP受体激活的下游分子,PGF2α和TXB2(TXA2的代谢物)均为 TP受体的配体[7],我们观察到糖尿病动物血管组织中PGF2α和TXB2水平显著升高,这为糖尿病状态下Rho激酶激活提供了直接依据。
综上所述,TP受体激活可以通过增强Rho激酶活性影响正常血管的内皮功能,糖尿病状态下血管内皮功能紊乱与TP受体激活物合成增多、Rho激酶活性增强和eNOS活性降低有关。抑制TP受体激活或抑制Rho激酶活性可能会对糖尿病血管内皮功能损伤起到预防或治疗作用。利用TP受体阻断剂或Rho激酶抑制剂对糖尿病模型动物进行慢性处理,观察心血管系统功能的改变是我们下一步研究的内容。
[1]Budzyn K,Marley PD,Sobey CG.Targeting Rho and Rho- kinase in the treatment of cardiovascular disease[J].Trends Pharmacol Sci,2006,27(2):97 -104.
[2]Sakurada S,Okamoto H,Takuwa N,et al.Rho activation in excitatory agonist-stimulated vascular smooth muscle[J].Am J Physiol Cell Physiol,2001,281(2):C571 -C578.
[3]Wakino S,Kanda T,Hayashi K.Rho/Rho kinase as a potential target for the treatment of renal disease[J].Drug News Perspect,2005,18(10):639 -643.
[4]Noma K,Oyama N,Liao JK.Physiological role of ROCKs in the cardiovascular system[J].Am J Physiol Cell Physiol,2006,290(3):C661 - C668.
[5]汪祥海,伍 卫,杨 军,等.Rho激酶在血管紧张素Ⅱ刺激大鼠心肌成纤维细胞增殖和胶原合成中的作用[J].中国病理生理杂志,2007,23(6):1098-1101.
[6]Liu CQ,Leung FP,Wong SL,et al.Thromboxane prostanoid receptor activation impairs endothelial nitric oxidedependent vasorelaxations:The role of Rho kinase[J].Biochem Pharmacol,2009,78(4):374 -381.
[7]Wilson DP,Susnjar M,Kiss E,et al.Thromboxane A2-induced contraction of rat caudal arterial smooth muscle involves activation of Ca2+entry and Ca2+sensitization:Rho-associated kinase-mediated phosphorylation of MYPT1 at Thr-855,but not Thr- 697[J].Biochem J,2005,389(Pt3):763-774.
[8]赵自刚,牛春雨,魏艳玲,等.Rho激酶在阻断休克肠淋巴液回流、提高大鼠血管钙敏感性中的作用[J].中国病理生理杂志,2012,28(1):11-15.
[9]Ming XF,Viswambharan H,Barandier C,et al.Rho GTPase/Rho kinase negatively regulates eendothelial nitric oxide synthase phosphorylation through the inhibition of protein kinase B/Akt in human endothelial cells[J].Mol Cell Biol,2002,22(24):8467 -8477.
[10]Ming XF,Barandier C,Viswambharan H,et al.Thrombin stimulates human endothelial arginase enzymatic activity via RhoA/ROCK pathway:implications for atherosclerotic endothelial dysfunction[J].Circulation,2004,110(24):3708-3714.
[11]徐利保,王天晓,孙 薇.Rho激酶抑制剂的研究进展[J].国际药学研究杂志,2008,35(6):429-432.
[12]Shimokawa H,Takeshita A.Rho-kinase is an important therapeutic target in cardiovascular medicine[J].Arterioscler Thromb Vasc Biol,2005,25(9):1767 - 1775.
[13]Mita S,Kobayashi N,Yoshida K,et al.Cardioprotective mechanisms of Rho-kinase inhibition associated with eNOS and oxidative stress-LOX-1 pathway in Dahl salt- sensitive hypertensive rats[J].J Hypertens,2005,23(1):87-96.
