血管紧张素-(1-7)通过AC-cAMP途径增加THP-1源性泡沫细胞ABCA1的表达并减少细胞胆固醇含量*
2012-01-30杨志明
阎 丰, 杨志明, 刘 娟
(山西医科大学第二医院心内科,山西太原030001)
动脉粥样硬化斑块形成是冠心病的病理学基础,泡沫细胞的形成在动脉粥样斑块的形成中起着重要的作用[1]。三磷酸腺苷结合盒转运子A1(ATP-binding cassette transporter A1,ABCA1)是细胞膜上重要的胆固醇流出调节蛋白,它介导的细胞内胆固醇流出是胆固醇逆转运(reverse cholesterol transport,RCT)的起始环节[2]。环磷酸腺苷(cyclic adenosine monophosphate,cAMP)是细胞内重要的第二信使,亦是调节ABCA1表达的重要因子[3]。血管紧张素-(1-7)[angiotensin-(1-7),Ang-(1-7)]是近几年发现的可拮抗血管紧张素Ⅱ(angiotensinII,Ang II)的一种激素,它通过和Mas受体结合起到抗炎、抑制血管平滑肌增殖的作用[4]。通过前一阶段研究,我们已证明Ang-(1-7)可以使单核细胞ABCA1蛋白表达增加,胆固醇流出率增加。那么cAMP是否在Ang-(1-7)影响泡沫细胞ABCA1的表达过程中起作用呢?尚缺乏充分证据。本实验通过分别对泡沫细胞施加Ang-(1-7)和腺苷酸环化酶抑制剂MDL(MDL-12,330A)因素,观察泡沫细胞ABCA1表达及胆固醇含量的变化。
材料和方法
1 材料
人THP-1单核细胞株购自中科院上海细胞库,RPMI-1640培养基购于 HyClone,Ang-(1-7)、MDL和佛波酯(phorbol myristate acetate,PMA)均购于Sigma,鼠抗人ABCA1Ⅰ抗购自 Santa Cruz,羊抗鼠Ⅱ抗购于武汉博士德公司,胆固醇标准品购于中国药品生物制品检定所,氧化低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL)购于北京欣和佳源公司,RNAiso Plus总RNA提取试剂、逆转录试剂盒、实时荧光定量试剂盒均购自TaKaRa,[3H]胆固醇购于American Life Science,ABCA1和 β-actin引物购自上海生工生物工程有限公司,油红O试剂购于北京索莱宝公司,甲醇、异丙醇和乙腈为天津市河东区红岩试剂厂产品,CO2培养箱购自Thermo,高效液相色谱仪购自Waters。
2 方法
2.1 细胞培养 将人THP-1单核细胞悬浮于含15%胎牛血清的RPMI-1640培养基中,在5%CO2、37℃条件下培养。显微镜下可见细胞呈球形、悬浮生长。根据细胞生长情况换液、传代。选取生长良好的3~5代细胞进行实验研究。实验前在培养液中加入160 nmol/L PMA孵育THP-1细胞24 h,诱导单核细胞分化为巨噬细胞,显微镜下观察细胞可见细胞由悬浮状态向贴壁状态转化,伸出伪足,呈现巨噬细胞形态。换液后加入50 mg/L ox-LDL,培养48 h,使其变成泡沫细胞。换含15%胎牛血清的培养液后加入干预因素。实验分为4组:(1)泡沫细胞组:不加干预因素;(2)MDL组:加MDL 10 mmol/L;(3)Ang-(1-7)组:加 Ang-(1-7)1 000 nmol/L;(4)MDL+Ang-(1-7)组:分别加10 mmol/L MDL和1 000 nmol/L Ang-(1-7)。
2.2 泡沫细胞模型的鉴定 采用Lillie氏油红O染色法。将THP-1源性单核细胞接种于6孔板中,按上述方法诱导泡沫细胞模型。后弃上清,PBS洗3次,加10%甲醛固定15 min,PBS洗3次,60%异丙醇漂洗1次20~30 s,稀释油红O储存液,油红O∶去离子水=3∶2,滤纸过滤4~5次,室温放置10 min,染色15 min左右,经60%异丙醇分化数秒钟,水洗1~2 min,用稀释1倍的明矾苏木素染液淡染细胞核30 s,水洗返蓝,显微镜下观察并摄像。
2.3 ELISA检测各组cAMP的含量 各组细胞处理后,样品弃上清,PBS洗3次,刮刀刮取细胞,置于离心管中,用1 mL注射器反复抽吸裂解细胞,每孔分别加入标准品和上述裂解液各100 μL,将反应板充分混匀后置37℃ 120 min,用洗涤液将反应板充分洗涤4~6次,向滤纸上印干,每孔中加入第Ⅰ抗体工作液100 μL,将反应板充分混匀后置于37℃ 60 min洗板同上,每孔加酶标抗体工作液100 μL,将反应板置于37℃ 30 min,洗板同前,每孔加入底物工作液100 μL,置于37℃暗处反应15 min。每孔加入100 μL终止液混匀。30 min内用酶标仪在450 nm处检测吸光度值。制定cAMP标准曲线,根据公式y=3.4603 × x1.0629/(6.00151.0629+x1.0629)计算各组cAMP数值。
2.4 实时荧光定量逆转录-聚合酶链反应(realtime RT-PCR)检测ABCA1 mRNA的表达 使用Trizol提取总RNA,按试剂盒说明(TaKaRa)逆转录成cDNA。以ABCA1 cDNA为模板,ABCA1上游引物P1为aacagtttgtggcccttttg,下游引物P2为agttccaggctggggtactt。按两步法进行反应:95℃预变性30 s,95℃ 5 s,60℃ 31 s,扩增40个循环。实验重复3次,取平均值,根据以下相对定量公式计算:待测样本相对量 =2-ΔΔCt,ΔΔCt= ΔCt内参照- ΔCt待测样品,ΔCt=Ct阴性对照-Ct待测样品。
2.5 Western blotting检测 ABCA1蛋白的表达 胰蛋白酶消化、离心收集细胞,PBS洗涤3次后加入细胞裂解液,4℃、12 000×g离心15 min,提取细胞总蛋白。经12%SDS聚丙烯酰胺变性凝胶分离蛋白,电转膜法将蛋白转移到硝酸纤维膜上,封闭,先后加I抗、II抗,酶法显色。显影后扫描图像进行统计学分析。
2.6 高效液相色谱仪检测细胞内胆固醇的含量(1)总胆固醇的提取:收集细胞冰浴超声10 min裂解细胞,加15%KOH乙醇溶液,50℃水解2 h,用正己烷-异丙醇抽提2次,有机相液氮吹干干燥,用流动相溶液溶解摇匀,作为总胆固醇标准品的供试液。(2)游离胆固醇的提取:取细胞裂解液,加入乙醇,用正己烷-异丙醇如上法抽提2次,并液氮吹干干燥,溶解摇匀,作为游离胆固醇标准品的供试液。(3)取胆固醇标准品倍比稀释法配成5个不同的浓度,将上述标准品溶液分别注入高效液相色谱仪,进样量为10 μL,以胆固醇的质量浓度为横坐标X轴,其电压波峰面积为纵坐标Y轴,绘制标准曲线。(4)按流动相异丙醇 -乙腈(50∶50)、流速1 mL/min、柱温40℃的色谱条件,进样20 μL,记录胆固醇的峰面积,代入回归方程,计算总胆固醇量和游离胆固醇量,总胆固醇量减去游离胆固醇量为胆固醇酯的量。
2.7 闪烁计数法测定细胞内胆固醇流出率 随机选择诱导好的泡沫细胞,在含15%胎牛血清的RPMI-1640培养液中加入0.37×109Bq/L[3H]标记胆固醇共同孵育48 h之后,用PBS液洗涤细胞2次,再在新培养液中按以上分组分别加入Ang-(1-7)、MDL和Ang-(1-7)+MDL干预因素培养24 h,再用PBS液洗涤细胞。在无血清含10 mg/L载脂蛋白A-I(apolipoprotein A-I,ApoA-I)的新培养液中继续培养12 h,闪烁液裂解细胞后,用闪烁计数法检测培养液和细胞的[3H]标记胆固醇。胆固醇流出率(%)=培养液(counts/min)值 ÷[培养液(counts/min)值 +细胞(counts/min)值]×100%。
3 统计学处理
采用SPSS 16.0统计软件分析,数据用均数±标准差(±s)表示,多组间比较采用单因素方差分析(ANOVA),组间两两比较采用最小显著差异法(LSD法),以P<0.05为差异有统计学意义。
结 果
1 THP-1源性单核细胞、巨噬细胞及泡沫细胞的形态
将THP-1单核细胞用PMA诱导24 h后可见细胞呈梭形贴壁生长,多数细胞伸出伪足,说明细胞己分化为巨噬细胞。再用50 mg/L ox-LDL与巨噬细胞共同孵育48 h后,经油红O染色,显微镜下观察,细胞质内有大量的红色脂质颗粒存在,符合泡沫细胞形态特点,见图1。

Figure 1.The induction process of foam cells(×400).A:THP-1 monocytes;B:macrophages;C:foam cells.The THP-1 monocytes were induced to be macrophages by 160 nmol/L PMA for 48 h,followed by methanol fixation for 15 min,oil red O staining for 15 min and alum hematoxylin staining for 30 s.图1 THP-1单核细胞、巨噬细胞和泡沫细胞的形态
2 ELISA检测各组cAMP的含量
Ang-(1-7)组较泡沫细胞组、MDL组和Ang-(1-7)+MDL组cAMP含量明显增加(P<0.05);MDL组较泡沫细胞组明显降低(P<0.05);Ang(1-7)+MDL组介于Ang-(1-7)组与泡沫细胞组间,且与两组有显著差异(P<0.05)。cAMP标准曲线见图2,各组cAMP含量值见表1。
3 细胞内ABCA1 mRNA的表达
以泡沫细胞中ABCA1 mRNA作为空白对照,经Ang-(1-7)干预的泡沫细胞中ABCA1 mRNA表达较泡沫细胞、MDL组显著增加(P<0.05);MDL干预的泡沫细胞中,ABCA1 mRNA的表达较泡沫细胞组显著降低(P<0.05);MDL+Ang-(1-7)组介于泡沫细胞组与Ang-(1-7)组之间,与两组有显著差异(P<0.05),各组mRNA相对表达量见表2。

Figure 2.The standard curve of cAMP sample generated by Hill curve fitting.图2 通过Hill曲线拟合生成的cAMP标准曲线
表1 各组细胞cAMP含量Table 1.The content of cAMP in different groups(nmol/L.±s.n=3)

表1 各组细胞cAMP含量Table 1.The content of cAMP in different groups(nmol/L.±s.n=3)
*P < 0.05 vs foam cells.
Foam cells 0.9547 ±0.0031 MDL 0.8508 ±0.0060*Ang-(1-7) 1.1397 ±0.0020*Ang-(1-7)+MDL 1.0693 ±0.0028*
表2 细胞内ABCA1 mRNA的表达Table 2.The expression of ABCA1 mRNA in different groups(%.±s.n=3)

表2 细胞内ABCA1 mRNA的表达Table 2.The expression of ABCA1 mRNA in different groups(%.±s.n=3)
*P < 0.05 vs foam cells.
Foam cells 1.0000 ±0.0000 MDL 0.8945 ±0.0201*Ang-(1-7) 1.8966 ±0.0272*MDL+Ang-(1-7) 1.5873 ±0.0110*
4 各组细胞ABCA1蛋白的表达
泡沫细胞组、MDL组、Ang(1-7)+MDL组、Ang-(1-7)组细胞ABCA1蛋白表达分别为65.05% ±6.70%、50.44% ± 1.41%、70.06% ± 4.40% 和75.20% ±1.29%。Ang-(1-7)组与泡沫细胞组、MDL组和Ang-(1-7)+MDL组比较,ABCA1表达明显增高,差异显著(P<0.05),MDL组较泡沫细胞组明显降低(P <0.05),Ang-(1-7)+MDL介于Ang-(1-7)组与泡沫细胞组之间,与泡沫细胞组比较有升高趋势,但差异无统计学意义(P>0.05),见图 3、4。
5 各组细胞胆固醇含量
Ang-(1-7)组与泡沫细胞组、MDL组和Ang-(1-7)+MDL组比较,胆固醇含量减低(P<0.05),MDL组与泡沫细胞组比较胆固醇含量增加(P<0.05)。MDL+Ang-(1-7)组胆固醇含量介于泡沫细胞组与Ang-(1-7)组之间,与两组比较差异有统计学意义(P <0.05),见图5、6 及表3。
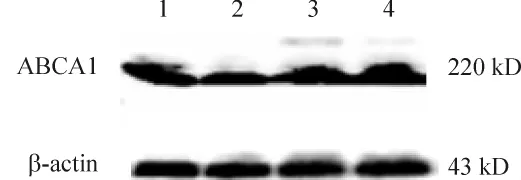
Figure 3.The expression of ABCA1 protein in different groups.1:foam cells group;2:MDL group;3:Ang-(1-7)+MDL group,4:Ang-(1-7)group.图3 各组细胞ABCA1蛋白的表达
6 各组细胞胆固醇流出率
Ang-(1-7)组与泡沫细胞组、MDL组和Ang-(1-7)+MDL组比较,胆固醇流出率最高(P<0.05),MDL组与泡沫细胞组比较胆固醇流出率下降(P<0.05)。MDL+Ang-(1-7)组胆固醇流出率介于泡沫细胞组与Ang-(1-7)组之间,与两组比较差异有统计学意义(P<0.05),见表4。
讨 论
近年研究认为,冠状动脉粥样硬化形成过程中,血管内皮细胞损伤与泡沫细胞的形成在冠脉粥样硬化的病变中起着重要的作用[5]。肾素-血管紧张素系统(renin-angiotensin system,RAS)是维持机体正常水电解质平衡、血压的重要系统。近年发现其在血管平滑肌细胞增殖和迁移及冠状动脉粥样斑块形成和进展过程中起着重要的作用。Ang II是这一作用的关键分子,而Ang-(1-7)是血管紧张素家族的终末活性产物,是Ang II的内源性拮抗因子,在心血管系统中起重要调控作用[6],其与Mas受体结合后通过NO/cGMP途径、钙调神经磷酸酶/T细胞活化核因子、细胞外信号调节蛋白激酶(extracellular signal-regulated protein kinase,ERK)/p38、核因子κB等途径发挥扩张血管、降低血压、抑制平滑肌细胞增殖、利尿、利钠及抑制新生内膜增生等功能[7]。ABCA1是ABCA超家族的一员[8],它以ATP为能源对包括脂质、细胞毒素和药物等底物进行转运,是RCT过程中的重要的蛋白。新生高密度脂蛋白主要由ApoA-I与ABCA1结合后转运脂质,这是ABCA1介导RCT的第一步,也是限速步骤。随后高密度脂蛋白运送脂质到肝脏以胆盐的形式排泄。cAMP是细胞内重要的第二信使,研究显示cAMP通过抑制磷酸二酯酶和活化腺苷酸环化酶可调节血小板聚集及抑制血栓形成[9]。目前已证实 cAMP通过诱导ABCA1的分泌增加并降低胆固醇的循环水平,促使巨噬细胞中多余的游离胆固醇排出,从而抑制泡沫细胞的形成。其机制可能为当ApoA-I与ABCA1结合后,活化了与ABCA1偶联的Gα,使腺苷酸环化酶激活,cAMP产生[10],并作用于 SP1/3及SP1元件调节GC-Box的表达,从而导致ABCA1磷酸化,进行胆固醇生理外流调节[11]。

Figure 6.The standard curve of cholesterol stardard.图6 胆固醇的标准曲线
表3 各组细胞内胆固醇含量Table 3.The intracellular content of cholesterol in different groups(mg/L.±s.n=3)

表3 各组细胞内胆固醇含量Table 3.The intracellular content of cholesterol in different groups(mg/L.±s.n=3)
*P < 0.05 vs foam cells.
Foam cells 38.5833 ±0.6171 16.3500 ±0.7000 MDL 43.9500 ±0.5074* 20.9000 ±0.1803*Ang-(1-7) 25.6000 ±0.4359* 12.2500 ±0.0500*MDL+Ang-(1-7) 30.2333 ±0.5008* 13.7800 ±0.6322*
表4 各组细胞胆固醇流出率Table 4.The cholesterol efflux rates in different groups(%.±s.n=3)
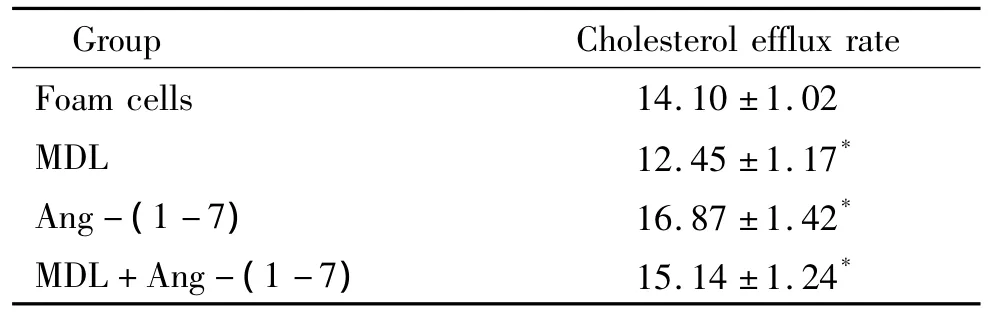
表4 各组细胞胆固醇流出率Table 4.The cholesterol efflux rates in different groups(%.±s.n=3)
*P <0.05 vs foam cells.
Group Cholesterol efflux rate Foam cells 14.10 ±1.02 MDL 12.45 ±1.17*Ang-(1-7) 16.87 ±1.42*MDL+Ang-(1-7) 15.14 ±1.24*
通过前述研究[12-13],我们已证明Ang-(1-7)可拮抗Ang II的作用,并通过转录级联效应促进过氧化物酶体增生物激活受体γ、肝X受体α和ABCA1的表达使巨噬细胞胆固醇流出率增加。cAMP作为RCT中影响ABCA1表达的重要调节因子,在Ang-(1-7)调节胆固醇逆转运的过程中是否起作用呢?本研究显示,Ang-(1-7)与泡沫细胞组比较可使ABCA1表达增加,通过促进胆固醇外流,使泡沫胆固醇含量降低。MDL组与泡沫细胞组比较ABCA1表达降低,胆固醇外流减少,胆固醇含量增加。这证明cAMP在ABCA1的表达及RCT过程中起着重要的作用。Ang-(1-7)+MDL与泡沫细胞组比较ABCA1有升高趋势,胆固醇含量降低。这表明cAMP在Ang-(1-7)作用于泡沫细胞的RCT起着十分重要的作用,但抑制cAMP的产生并不能完全阻断Ang-(1-7)对泡沫细胞RCT的作用。Ang-(1-7)与Mas受体结合后,通过上述一系列信号转导通路影响RCT的过程。
本实验通过建立THP-1源性泡沫细胞模型,证实了Ang-(1-7)可促进泡沫细胞ABCA1 mRNA和蛋白的表达,并促进胆固醇外流使泡沫细胞胆固醇含量降低;通过MDL抑制腺苷酸环化酶的活化而减少cAMP的分泌,可部分拮抗Ang-(1-7)但不能完全阻断它在泡沫细胞RCT中的作用,本实验进一步探讨了Ang-(1-7)在RCT过程中的影响因子及通路,提示cAMP在Ang-(1-7)促进泡沫细胞RCT及抑制动脉粥样硬化形成过程中起着重要的作用。
[1]Sekiya M,Osuga J,Igarashi M,et al.The role of neutral cholesterol ester hydrolysis in macrophage foam cells[J].J Atheroscler Thromb,2011,18(5):359-364.
[2]Zhao Y,van Berkel TJ,van Eck M.Relative roles of various efflux pathways in net cholesterol efflux from macrophage foam cells in atherosclerotic lesions[J].Curr Opin Lipidol,2010,21(5):441-453.
[3]Fantidis P.The role of intracellular 3',5'-cyclic adenosine monophosphate(cAMP)in atherosclerosis[J].Curr Vasc Pharmacol,2010,8(4):464-472.
[4]Akhtar S,Yousif MH,Dhaunsi GS,et al.Angiotensin-(1-7)inhibits epidermal growth factor receptor transactivation via a Mas receptor-dependent pathway[J].Br J Pharmacol,2012,165(5):1390-1400.
[5]Lynn EG,Austin RC.Hydrogen sulfide in the pathogenesis of atherosclerosis and its therapeutic potential[J].Expert Rev Clin Pharmacol,2011,4(1):97-108.
[6]Santos RA,Ferreira AJ,Simöes E,et al.Recent advances in the angiotensin converting enzyme 2-angiotensin(1-7)Mas axis[J].Exp Physiol,2008,93(5):519-527.
[7]Gomes ER,Lara AA,Almeida PW,et al.Angiotensin-(1-7)prevents cardiomyocyte pathological remodeling through a nitric oxide/guanosine 3',5'-cyclic monophosphate-dependent pathway[J].Hypertension,2010,55(1):153-160.
[8]Broccardo C,Luciani M,Chimini G.The ABCA subclass of mammalian transporters[J].Biochim Biophys Acta,1999,1461(2):395-404.
[9]Fantidis P.The role of intracellular 3'5'-cyclic adenosine monophosphate in atherosclerosis[J].Curr Vasc Pharmacol,2010,8(4):464-472.
[10]赵国军,唐朝克.ApoA-Ⅰ与ABCA1结合激活信号通路并介导细胞内胆固醇流出[J].中南医学科学杂志,2011,39(4):361-365.
[11]Schmilz G,Langman T.Structure,function and regulation of the ABC1 gene product[J].Curr Opin Lipidol,2001,12(2):129-140.
[12]亢小红,杨志明,边云飞,等.不同浓度的血管紧张素Ⅱ、血管紧张素-(1-7)对THP-1巨噬细胞过氧化体增殖物激活型受体γ表达的影响[J].中国动脉硬化杂志,2011,19(6):505-508.
[13]李 慧,杨志明,肖传实,等.血管紧张素-(1-7)与血管紧张素Ⅱ对THP-1巨噬细胞NPC1表达及胆固醇流出的影响[J].中国病理生理杂志,2011,27(3):455-459.
