RASA1在胰腺癌中的异常表达及其临床意义*
2012-01-30秦玉璇李东风张世能段伊帆谢子钧李子俊
秦玉璇, 李东风, 张世能, 段伊帆, 谢子钧, 李子俊△
(1南方医科大学研究生院,广东广州510515;广东省医学科学院,广东省人民医院2消化科,3医学研究中心,广东广州510080;4中山大学孙逸仙纪念医院消化科,广东广州510120)
胰腺癌是恶性程度最高的肿瘤之一,具有早期 侵袭性生长和远处转移的特性,预后极差,平均5年生存率不到5%。Ras信号通路的异常活化与胰腺癌的发生发展关系密切。Kirston-ras癌基因蛋白(简称K-Ras)是Ras信号通路的核心成员,而RASA1蛋白是负性调节K-Ras的关键蛋白之一。本实验拟检测RASA1在胰腺癌及胰腺良性病变组织中的表达水平,分析其与胰腺癌临床病理特征的关系,探讨其在胰腺癌发病中的作用。
材料和方法
1 材料
1.1 细胞 人胰腺癌细胞株Capan-2、CFPAC-1和BxPC-3(Capan-2和CFPAC-1为K-ras基因突变型,BxPC-3为K-ras基因野生型)购自中国科学院上海细胞研究所,使用RPMI-1640或DMEMHG培养基(Life Technologies)加10%胎牛血清(Life Technologies),5%CO2、37 ℃ 培养;正常人胰腺导管上皮细胞H6C7(由中山大学孙逸仙纪念医院张世能教授惠赠)使用 Keratinocyte-SFM培养基(Life Technologies)加10%胎牛血清(Life Technologies),5%CO2、37 ℃培养。
1.2 组织切片 取广东省人民医院病理标本库2000年至2009年胰腺导管腺癌切除石蜡标本32例,所有患者术前均未接受放疗、化疗及其他抗肿瘤治疗,术中未发现远处转移。按日本胰腺病学会提出的胰腺癌分类标准:依据肿瘤组织的大小、浸润范围、局部淋巴结转移及远处转移等情况,将胰腺癌分为Ⅰ~Ⅳ期。32例中Ⅰ、Ⅱ和Ⅲ期各5、13和14例,无Ⅳ期患者。临床随访时间:自患者术后开始随访至2011年9月,共23例达到随访终点。另取10例胰腺良性病变(5例胰腺囊肿、5例慢性胰腺炎)组织标本作为对照(来源于广东省人民医院病理标本库)。所有标本均经病理科医生复习阅片后制备石蜡组织切片。肿瘤患者临床资料见表1。
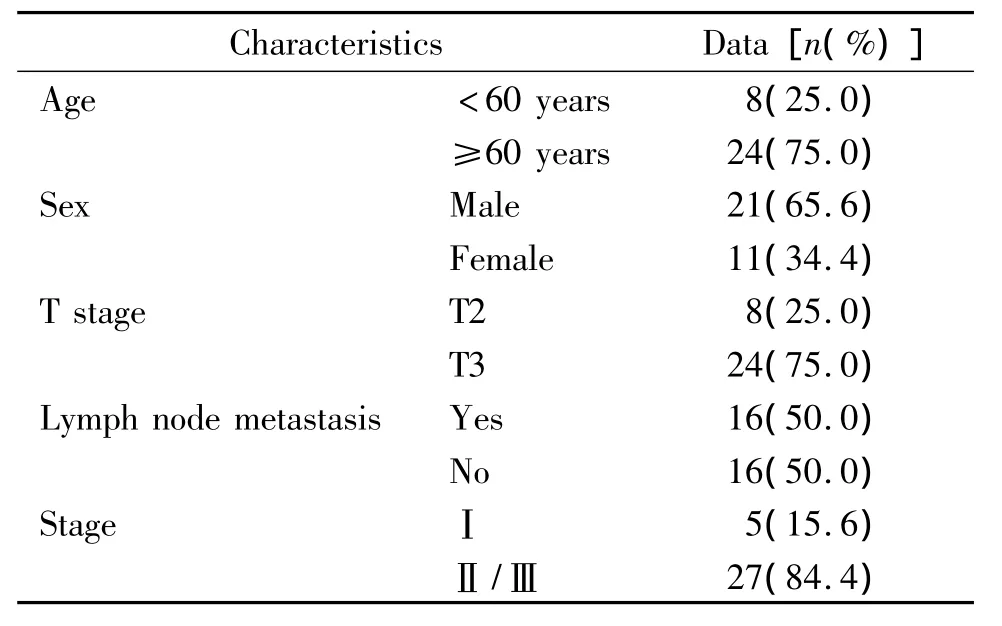
表1 胰腺癌患者临床特征Table 1.Clinical characteristics of pancreatic cancer patients
2 方法
2.1 荧光定量PCR法检测细胞中RASA1 mRNA表达 采用Trizol(Life Technologies)提取细胞总RNA。通过逆转录获得cDNA,以GAPDH为内参照,进行荧光定量PCR。RASA1引物:正义链5’-TGACAGAACGATAGCAGAAGAAC-3’,反义链 5’-TTCCACCAATGTAGTAATC TCCAC-3’;在 ABI-7500型荧光定量PCR仪上进行PCR反应。反应条件:95 ℃ 10 min,95 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s,50个循环。反应结束后确认real-time PCR的扩增曲线和熔解曲线,利用实时荧光PCR仪自带软件进行分析,获得产物Ct值;并回收产物,进行琼脂糖凝胶电泳。RASA1 mRNA的相对表达量采用2-ΔCt计算。
2.2 Western blotting检测细胞中RASA1蛋白的表达 以400 μL 100℃ 1×SDS裂解液裂解2×106个细胞,煮沸10 min;4℃、20 000×g离心10 min,取上清;BCA法测定蛋白浓度;调整浓度至1 g/L,取20 μL蛋白行SDS-PAGE电泳;将蛋白质转印到PVDF膜上;兔抗人RASA1多克隆抗体(Epitomics)1∶1 000稀释、兔抗人GAPDH单克隆抗体(CST)1∶2 000稀释,4℃孵育过夜;加入辣根过氧化物酶标记的山羊抗兔Ⅱ抗(CST)1∶1 500稀释,室温孵育1 h;ECL(Invitrogen)显色,曝光。BandScan 5.0软件分析条带灰度并进行统计学分析。
2.3 免疫组化检测组织中RASA1蛋白的表达 采用免疫组化EnVision染色法检测RASA1蛋白表达。石蜡组织常规脱蜡水化;pH 8.0 Tris-EDTA液高温高压修复;3%H2O2室温孵育15 min消除内源性过氧化物酶,PBS漂洗;兔抗人RASA1单克隆抗体(Lifespan)1∶50稀释,室温孵育60 min,PBS漂洗;羊抗兔EnVision试剂(上海基因公司)室温孵育35 min,PBS漂洗;DAB显色,苏木精复染,脱水透明,树胶封片。PBS代替Ⅰ抗作为阴性对照,用已知表达阳性的人卵巢癌标本作为阳性对照。阳性细胞必须具备:(1)细胞结构清晰;(2)阳性颗粒定位准确;(3)着色明显高于背景,对比清楚。RASA1定位于细胞质。阳性染色为黄色、棕黄色或棕褐色。免疫组化结果根据阳性细胞染色强度判定:无着色为0分,淡黄色或黄色为1分,棕黄色或棕褐色为2分。
3 统计学处理
使用SPSS 13.0软件进行统计分析,采用单因素方差分析比较各细胞株间RASA1 mRNA表达差异,采用χ2检验及Fisher精确概率法分析各组织中RASA1的表达差异及RASA1表达水平与各临床病理特征之间的关系;对于不符合正态分布和/或方差不齐的数据采用秩和检验,以P<0.05为差异有统计学意义。
结 果
1 胰腺细胞中RASA1 mRNA表达水平
胰腺癌细胞(BxPC-3、Capan-2、CFPAC-1)和胰腺导管上皮细胞(H6C7)RASA1 mRNA的相对表达量(×10-5)分别为:20.38 ±3.25、35.99 ±4.80、34.15 ±5.61 和 41.20 ±4.88;其中 BxPC-3、Capan-2、CFPAC-1与H6C7的表达量之间差异显著(均P<0.01),即上述胰腺癌细胞中RASA1 mRNA表达量均低于胰腺导管上皮细胞。BxPC-3细胞(K-ras基因野生型)中的RASA1 mRNA表达量显著低于Capan-2和CFPAC-1细胞(K-ras基因突变型)(P<0.01);而Capan-2和 CFPAC-1细胞的表达量之间差异无统计学意义(P>0.05),见图1。
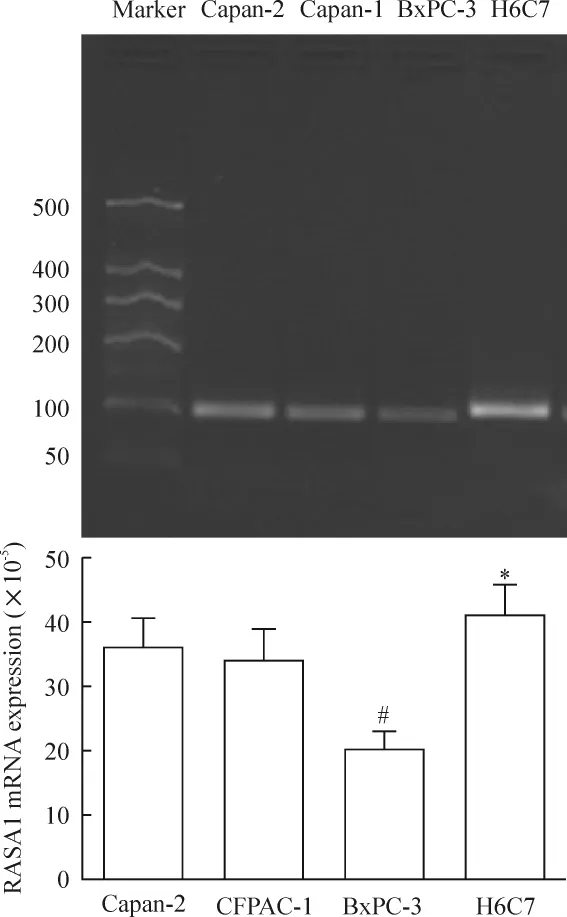
Figure 1.RASA1 mRNA expression in different pancreatic cells.±s.n=9.*P<0.05 vs other groups.#P<0.05 vs Capan-2 or CFPAC-1.H6C7:pancreatic duct cells;Capan-2 and CFPAC-1:K-ras-mutant pancreatic cancer cells;BxPC-3:K-ras-wild pancreatic cancer cells.图1 胰腺细胞中RASA1 mRNA的表达差异
2 胰腺RASA1蛋白表达水平
2.1 胰腺细胞中RASA1蛋白的表达 胰腺导管上皮细胞的RASA1蛋白表达量高于胰腺癌细胞株;Capan-2和CFPAC-1细胞的蛋白表达量高于BxPC-3细胞,其趋势与mRNA表达水平相一致,见图2。
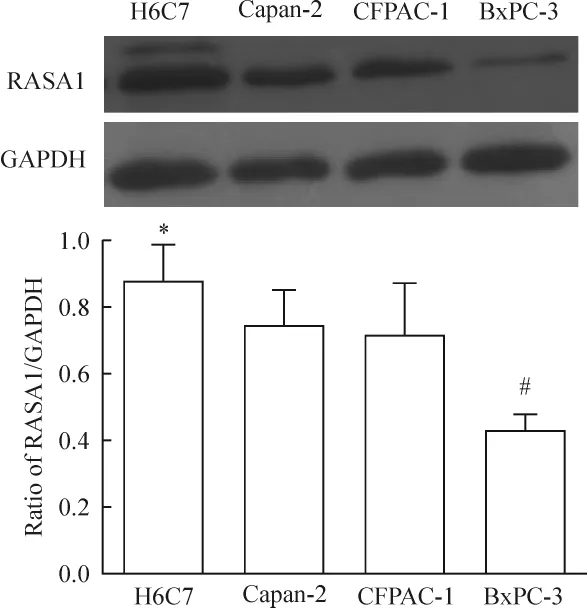
Figure 2.RASA1 protein expression in different pancreatic cells.±s.n=6.*P <0.05 vs other groups.#P <0.05 vs CFPAC-1.H6C7:pancreatic duct cells;BxPC-3:K -ras-wild pancreatic cancer cells;Capan-2 and CFPAC-1:K -ras-mutant pancreatic cancer cells.图2 胰腺细胞中RASA1蛋白的表达差异
2.2 胰腺组织中RASA1蛋白的表达 免疫组化结果显示,胰腺癌组织及胰腺良性病变组织中RASA1均表达于实质细胞细胞浆中,且90%以上细胞可见染色(评分标准见前述方法),见图3。胰腺癌组织中,记0分和1分的组织各16例;良性病变组织3例记2分,2例记0分,其余记1分;两者差异有统计学意义(P <0.01),见表2。
3 胰腺癌组织中RASA1蛋白表达水平与临床病理参数的关系
胰腺癌病例组RASA1高表达(染色为淡黄色或黄色,评分为1分)和低表达(无染色,评分为0分)各16例。依据胰腺癌浸润程度不同将手术切除病例分为2组,即胰腺癌局部浸润组(包括胰腺及胰周组织)和胰腺周围器官浸润组(十二指肠、胆管、肠系膜等)。其中胰腺局部浸润组7例,RASA1低表达者1例,高表达6例;胰腺周边浸润组25例,RASA1低表达者15例,高表达者10例。2组比较发现RASA1表达量周围器官浸润组显著低于局部浸润组(P<0.05)。依据日本胰腺癌分期,I期的胰腺癌中100%RASA1高表达(5/5),而在Ⅱ/Ⅲ期胰腺癌中,RASA1低表达者占59.26%(16/27),高表达者占40.74%(11/27)。Ⅱ/Ⅲ期胰腺癌与 I期胰腺癌比较,RASA1表达差异有统计学意义(P<0.05)。而RASA1在不同性别、淋巴结有无转移等分组中表达差异无统计学意义;而RASA1高表达组和低表达组间年龄、肿瘤最大直径、术后生存时间均无显著差异,见表3。
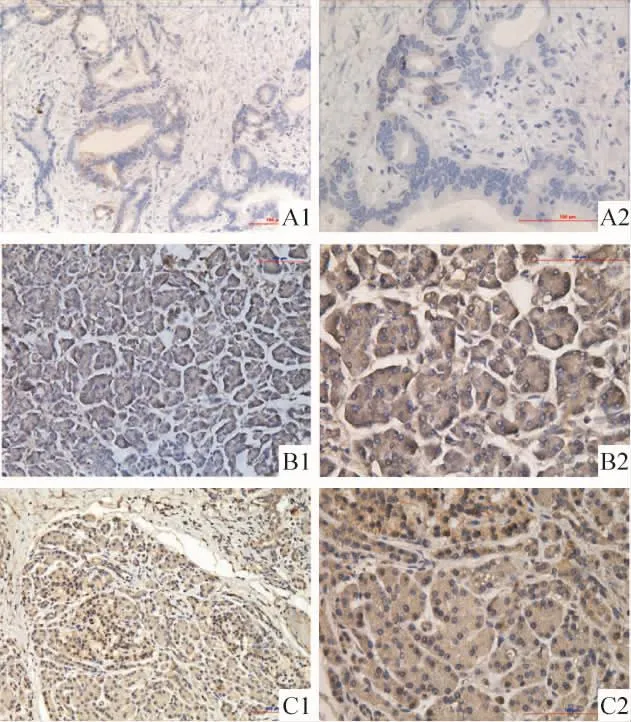
Figure 3.The immunohistochemistry for RASA1 between different tissues.A1:pancreatic cancer tissue(×200);A2:pancreatic cancer tissue(×400);B1:chronic pancreatitis tissue(×200);B2:chronic pancreatitis tissue(×400);C1:pancreatic cyst tissue(×200);C2:pancreatic cyst tissue(×400).图3 RASA1免疫组织化学结果

表2 胰腺癌和胰腺良性组织RASA1蛋白的表达差异Table 2.RASA1 protein expression differences between pancreatic cancer tissues and pancreatic benign lesion tissues
讨 论
由于环境污染和人们的饮食结构改变等原因,胰腺癌的发病率和病死率逐年增高。调查报告显示,截止2006年上海市区胰腺癌发病率达到12.17/10万,较上世纪70年代发病率上升约70%[1]。而美国每年有44030例新发胰腺癌病例,同时有37660例患者死亡[2]。因此,有关胰腺癌的研究已成为目前的热点和难点,挖掘和发现敏感而又特异的早诊分子标志物是治愈胰腺癌的关键。

表3 胰腺癌组织RASA1表达与临床病理特征的关系Table 3.The relationship between clinicopathological features and RASA1 expression level in the pancreatic tissues
2008年Jones等[3]通过全基因组检测发现胰腺癌的发生发展与12条分子信号通路相关,其中又以ras信号通路与胰腺癌关系最为密切。过去有关Ras通路异常活化的研究多集中在ras基因突变与肿瘤发生的关系[4-5],而有关野生型ras基因与肿瘤发病关系的研究较少,即野生型ras基因所调控的Ras信号通路和在肿瘤发生发展中的作用机制尚不清楚。近来,有研究显示在ras基因野生型肿瘤中,同样存在着Ras蛋白过度活化以及Ras信号通路的调节异常,与Ras活化的抑制子如 Ras GTP酶活化蛋白(Ras GTPase activating proteins,Ras GAPs)下调或作用缺失有关[6-7]。
通常体内Ras蛋白处在Ras GTP活化和Ras GDP失活两种循环状态,而调节它们的是两类酶蛋白分子,即Ras鸟嘌呤核苷酸交换因子(Ras guanine nucleotide exchange factors,Ras GEFs)和 Ras GAPs。Ras GEFs促使 Ras GDP转化为活化状态的 Ras GTP,开放Ras信号通路,而 Ras GAPs则通过增加Ras蛋白内在的GTPase活性,水解Ras GTP形成Ras GDP,关闭Ras信号通路而发挥负调控作用。
RASA1是最早发现的Ras GAPs之一,相对分子量为120 kD,属胞浆蛋白。其N端由SH3、SH2、PH及CaLB/C2等区域组成,C端是具有催化作用的GTP酶活化蛋白(GAP)结构域。RASA1通过GAP相关催化域与活化的Ras(Ras GTP)结合,激活内在的Ras GTP酶活性,促进Ras GTP水解为Ras GDP,从而关闭Ras信号通路[8]。
现有的研究表明:RASA1是胞内调节细胞增殖凋亡信号通路的关键分子,其与众多肿瘤细胞转化相关[9]。Davidson等[10]发现在 16% 的前列腺癌组织中胞浆RASA1表达较前列腺良性组织减少,推测可能起到抑癌基因的作用。分别采用基因芯片或比较基因组杂交的方法检测乳腺癌细胞和组织中基因表达,结果均表明相对于正常组织或细胞,RASA1在乳腺癌组织或细胞中表达明显下调或缺失,说明RASA1的缺失可能对肿瘤的发生发展起促进作用[11-13]。此外,通过蛋白芯片检测发现在多株结肠癌、胃癌及乳腺癌等肿瘤细胞中,耐药细胞株的RASA1表达较非耐药细胞株显著下调,提示RASA1的缺失在肿瘤细胞产生耐药的过程中起作用[14]。
本研究检测胰腺癌细胞和组织中RASA1的表达,结果发现胰腺癌细胞和组织中RASA1的表达较正常细胞或良性病变组织中均表达显著下调,说明RASA1在胰腺癌发生中可能具有抑癌蛋白样的作用。临床研究依据胰腺癌浸润程度不同将手术切除标本分为两组,即胰腺癌局部浸润组(包括胰腺及胰周组织)和胰腺周围器官浸润组(十二指肠、胆管、肠系膜等),结果发现后者RASA1表达量显著低于局部浸润组,提示RASA1表达量减低可能与肿瘤的侵袭能力提高有关。而关于胰腺癌有无淋巴结转移的研究发现,RASA1表达量高低与淋巴结是否转移相关性不明确。
本研究结果分析发现,Ⅰ期胰腺癌组织中RASA1表达量显著高于Ⅱ、Ⅲ期组织,说明RASA1的表达降低可能是发生在胰腺癌早期的分子事件,提早检测或干涉胰腺癌中RASA1的表达水平有可能对胰腺癌的早诊或防治有价值,有待进一步深入研究。
综上所述,Ras信号通路是参与胰腺癌发生发展中重要的通路之一,而RASA1与Ras通路关闭失活密切相关。本研究首次证实了RASA1在胰腺癌肿瘤和良性组织中表达差异显著,且发现其表达与胰腺癌的浸润深度、分期相关,说明RASA1在胰腺癌发生发展中具有重要作用。未来有关RASA1及同类RAS GAP蛋白分子功能的深入研究,有望从RAS信号通路活化的另一侧面寻找和挖掘到肿瘤诊断或治疗新的靶分子。
[1]顾 凯,吴春晓,鲍萍萍,等.上海市胰腺癌流行现况、回顾与比较分析[J].外科理论与实践,2009,14(5):510-515.
[2]Siegel R,Ward E,Brawley O,et al.Cancer statistics,2011:the impact of eliminating socioeconomic and racial disparities on premature cancer deaths[J].CA Cancer J Clin,2011,61(4):212-236.
[3]Jones S,Zhang X,Parsons DW,et al.Core signaling pathways in human pancreatic cancers revealed by global genomic analyses[J].Science,2008,321(5897):1801-1806.
[4]吴文辉,肖隆斌,汤友珍,等.K-ras基因突变与结直肠癌生物学行为的关系[J].中国病理生理杂志,2009,25(11):2159-2162.
[5]吴文辉,汤友珍,肖隆斌,等.结直肠癌原发灶、门静脉血和肝转移灶K-ras基因突变的研究[J].中国病理生理杂志,2010,26(10):1913-1917.
[6]Ohta M,Seto M,Ijichi H,et al.Decreased expression of the RAS-GTPase activating protein rasal1 is associated with colorectal tumor progression[J].Gastroenterology,2009,136(1):206-216.
[7]Calvisi DF,Ladu S,Conner EA,et al.Inactivation of ras GTPase-activating proteins promotes unrestrained activity of wild-type ras in human liver cancer[J].J Hepatol,2011,54(2):311-319.
[8]Marshall MS,Hill WS,Ng AS,et al.A C-terminal domain of GAP is sufficient to stimulate ras p21 GTPase activity[J].EMBO J,1989,8(4):1105-1110.
[9]Iyengar P,Tsao MS.Clinical relevance of molecular markers in lung cancer[J].Surg Oncol,2002,11(4):167-179.
[10]Davidson B,Agulansky L,Goldberg I,et al.Immunohistochemical analysis of rasGTPase activating protein rasGAP in prostate cancer[J].Pathol Res Pract,1998,194(6):399-404.
[11]Hu X,Stern HM,Ge L,et al.Genetic alterations and oncogenic pathways associated with breast cancer subtypes[J].Mol Cancer Res,2009,7(4):511-522.
[12]Johannsdottir HK,Jonsson G,Johannesdottir G,et al.Chromosome 5 imbalance mapping in breast tumors from BRCA1 and BRCA2 mutation carriers and sporadic breast tumors[J].Int J Cancer,2006,119(5):1052-1060.
[13]Naylor TL,Greshock J,Wang Y,et al.High resolution genomic analysis of sporadic breast cancer using arraybased comparative genomic hybridization[J].Breast Cancer Res,2005,7(6):1186-1198.
[14]Schäfer R,Tchernitsa OI,Györffy B,et al.Functional transcriptomics:an experimental basis for understanding the systems biology for cancer cells[J].Advan Enzyme Regul,2007,47:41-62.
