人心肌肌球蛋白轻链基因启动子驱动的GFP和Luc报告基因在人心肌细胞系中的表达*
2012-01-30许秀芳汪劲松赵莉敏杜兰萍葛桂玲王世强黄益民
许秀芳, 辛 毅, 汪劲松, 赵莉敏, 杜兰萍, 葛桂玲,李 娜, 张 颖, 王世强, 黄益民, 罗 毅
(首都医科大学附属北京安贞医院,北京市心肺血管疾病研究所1细胞与分子生物学研究室,3实验中心,北京100029;2首都医科大学附属北京儿童医院心外科,北京100045;4北京放射医学研究所,北京100850;5北京大学生命科学学院,北京100871;6北京中医药大学电镜室,北京100029)
肌球蛋白轻链2v(myosin light chain 2v,MLC2v)的表达在胚胎心脏发育形成过程中起很重要的作用,MLC2v表达的异常改变将导致心脏缺陷,例如人类心肌病与MLC2v的点突变相关。无论在胚胎发育和出生后的婴儿发育或成熟期,MLC2v都具有心脏高度特异性。MLC2v基因的启动子(myosin light chain 2v gene promoter,pMLC2v)是3 kb 的片段,心脏特异性序列位于250 bp内,接近于TATA box[1]。有报道利用心室肌特异的MLC-2v启动子驱动EGFP,研究了大鼠骨髓间充质干细胞(mesenchymal stem cells,MSCs)分化心室肌细胞的过程,不仅证明转染pMLC2v-EGFP并不影响大鼠MSCs的生长和向心室肌样细胞分化的能力,还证明EGFP在MLC-2v启动子驱动下能特异、有效标记大鼠骨髓MSCs来源心室肌样活细胞[2]。为了寻找一种能够示踪人MSCs分化为心肌细胞的特异性报告基因,本研究拟构建的心肌肌球蛋白轻链2v启动子驱动的绿色荧光蛋白(green fluorescent protein,GFP)和萤光素酶(luciferase,Luc)报告基因慢病毒载体[3-6],转染人心肌细胞系(human cardiomyocyte cell line,HCM)和人肺癌细胞系A549,观察2种细胞中报告基因的整合表达特征,以及pMLC2v-GFP和pMLC2v-Luc是否具有心肌细胞特异性,为利用多个报告基因同步示踪实验动物活体内人MSCs的归巢、迁移和分化等多个生命特征奠定基础。
材料和方法
1 材料
1.1 主要试剂 高糖DMEM培养基、胎牛血清(fetal bovine serum,FBS)、青霉素和链霉素均购自Gibco。胰蛋白酶(Sigma)。羊抗人心肌肌钙蛋白(troponin)I(I抗,Santa Cruz)和FITC标记兔抗羊IgG(Ⅱ抗,Jacson);小鼠抗人肌球蛋白轻链单克隆抗体(Abcam)和TRITC标记羊抗鼠抗体IgG(Ⅱ抗,Jacson)。人心肌细胞系HCM和心肌细胞培养基(myocardial cell medium,MCM)购自 ScienCell Research Laboratories。细胞培养板、离心管、培养皿等均购自Corning。
1.2 主要仪器 激光共聚焦显微镜(Leica,TCS SP5 MP型),CO2细胞培养箱(三洋),高速低温离心机和酶标检测仪(Beckman),生物发光成像系统(IVIS LuminaⅡ型),细胞电刺激器(北京大学生命科学学院自制),透射电子显微镜(JEM-1230)。
2 方法
2.1 慢病毒载体的包装与鉴定 参照前期的方法[3],分别应用pMLC2v-GFP和pMLC2v-Luc质粒,与含有HIV-1病毒gag、pol和rev等基因的pHelper 1.0质粒(编码病毒主要的结构蛋白)、含有单纯疱疹病毒VSVG基因的pHelper 2.0质粒(提供病毒包装所需要的衣壳蛋白)构建pMLC2v-GFP或pMLC2v-Luc报告基因慢病毒载体。同时构建非特异性启动子驱动GFP(common promoter-driven GFP,GFPC)和非特异性启动子驱动红色荧光蛋白(common promoter-driven red fluorescent protein,RFPC)报告基因的慢病毒载体。
2.2 pMLC2v-GFP、GFPC和 RFPC转染 HCM 和 A549细胞
HCM采取如下方法培养:在35 mm共聚焦专用培养皿中加入1 mL MCM培养液,分别将实验和对照孔中加入1×105个原代HCM细胞,于37℃、5%CO2、95%湿度条件下培养,实验孔于第2 d换液后分别以pMLC2v-GFP、GFPC单独转染和pMLC2v-GFP和RFPC共同转染,每2 d换液,分别于第 3 d、7 d、14 d、18 d、21 d 后吸出培养液,用 PBS 洗 2 遍,激光共聚焦显微镜检测。对照孔每3 d换液1次,光镜观察细胞生长情况。采用RPMI-1640培养基按照常规培养方法培养肺癌细胞系A549,取第2代培养细胞作为对照孔细胞,转染与检测步骤同上。
2.3 pMLC2v-Luc转染 HCM和 A549细胞 24孔板加入MCM培养液,将1×105个细胞加入孔中,于37℃、5%CO2、95%湿度条件下培养,第2 d换液后转染pMLC2v-Luc,每2 d 换液,分别于第 3 d、7 d、14 d、18 d、21 d 吸出培养液,用 PBS洗2遍,生物发光成像系统定期检测。肺癌细胞系A549作为对照孔,转染与检测步骤同上。
2.4 慢病毒载体转染报告基因表达的检测
2.4.1 GFPC、RFPC和 pMLC2v-GFP 表达的荧光成像检测分别于 GFPC、RFPC和 pMLC2v-GFP报告基因转染人HCM 和 A549 2 种细胞 3 d、7 d、14 d、18 d、21 d 时,用激光共聚焦显微镜观察。红色荧光用614 nm、绿色荧光用488 nm的激发波长对不同转染方式的2种细胞进行细胞断层扫描和三维图像合成,并将2种波长的荧光成像相互重叠。分析比较报告基因转染后,不同细胞中报告基因的表达时相和表达特征。
2.4.2 Luc表达的发光成像检测 分别于Luc报告基因转染人 HCM 和 A549 2 种细胞 3 d、7 d、14 d、18 d、21 d 时,用生物发光成像系统检测2种细胞对Luc的表达。在未转染报告基因的HCM培养孔中分别加入15 g/L萤光素(Luciferin)100 μL作为阴性对照、加入Luciferase+Luciferin作为阳性对照;在转染报告基因的HCM培养孔中加入15 g/L荧光素100 μL、不加反应底物作为空白对照。A549细胞的检测方法相同。
2.5 免疫荧光鉴定人心肌肌钙蛋白I和MLC2v的表达 取pMLC2v-Luc转染前和转染21 d后的HCM和A549细胞接种于铺有盖玻片的24孔板中,24 h后PBS洗3次,每次2 min;40 g/L多聚甲醛(pH 7.2)固定40 min,PBS洗3次,每次2 min;3 g/L Triton X-100室温封闭1 h,PBS洗3次,每次2 min;200 μL 胎牛血清室温封闭 1 h,取 100 μL 1∶100 稀释的羊抗人心肌肌钙蛋白I和小鼠抗人MLC2v单克隆抗体滴到有2种细胞的盖玻片上,室温孵育1.5 h,PBS洗3次,每次2 min;分别加入1∶100 FITC标记的兔抗羊抗体IgG和TRITC标记的羊抗鼠抗体IgG,室温避光孵育1 h,PBS洗3次,每次2 min,激光共聚焦显微镜下观察细胞染色情况。
2.6 HCM超微结构鉴定 分别取转染pMLC2v-Luc前和转染后表达Luc的HCM,PBS洗3次,每次2 min;2.5%戊二醛固定,包埋,切片,透射电子显微镜观察超微结构。
2.7 HCM兴奋-收缩偶联功能检测 分别将未转染报告基因和转染pMLC2v-GFP的HCM加入2 μmoL/L的Fluo4-AM和2 mmol/L的Ca2+,37℃孵育5 min;于垂直心肌细胞长轴的细胞两端用白金电极施加10 V、1 Hz、10 ms波宽的脉冲电刺激,激光共聚焦显微镜连续观察记录人心肌细胞系内的钙火花和细胞收缩发生情况,每组共观察10个细胞,检测人心肌细胞系的兴奋-收缩偶联功能。
3 统计学处理
使用SPSS 12.0统计软件进行数据处理。数据用均数±标准差(±s)表示,组间的比较采用t检验。以P<0.05为差异有统计学意义。
结 果
1 HCM转染GFPC后GFP的表达
激光共聚焦显微镜观察结果显示,HCM的增殖周期约为7 d,培养21 d时,细胞数为原代细胞数的4~5倍,生长状态良好,显示培养21 d时有大量新增殖的心肌细胞,可用于长期的实验观察,特别是可以进行新生心肌细胞的观察研究。实验孔的HCM转染GFPC后第3 d时表达GFP,表达特征为细胞核和细胞浆中均有较强表达,显示细胞核、核仁以及部分肌丝的轮廓,见图1。GFPC可在原代HCM中稳定转染表达。转染GFPC的A549细胞也表达GFP(结果未显示)。

Figure 1.GFP expression in HCM 3 d after transfected with GFPC.A:×100;B:×400.图1 人心肌细胞系HCM转染GFPC后第3 d GFP的表达
2 HCM细胞转染pMLC2v-GFP后表达GFP
HCM转染pMLC2v-GFP 21 d后表达GFP,见图2B~D。表达特征为细胞核和细胞浆全细胞表达,可清晰显示细胞以及细胞核形态。这提示pMLC2v主要在培养21 d后新增殖的心肌细胞中稳定驱动GFP表达,在原代心肌细胞中不表达。转染pMLC2v-GFP基因的A549细胞不表达GFP,见图2A。

Figure 2.GFP expression in HCM and A549 cells 21 d after transfected with pMLC2v-GFP.A:A549 cells(×100);B:HCM(×100);C:HCM(×400);D:HCM(×1 000).图2HCM转染pMLC2v-GFP后21 d表达GFP
3 pMLC2v-GFP和RFPC慢病毒载体共转染HCM后表达双报告基因
pMLC2v-GFP和RFPC共转染后3 d,HCM表达RFP,表达特征为胞浆中呈颗粒状较强表达(图3A)。转染后21 d,HCM开始表达GFP,表达特征为全细胞表达但以胞浆中表达量稍高(图3B)。大部分HCM细胞同时表达RFP和GFP,但两者的表达强度各有不同(图3C,细胞呈黄色),部分细胞对2种报告基因均高效表达而呈金黄色,部分细胞RFP表达量较高而呈橘黄色或橘红色。少量细胞只表达RFP(图3C,细胞呈红色)或只表达GFP(图3C,细胞呈绿色)。这提示RFPC在原代和新增殖HCM中的稳定表达,并不影响pMLC2v-GFP在新增殖心肌细胞中的稳定表达,说明HCM可进行双报告基因的转染示踪。A549细胞在转染后3 d开始表达RFP,未表达 GFP。
4 HCM转染pMLC2v-Luc后表达Luc
HCM转染pMLC2v-Luc后21 d检测到强的生物发光信号,见图4E2、F1、F2、F3,说明细胞表达 Luc;而 A549 细胞系并不发光,见图 4B1、B2、B3、B4。I组:转染 pMLC2v-Luc的HCM+luciferin发光的平均光通量为(8.43±0.98)×104p·s-1·cm-2·sr-1;Ⅱ组:转染pMLC2v-Luc的人A549+luciferin发光的平均光通量为(0.27±0.54)×104p·s-1·cm-2·sr-1,2组比较差异显著(P<0.01)。这进一步提示pMLC2v驱动Luc只在新增殖的人心肌细胞系中表达,在原代细胞和A549细胞系中不表达,可用于心肌细胞活体生物发光示踪。
5 表达Luc的HCM免疫荧光染色结果
转染pMLC2v-Luc前,人HCM的肌钙蛋白 I和MLC免疫荧光染色均呈阳性,清楚可见胞浆中沿细胞长轴分布的肌丝结构(图5),证明本研究采用的原代人心肌细胞系具有典型的正常人心肌细胞结构蛋白成分表型。转染pMLC2v-Luc 21 d后,表达Luc的HCM仍然表现为肌钙蛋白I和MLC免疫荧光染色阳性,两种蛋白分布于胞浆中(图5),证明新增殖的心肌细胞仍保持了典型的正常人心肌细胞结构蛋白成分表型。A549细胞系在转染pMLC2v-Luc前后的肌钙蛋白I和MLC免疫荧光染色均为阴性。
6 HCM的超微结构
电镜观察发现,HCM并没有正常成人心肌细胞中的肌丝、肌小节和肌丝束间排列的线粒体等典型的超微结构,但多见条索状内质网和分布不均的线粒体;线粒体的形态正常,但体积明显小于正常成人心肌线粒体,见图6。

Figure 3.RFP expression(3 d)and GFP expression(21 d)in HCM after cotransfected with pMLC2v-GFP and RFPC.图3HCM同时转染RFPC和pMLC2v-GFP后RFP和GFP的表达
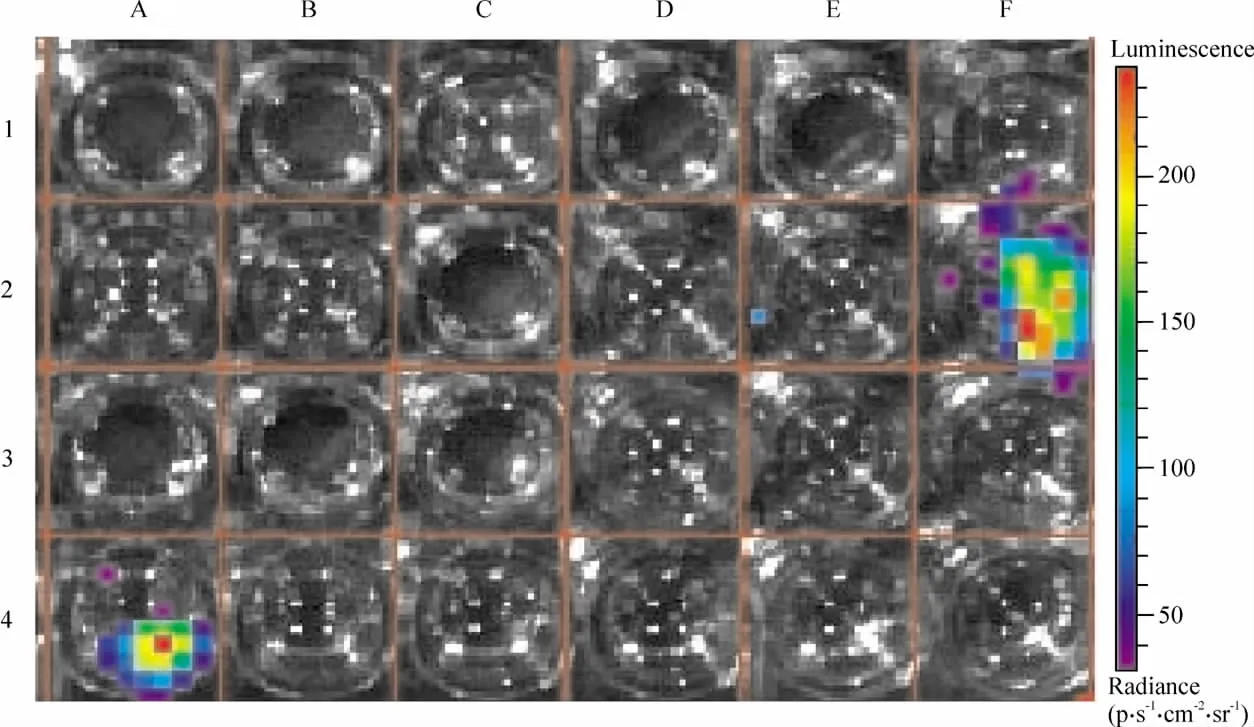
Figure 4.Luc expression in HCM 21 d after transfected with pMLC2v-Luc.F1~3,E2:HCM+pMLC2v-Luc+luciferin;A4:HCM+Luc+luciferin(positive control);C3:HCM+luciferin(negative control);A2:HCM+pMLC2v-Luc(blank control);B1~4:A549+pMLC2v-Luc+luciferin(no luminescence).图4 HCM转染pMLC2v-Luc 21 d后Luc的表达
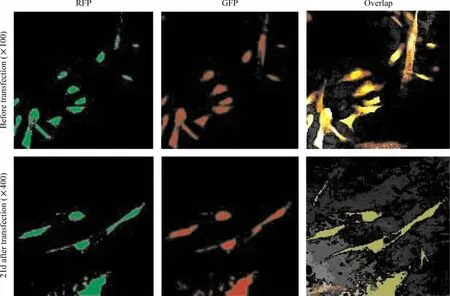
Figure 5.Immunofluorescent staining of HCM before and 21 d after transfected with pMLC2v-Luc.图5 转染pMLC2v-Luc前和转染21 d后HCM的免疫荧光染色
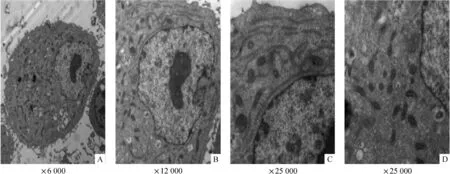
Figure 6.Ultrastructure of HCM under transmission electron microscope.A:no typical myofilaments and sarcomere in HCM;B,C and D:strip-like endoplasmic reticulum and disarranged mitochondia.图6 透射电镜观察HCM的超微结构
7 HCM的兴奋-收缩偶联功能
对转染pMLC2v-Luc前和转染21 d后的HCM连续施加10 V、1 Hz、10 ms波宽的脉冲电刺激5 min,既没有引起细胞内产生钙火花也没有引发细胞的收缩或搏动,提示本实验中无论是原代或新增殖的人心肌细胞系都不具备“兴奋-收缩偶联”功能。同样,电刺激也没有引起A549细胞收缩和细胞内出现钙火花。
讨 论
MSCs是一种成体干细胞,具有自我更新和诱导分化潜能,能够体外定向诱导分化为骨细胞、软骨细胞、脂肪细胞和心肌细胞,甚至可“横向”分化为神经细胞和神经胶质细胞[7-9],MSCs在心脏方面的研究主要集中在心肌梗死的治疗上[10-14]。近年来,将细胞移植至受损心脏处替代坏死心肌,以修复心肌结构和功能的临床实验研究已取得一定进展。一直以来,干细胞改善心功能的作用机制始终是研究的热点问题。
为了追踪观察移植细胞的归巢、嵌入、分布和分化进程,必须将移植细胞加以标记示踪,以便于识别和监测。良好的非侵入性示踪剂探针必须满足以下要求:(1)无毒;(2)不改变细胞活力、增殖、分化和其它生物活性;(3)不从标记细胞中释放出来而感染周围宿主细胞出现假阳性标记;(4)稳定的代谢分解途径;(5)足够长的半衰期;(6)能准确地反映标记细胞死亡并实现无创在体检测,具备较高的分辨率。近年快速发展的生物发光成像技术,是利用转染Luc报告基因的细胞所表达Luc在活细胞内的O2和三磷酸腺苷(adenosine triphosphate,ATP)环境中主动催化萤光素而发出生物可见光,可以穿透5~10 mm组织,具有极低的背景和高灵敏度[15-17],是活体示踪细胞功能的首选探针。报告基因GFP和RFP的表达同样可作为快速反应探针用于指示细胞活性和功能的变化。
在基因表达调控的顺式元件中,启动子就像“开关”一样发挥着控制基因表达转录的起始时间和表达程度的关键作用。启动子对外源基因的表达水平影响很大,要使克隆的报告基因能够在目的细胞中靶向、高效和长期稳定地表达,启动子最好是超强的组织特异性启动子(tissue-specific promoter)[18]。组织特异启动子又称器官特异性启动子。在这类启动子调控下,基因往往只在某些特定的器官或组织部位表达。
成年人心肌肌球蛋白是由2条200 kD的重链(MHC)和4条轻链(MLC)构成的六聚体,每条MHC分别与1条18~19 kD可磷酸化的调控MLC2和1条28 kD的基础MLC1连接[19]。心肌肌球蛋白轻链MLC-2v的启动子属于心肌组织特异性启动子[20-23],无论是在胚胎发育期或在出生后的发育成熟期或在心脏代偿重塑期[19],其调控的MLC2v表达都具有心脏高度特异性。在心肌发育期,pMLC2v可被心肌增强因子2(myocyte enhancer factor-2,MEF2)和心脏特异性转录因子GATA-4协同激活,正调肌球蛋白轻链的基因表达[22]。在人心肌肥厚时,Ca2+-钙调蛋白-钙神经素-激活T细胞的细胞核因子(Ca2+-calmodulin-calcineurin-NFAT)信号通路中的Ca2+-钙调蛋白-钙调蛋白依赖性激酶(Ca2+-calmodulin-CaMK)使组蛋白去乙酰转移酶磷酸化,继而细胞核从组蛋白释放出活化的MEF2单体,结合到人肌球蛋白轻链启动子的MEF2结合位点。同时,cAMP反应元件结合蛋白(cAMP response element-binding protein,CREB)的Ser133位点被CaMK IV磷酸化,进而结合到人肌球蛋白轻链启动子的结合位点上[20]。
正常人心室不表达肌球蛋白。因此pMLC2v处于静默状态。只有当心肌损伤需要修复或心肌细胞代偿重塑或新增殖心肌细胞时,pMLC2v才会被活化,启动和正调肌球蛋白的翻译表达。
在本实验中我们发现,HCM在转染pMLC2v-GFP和pMLC2v-Luc 21 d后才开始表达报告基因GFP和Luc,这与GFPC和RFPC在第1代细胞内表达的结果明显不同,说明了pMLC2v是在新增殖的心肌细胞中被激活进而驱动诸如GFP和Luc等外源基因正调表达。这是由于转染后的pMLC2v-GFP和pMLC2v-Luc整合到第1代心肌细胞核的相应位点,与细胞自有的pMLC2v都处于静默状态,当心肌细胞增殖时相关转录因子活化pMLC2v,在翻译肌球蛋白轻链2的同时正调两种报告基因的表达,pMLC2v-GFP和pMLC2v-Luc也随着细胞增殖被传到下一代细胞。而A549细胞转染RFPC后3 d表达RFP但转染pMLC2v-GFP和pMLC2v-Luc后始终不表达相关报告基因的结果,进一步说明本研究构建的pMLC2v-GFP和pMLC2v-Luc具有心肌细胞特异性。另外,对转染pMLC2v-GFP和pMLC2v-Luc后的心肌细胞和A549细胞的肌钙蛋白I和MLC免疫荧光鉴定结果也支持pMLC2v-GFP和pMLC2v-Luc的心肌特异性,因此本研究构建的两种报告指示载体可用于心肌细胞的增殖、肥大、筛选、干细胞分化心肌细胞的研究。
我们的前期研究证明,人脐带MSCs、人脐静脉内皮细胞株Eahy926、人肺癌细胞系A549和大鼠乳鼠心肌细胞同时转染GFPC和RFPC后,可共表达GFP和RFP,但不同细胞对每种报告基因的表达特征有所不同[4-5]。本研究中人心肌细胞共转染RFPC和pMLC2v-GFP后可以共表达RFP和GFP,但是表达时相不一致,进一步证明人心肌细胞可以同时转染表达两种报告基因,但不同报告基因的表达时相取决于上游启动子的种类和整合位点。本研究中被转染的多个报告基因可以同时复制到下一代心肌细胞,不影响细胞的生长和增殖,这为利用不同启动子驱动多报告基因研究心肌细胞的结构与功能创造了条件。
心肌完整的肌丝结构是心肌收缩的基础,而丰富的线粒体为细胞收缩提供所需要的能量[24-26]。本研究发现,与正常成年人的心肌细胞超微结构相比较,本实验采用的人心肌细胞系没有肌丝结构以及线粒体散在分布且体积较小,证明此细胞系不是真正意义上的“正常成人心肌细胞”,这种异常的超微结构是导致本实验中的心肌细胞不能被刺激产生兴奋-收缩偶联功能的最主要原因。因此,此类成年人心肌细胞系只能称为“具有成年人心肌细胞蛋白表型的细胞”,只适合用于对人心肌细胞表型的相关研究,不适合心肌细胞的动力学研究。
本研究利用pMLC2v心肌组织特异性的特点,成功构建了pMLC2v驱动的GFP和Luc报告基因慢病毒载体pMLC2v-GFP和pMLC2v-Luc,并观测了这两种报告基因在原代和新增殖人心肌细胞系中的表达特征,为活体内和体外人MSCs分化为心肌细胞进程的研究提供一种特异性的直接实时示踪工具。我们下一步将从分子水平证实新的心肌细胞合成,并利用心肌细胞pMLC2v-GFP和pMLC2v-Luc报告基因探针动态示踪人脐带MSCs在心衰小鼠心脏中分化心肌的潜能和机制,深入探讨并具体阐述MSCs治疗心衰的作用机理,为解释MSCs治疗心衰的作用机理提供可视荧光和发光的直接证据。
[1]Phillips MI,Tang Y,Schmidt-Ott K,et al.Vigilant vector:heart-specific promoter in an adeno-associated virus vector for cardioprotection[J].Hypertension,2002,39(2 Pt 2):651-655.
[2]陈 勇.大鼠骨髓间充质干细胞来源心室肌样活细胞的体外诱导及其特异标记的研究[D].重庆:第三军医大学,2003.
[3]黄益民,张 颖,辛 毅,等.小鼠活体内 hMSCs干细胞生物发光示踪监测[J].心肺血管病杂志,2010,29(4):322-328.
[4]罗 毅,张 颖,辛 毅,等.原子力显微镜定量检测人骨髓间充质干细胞等效黏附力的实验研究[J].中国医药,2010,5(11):1065-1068.
[5]罗 毅,辛 毅,张 颖,等.GFP和RFP报道基因在人体不同细胞中转导率的比较研究[J].北京生物医学工程,2011,30(1):20-25.
[6]张 颖,辛 毅,汪劲松,等.绿色荧光蛋白和红色荧光蛋白共转染骨髓间充质干细胞、乳鼠心肌细胞、Eahy926细胞表达特征的共聚焦分析[J].新乡医学院学报,2011,28(2):147-151.
[7]彭朝权,高 雅,项 鹏,等.心肌营养素1诱导骨髓间充质干细胞分化为心肌样细胞[J].中国病理生理杂志,2011,27(11):2061-2066.
[8]Toma C,Pittenger MF,Cahill KS,et al.Human mesenchymal stem cells differentiate to a cardiomyocyte phenotype in the adult murine heart[J].Circulation,2002,105(1):93-98.
[9]Silva GV,Litovsky S,Assad JA,et al.Mesenchymal stem cells differentiate into an endothelial phenotype,enhance vascular density,and improve heart function in a canine chronic ischemia model[J].Circulation,2005,111(2):150-156.
[10]Tomita S,Li RK,Weisel RD,et al.Autologous transplantation of bone marrow cells improves damaged heart function[J].Circulation,1999,100(19 Suppl):Ⅱ247-Ⅱ256.
[11]Liu J,Hu Q,Wang Z,et al.Autologous stem cell transplantation for myocardial repair[J].Am J Physiol Heart Circ Physiol,2004,287(2):H501-H511.
[12]Schächinger V,Erbs S,Elsässer A,et al.Improved clinical outcome after intracoronary administration of bonemarrow-derived progenitor cells in acute myocardial infarction:final 1 year results of the REPAIR-AMI trial[J].Eur Heart J,2006,27(23):2775-2783.
[13]Seeger FH,Tonn T,Krzossok N,et al.Cell isolation procedures matter a comparison of different isolation protocols of bone marrow mononuclear cells used for cell therapy in patients with acute myocardial infraction[J].Eur Heart J,2007,28(6):766-772.
[14]Meyer GP,Wollert KC,Lotz J,et al.Intracoronary bone morrow cell transfer after myocardial infarction:eighteen months’follow-up data from the randomized,controlled BOOST(BOne marrOw transfer to enhance ST-elevation infarct regeneration)trial[J].Circulation,2006,113(10):1287-1294.
[15]Tseng JC,Levin B,Hurtado A,et al.Systemic tumor targeting and killing by sind bis viral vectors[J].Nat Biotechnol,2004,22(1):70-77.
[16]Massoud TF,Gambhir SS.Molecular imaging in living subjects:seeing fundamental biological processes in a new light[J].Genes Dev,2003,17(5):545-580.
[17]Nygren JM,Jovinge S,Breitbach M,et al.Bone marrow-derived hematopoietic cells generate cardiomyocytes at a low frequency through cell fusion,but not transdifferentiation[J].Nat Med,2004,10(5):494-501.
[18]彭 坚,李 惠,涂知明.神经组织特异性启动子的研究方法和进展[J].中国优生与遗传杂志,2010,18(9):8-11.
[19]谌 琛.肌球蛋白轻链 -2v基因表达调控的新机制——Nished,NFATc4及其共激活因子p300所形成的转录因子三聚体与内含子序列IRE的结合是肌球蛋白轻链-2v在心肌肥厚过程中上调的关键[J].中国分子心脏病学杂志,2004,4(4):223.
[20]Woischwill C,Karczewski P,Bartsch H,et al.Regulation of the human atrial myosin light chain 1 promoter by Ca2+-calmodulin-dependent signaling pathways[J].FASEB J,2005,19(6):503-511.
[21]Dawn B,Bolli R.Bone marrow cells for cardiac regeneration:the quest for the protagonist continues[J].Cardiovasc Res,2005,65(2):293-295.
[22]Choi SC,Shim WJ,Lim DS.Specific monitoring of cardiomyogenic and endothelial differentiation by dual promoterdriven reporter systems in bone marrow mesenchymal stem cells[J].Biotechnol Lett,2008,30(5):835-843.
[23]Orlic D,Kajstura J,Chimenti S,et al.Bone marrow cells regenerate infarcted myocardium[J].Nature,2001,410(5):701-705.
[24]黄益民,张 颖,辛 毅,等.mitoKATP通道经 FOXO1-PGC1α通路调节后负荷过载小鼠心肌线粒体的代谢功能[J].中国病理生理杂志,2010,26(7):1306-1310.
[25]Lu Z,Xu X,Hu X,et al.PGC-1α regulates expression of myocardial mitochondrial antioxidants and myocardial oxidative stress after chronic systolic overload[J].Antioxid Redox Signal,2010,13(7):1011-1022.
[26]Hu X,Xu X,Lu Z,et al.AMP activated protein kinaseα2 regulates expression of estrogen-related receptor-α,a metabolic transcription factor related to heart failure development[J].Hypertension,2011,58(4):696-703.
