应用酵母双杂交系统筛选E2F1相互作用蛋白*
2012-01-30王晓通谢玉波
廉 超, 王晓通, 谢玉波, 肖 强△
(广西医科大学第一附属医院 1胃肠腺体外科,2麻醉科,广西南宁530021)
在我国,胃癌的发病率及死亡率位居所有恶性肿瘤首位。而胃癌的发生发展是一个多步骤、多基因参与的复杂过程。E2F1转录因子(E2F1 transcription factor)作为重要的细胞周期相关转录因子,与肿瘤发生发展及细胞凋亡调控密切相关[1]。我们前期研究显示,E2F1在人胃癌组织中呈高表达,在癌旁和正常组织中均呈低表达[2],这提示E2F1的表达与胃癌的发生发展密切相关。本研究应用酵母双杂交系统,以E2F1为诱饵蛋白,从人正常胃黏膜细胞的cDNA文库中筛选出E2F1相互作用蛋白,为进一步研究E2F1影响胃癌发生发展的分子机制奠定了基础。
材料和方法
1 材料
酵母表达载体pGBKT7、酵母表达载体pGADT7、人正常胃黏膜细胞 cDNA 文库[3]和 pGBKT7-E2F1诱饵质粒[4]均由本实验室保存;酵母菌AH109、SD酵母基础培养基和-Trp-Leu-Ade-His营养缺陷培养基、-Trp-Leu营养缺陷培养基、YPAD培养基和X-Gal均购自Clontech;测序公司为北京蛋白质组研究中心(BPRC)。
2 方法
2.1 酵母感受态制备及文库转化效率测定 按照Clontech公司说明书(Matchmaker system Yeast Protocols Handbook)方法制备AH109感受态细胞,将pGBKT7-E2F1 pGADT7和文库质粒共转化酵母菌AH109,最终得到酵母菌种悬浊液10 mL,取10 μL 稀释 107倍,再取 100 μL 涂布于 SD/-Trp-Leu的培养基营养缺陷型平板,30℃培养3~5 d,经观察,共生长出18个单克隆,并据此计算文库转化效率。
2.2 酵母双杂交筛选阳性克隆 将共转化后的AH109首先划线于SD/-Trp/-Leu/-Ade/-His培养基平板,30℃培养3~5 d,待长出克隆后,挑取,依次划线于SD/-Trp/-Leu培养基平板,使其充分地生长复苏。并同时划线阳性对照(以pGBKT7-53和pGADT7-T质粒共转染的AH109)和阴性对照(以 pGBKT7-Lam和pGADT7-T质粒共转染的AH109),待其达到良好生长状态后(24 h左右),再用灭菌绒布原位复制划线至SD/-Trp/-Leu/-Ade/-His培养基平板,用以检测His和Ade双报告基因表型。与此同时亦复制划线于铺有滤纸的平板,30℃培养24 h左右,进行X-Gal滤膜分析,以检测LacZ报告基因,筛选出阳性克隆20个。
2.3 回转验证及测序分析 将筛库所得阳性克隆全部划线于SD/-Trp/-Leu和 SD/-Trp/-Leu/-Ade/-His两平板,与初筛时方法相同,两板分别划线阳性对照组和阴性对照组。划线重复4次,观察阳性克隆在平板上生长情况,之后进行X-Gal滤膜分析。通过反复划线,一方面再次检验诱饵蛋白和文库蛋白的相互作用,另一方面可使质粒分散排布,并能通过反复划线对假阳性进行初步排除。将回转阳性的质粒送北京蛋白质组研究中心测序,并将测序结果在NCBI上进行BLAST同源序列比对。
结 果
1 文库筛选结果
按照Clontech公司说明书(Matchmaker system Yeast Protocols Handbook)要求,筛库总转化效率达到1.0×106cfu/μg表示文库筛选试验操作成功。经计算,文库转化效率为:18/100 ×107=1.8 ×106cfu/μg >1.0 ×106cfu/μg,故满足文库筛选要求,见图1。
Figure 1.The growth of yeast clones in SD/-Leu-Trp Petri dish.图1 稀释107倍后涂布于SD/-Leu-Trp平板上的单克隆生长情况
2 阳性克隆的鉴定
在SD/-Trp/-Leu/-Ade/-His培养基平板上共筛选得到阳性克隆21个。将这21个初筛的阳性克隆重新划线于SD/-Trp/-Leu培养基平板,使其充分地生长复苏,之后用灭菌绒布原位复制划线于SD/-Trp/-Leu/-Ade/-His平板上,经X-Gal滤膜分析证实其中有21个阳性克隆表型为Ade+、His+、Leu+、Trp+和 LacZ+,见图 2。
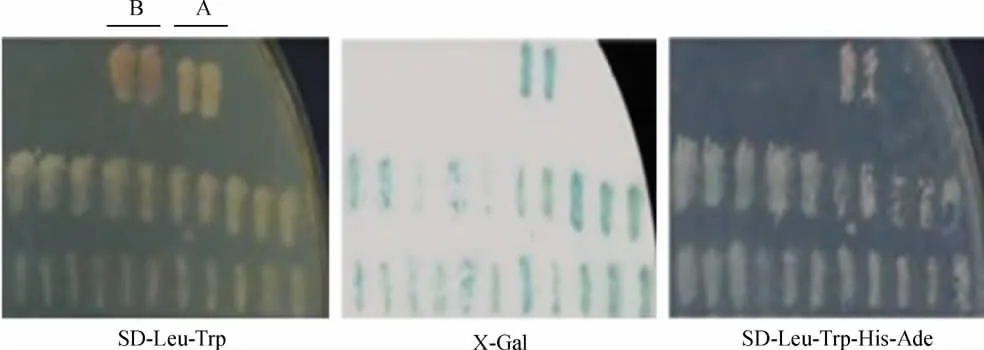
Figure 2.The growth of converted AH109 in SD/-Leu-Trp and SD/-Leu-Trp-His-Ade Petri dishes and the result of X-Gal staining(primary screening).A:positive control group(pGBKT7-53+pGADT-T);B:negative control group(pGBKT7-lam+pGADT-T).图2 共转化AH109在三平板上的生长情况
3 回转验证
将获得的阳性质粒一对一与诱饵质粒pGBKT7-E2F-1重新共转化AH109酵母菌后,重复划线4次,经X-Gal滤膜分析,筛除1组假阳性克隆,最终得到表达His、Ade和LacZ的候选阳性克隆20个,见图3。

Figure 3.The growth of converted AH109 in SD/-Leu-Trp and SD/-Leu-Trp-His-Ade Petri dishes and the result of X-Gal staining(secondary screening).A:positive control group(pGBKT7-53+pGADT-T);B:negative control group(pGBKT7-lam+pGADT-T).图3 共转化AH109在三平板上的生长情况
4 候选阳性克隆的测序及比对结果
经测序和同源序列比对,最终得到18个不同的候选基因序列,它们分别是:组织蛋白酶B(cathepsin B,CB)、SIVA1、干扰素调节因子7(interferon regulatory factor 7,IRF7)、鸟苷酸激酶1(guanylate kinase 1,GUK1)、ATP酶抑制因子1(ATPase inhibitory factor 1,ATPIF1)、核糖体蛋白 SA(ribosomal protein SA,RPSA)、纤溶酶原激活物抑制剂1 mRNA结合蛋白(serpine 1 mRNA binding protein 1,SERBP1)、精氨琥珀酸合酶1(argininosuccinate synthase 1,ASS1)、卵泡抑素类似物3(follistatin-like 3,FSTL3)、金属硫蛋白 2A(metallothionein 2A,MT2A)、内质网钙结合蛋白 1(reticulocalbin 1,RCN1)、WNT1可诱导信号通路蛋白2(WNT1 inducible signaling pathway protein 2,WISP2)、CDC42 效应蛋白 1(CDC42 effector protein 1,CDC42EP1)、可溶性半乳糖凝集素结合蛋白1(lectin galactoside-binding soluble 1,LGALS1)、中胚层发育候选2(mesoderm development candidate 2,MESDC2)、外切酶体成分7(exosome component 7,EXOSC7)和含EGF腓骨蛋白样胞外基质蛋白1(EGF-containing fibulin-like extracellular matrix protein 1,EFEMP1),还有一未知基因片段,见表1。
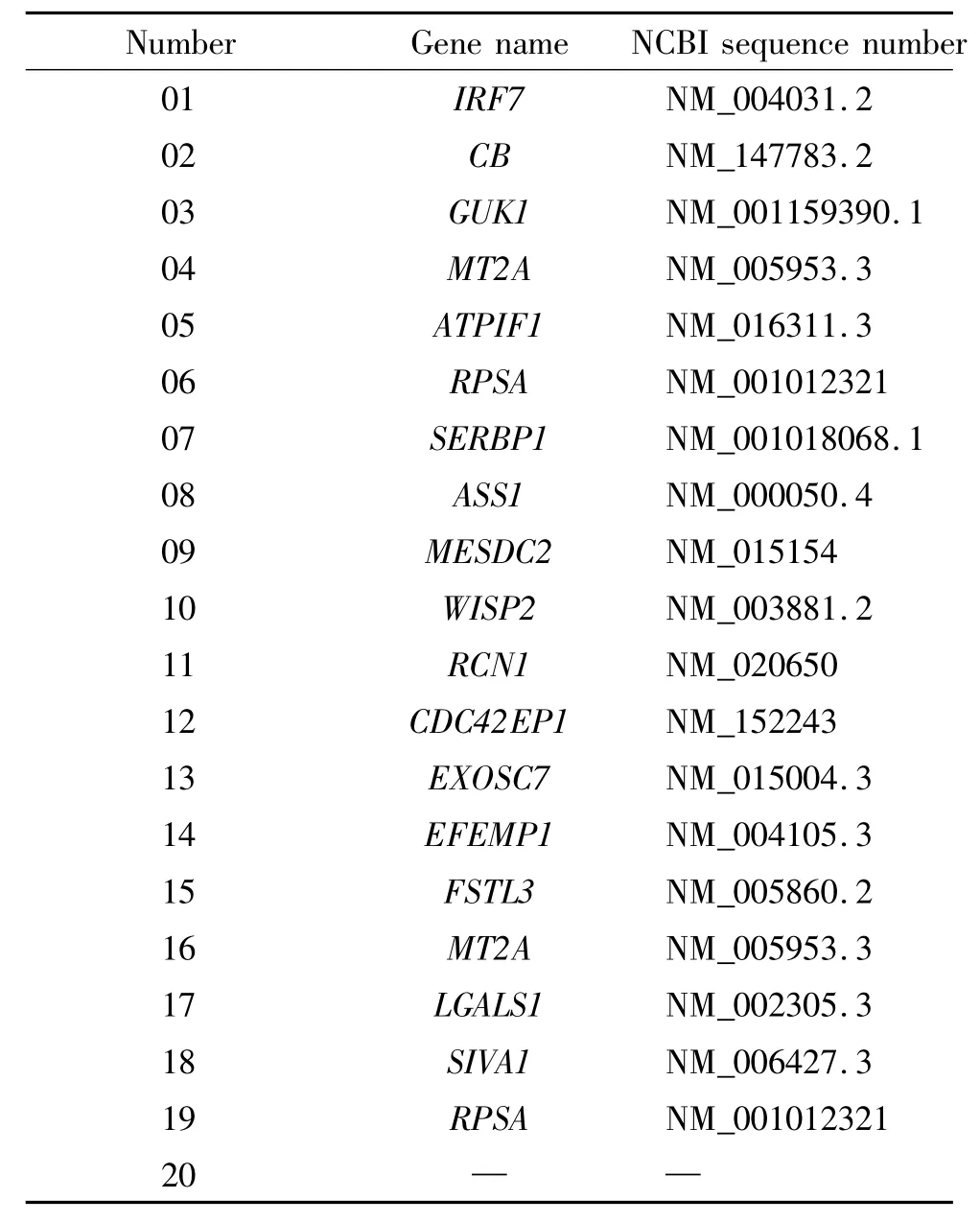
表1 E2F1相互作用蛋白的基因测序结果Table 1.Genetic sequence report of proteins interacting with E2F1
讨 论
转录因子E2F家族在控制细胞周期的进展中起关键作用。E2F1作为E2F家族重要成员之一,是细胞周期调控机制Rb/E2F通路中重要的转录活化因子。它通过与Rb及相关蛋白等多种依赖细胞周期的蛋白质及酶类相互作用,调节细胞周期由G1期向S期过渡,是细胞增殖和发育所必需的因子之一。我们前期研究显示:E2F1的高表达或沉默在体内及体外环境下均可明显抑制胃癌细胞的增殖与生长,使细胞周期阻滞在G1/S期,胃癌细胞迁移和侵袭能力明显减弱,并诱导肿瘤细胞的凋亡[5-8],但其具体机制尚未明确。
本实验应用酵母双杂交系统最终成功筛选出18种E2F1相互作用蛋白,其中CB和SIVA1已被广泛认可并已证实与E2F1及肿瘤发生发展密切相关。CB是细胞溶酶体内的一种半胱氨酸蛋白酶,能够直接降解或激活纤溶酶原激活剂及基质金属蛋白酶等而间接降解细胞外基质成分,CB对基底膜和细胞外基质的降解被认为是肿瘤侵袭与转移的关键步骤之一[9]。近年来大量研究证实,CB在胃癌、肠癌、肺癌、乳腺癌、宫颈癌、子宫内膜癌、前列腺癌、神经胶质瘤、膀胱癌、黑色素瘤和甲状腺癌等多种恶性肿瘤组织中均呈现高表达且CB活性远高于邻近正常组织[10-12],这说明CB与恶性肿瘤的发生发展密切相关。此外,Gopinath等[13]研究发现,CB可明显抑制p-ERK和c-Myc的表达,促使E2F1过表达,阻碍口袋蛋白的磷酸化进程,进而使p27表达上调,最终抑制肿瘤细胞的生长。SIVA是一种促凋亡蛋白,该蛋白与肿瘤坏死因子受体家族和抗凋亡Bcl-2家族密切相关。SIVA存在2种剪切变体,即SIVA1和SIVA2,其中SIVA1被认为对细胞凋亡的诱导起到至关重要的作用。最新研究表明,促凋亡基因SIVA是抑癌基因p53和E2F1的直接转录靶向基因,SIVA过表达不仅可诱导肿瘤细胞发生凋亡,还可抑制肿瘤的侵袭转移[14-15]。Ray 等[16]也发现,pRb 高表达可使 E2F1 表达明显增加,而E2F1表达上调会激活SIVA1转录途径,促使SIVA1过表达,进而相继激活caspase-9和caspase-3,最终诱导细胞凋亡。以上研究成果均表明,CB和SIVA1不仅在分子机制上与E2F1联系紧密,更与恶性肿瘤的发生发展密切相关。因此,E2F1极有可能通过与CB和SIVA1相互作用,经过不同的信号转导通路最终影响胃癌细胞生物学行为。另外,在本实验中,除 CB 和 SIVA1外,MT2A、RPSA、GUK1、ATPIF1、SERBP1、ASS1、MESDC2、WISP2、RCN1、CDC42EP1、EXOSC7、EFEMP1、FSTL3、IRF7、LGALS1等基因均为本次酵母双杂交系统筛选出的差异表达基因,提示这些基因与E2F1也可能有着密切的联系。
酵母细胞是最简单的真核细胞,其体内蛋白质合成后加工、修饰类型及其程度与哺乳动物的相应过程存在一定差异,因此酵母双杂交的结果仅仅是初步提出相互作用的可能性,要进一步确认CB、SIVA1等蛋白与E2F1的关系,还需在哺乳动物细胞中加以验证。对此,我们将会在未来的实验中,选取筛选得到的相互作用蛋白构建真核表达载体,分别与E2F1共转染体外培养的人胃癌细胞,以免疫共沉淀和激光共聚焦等方法进一步验证其相互作用,进而明确E2F1影响胃癌发生发展的基因通路,从而为E2F1潜在的基因治疗研究奠定基础。
[1]Xiao Q,Li L,Xie Y,et al.Transcription factor E2F -1 is upregulated in human gastric cancer tissues and its overexpression suppresses gastric tumor cell proliferation[J].Cell Oncol,2007,29(4):335 - 349.
[2]肖 强,徐君毅,谢玉波.E2F-1在胃癌组织中的突变、表达及其意义[J].中国肿瘤临床,2007,34(4):238-239.
[3]何 震,谢玉波,肖 强,等.人正常胃黏膜细胞全长cDNA文库的构建及鉴定[J].成都医学院学报,2010,5(1):8-11.
[4]孔凡彪,王晓通,谢玉波,等.E2F-1截短体的诱饵载体的构建及检测[J].广东医学,2011,32(20):2635-2637.
[5]Xie Y,Wang C,Li L,et al.Overexpression of E2F - 1 inhibits progression of gastric cancer in vitro[J].Cell Biol Int,2009,33(6):640 - 649.
[6]Xie Y,Yin Y,Li L,et al.Short interfering RNA directed against the E2F-1 gene suppressing gastric cancer progression in vitro[J].Oncol Rep,2009,21(5):1345 -1353.
[7]Wang XT,Xie YB,Xiao Q.Lentivirus- mediated RNA interference targeting E2F-1 inhibits human gastric cancer MGC -803 cell growth in vivo[J].Exp Mol Med,2011,43(11):638-645.
[8]王晓通,李 雷,钱 倩,等.转录因子E2F-1对裸鼠人胃癌细胞移植瘤生长的影响[J].中华实验外科杂志,2010,27(2):207 -209.
[9]Podgorski I,Sloane BF.Cathepsin B and its role(s)in cancer progression[J].Biochem Soc Symp,2003,(70):263-276.
[10]Liu Y,Xiao S,Shi Y,et al.Cathepsin B on invasion and metastasis of gastric carcinoma[J].Chin Med J(Engl),1998,111(9):784 -788.
[11]Chan AT,Baba Y,Shima K,et al.Cathepsin B expression and survival in colon cancer:implications for molecular detection of neoplasia[J].Cancer Epidemiol Biomarkers Prev,2010,19(11):2777 -2785.
[12]Nouh MA,Mohamed MM,El-Shinawi M,et al.Cathepsin B:a potential prognostic marker for inflammatory breast cancer[J].J Transl Med,2011,9:1.
[13]Gopinath S,Alapati K,Malla RR,et al.Mechanism of p27 upregulation induced by downregulation of cathepsin B and uPAR in glioma[J].Mol Oncol,2011,5(5):426 -437.
[14]Fortin A,MacLaurin JG,Arbour N,et al.The proapoptotic gene SIVA is a direct transcriptional target for the tumor suppressors p53 and E2F1[J].J Biol Chem,2004,279(27):28706-28714.
[15]Mei Y,Wu M.Multifaceted functions of Siva-1:more than an Indian God of Destruction[J].Protein Cell,2012,3(2):117-122.
[16]Ray RM,Bhattacharya S,Johnson LR,et al.Mdm2 inhibition induces apoptosis in p53 deficient human colon cancer cells by activating p73-and E2F1-mediated expression of PUMA and Siva -1[J].Apoptosis,2011,16(1):35 -44.
