环氧化酶2在铝负荷致大鼠海马神经元损伤中的作用*
2012-01-30万立华谢灵瑶杨俊卿
吴 柯, 万立华, 谢灵瑶, 杨俊卿△
(1重庆医科大学药学院,重庆市生物化学与分子药理学重点实验室,2重庆医科大学基础医学院法医学教研室,重庆400016)
有研究证明铝盐负荷是成熟的神经元损伤模型之一[1-2],另一方面,环氧化酶 2(cyclooxygenase 2,COX -2)的表达增加与包括外伤性脑损伤[3]、脑缺血[4]、阿尔茨海默病(Alzheimer disease)[5]等神经病理密切相关。正如大家所熟知,神经元的损伤和慢性炎症会导致神经回路甚至中枢神经系统的功能失调,那么在炎症或损伤过程中扮演着关键角色的COX-2在海马、皮层神经元呈现的高表达[6]对于神经元有明显的致损伤何作用,具体机制仍待探讨。本实验以RNA干扰为手段,以铝负荷致大鼠海马神经元损伤为模型,初步探讨了COX-2表达与神经元损伤的关系。
材料和方法
1 动物、细胞株和主要试剂
新生24 h内SD大鼠,重庆医科大学实验动物中心提供,动物许可证号为SCXK(渝)2007001;293细胞株和COX-2特异性干扰重组腺病毒由重庆医科大学检验系提供;六水三氯化铝购于国药化工试剂有限公司;B27购于Gibco;左旋多聚赖氨酸和MTT购于Sigma;乳酸脱氢酶(lactate dehydrogenase,LDH)试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒和丙二醛(malondialdehyde,MDA)试剂盒购于南京建成生物工程研究所;ECL化学发光试剂盒购于Pierce;COX-2Ⅰ抗购于Santa Cruz。
2 方法
2.1 大鼠海马神经元原代培养 参照Choi等[7]方法,出生24 h内SD乳鼠,用75%乙醇消毒后,断头。超净台分离海马,尽量剔除结缔组织和血管,并将组织尽量剪碎,加组织体积5倍的0.125%胰酶消化。250目尼龙网过滤,得到的细胞悬液,800 r/min离心8 min。2次离心后,台盼蓝法对细胞悬液进行活细胞记数。计算细胞存活率(>95%)并将细胞密度调整为1×106cells/L的细胞悬液,种植于赖氨酸处理的24孔板或96孔板中,37℃、5%CO2培养箱中培养。观测24 h神经元贴壁后,换B27无血清维持培养液进行培养,每2 d半量换液1次。
2.2 293细胞培养,腺病毒的扩增及滴度的测定 于100 mL培养瓶中种植状态良好的293细胞,生长至80%融合即用于扩增腺病毒。将1.5 mL腺病毒原液加入到4 mL 10%DEME完全培养液中充分混匀,再加入到PBS洗过的80%融合的293细胞中,37℃、5%CO2培养箱继续培养。荧光观察病毒感染率及倒置显微镜观察细胞病变效应(cytopathic effect,CPE)到明显荧光且细胞出现明显的CPE时即到达收病毒时间。3 000 r/min离心,0.5 mL培养液吹散细胞沉淀,37℃至-80℃反复冻融4次,8 000 r/min低温离心15 min,收集上清液即为扩增好的腺病毒。参照江千里等[8]的方法,进行病毒滴度的测定。病毒滴度(U/L)=103U×计数孔相对于第1孔的稀释倍数/第1孔加入病毒的体积,即1×10(n+4)U/L,n=计数孔。
2.3 实验分组 正常大鼠神经元培养至第7 d,分成空载腺病毒组、COX-2特异性干扰腺病毒组、铝+空载腺病毒组、铝+COX-2特异性干扰腺病毒组。空载组加入感染复数(multiplicity of infection,MOI)为100的空载病毒量,COX-2特异性干扰腺病毒组加入MOI为100的COX-2特异性干扰病毒量;铝+空载腺病毒组全量换液成200 μmol·L-1AlCl3培养液,同时加入MOI为100的空载病毒量,铝+COX-2特异性干扰腺病毒组全量换液成200 μmol·L-1AlCl3培养液,同时加入MOI为100的COX-2特异性干扰病毒量。作用24 h后进行MTT、生化检测、荧光细胞观察和蛋白提取。
2.4 Western blotting检测海马神经元COX-2蛋白表达收集经干预处理24 h后的细胞,裂解20 min。用Bradford法测定裂解液中总蛋白含量。取细胞裂解液上样于SDSPAGE聚丙烯酰胺凝胶,每孔50 μg蛋白电泳。电转移将蛋白转至硝酸纤维素膜上。加入封闭液过夜,抗靶蛋白抗体溶液与滤膜一同室温孵育2~3 h,洗膜,加入Ⅱ抗工作液室温孵育1 h,洗膜,检测靶蛋白的表达。
2.5 SOD活性和MDA含量测定 大鼠海马神经元在24孔板中培养至7 d,胰酶消化后,低温超声破碎细胞,收集上清液0.2 mL,按照SOD和MDA试剂盒说明书,分别在550 nm和532 nm处测各管吸光度(absorbance,A)。蛋白定量采用考马斯亮蓝法。
SOD活性[103U·(g protein)-1]=(对照管A值-测定管A值)/对照管A值/50% ×反应液总体积/取样量(mL)/蛋白含量(g·L-1)。MDA[μmol·(g protein)-1]=(测定管A值-测定空白管A值)/(标准管A值-标准空白管A值)×10 μmol·L-1÷蛋白浓度(g·L-1)。
2.6 LDH测定 收集各组培养液上清0.06 mL(设为A溶液)。胰酶消化各组细胞,超声波破碎细胞,低温离心收集上清液0.06 mL(设为B溶液)。参照LDH测定试剂盒说明书,于440 nm处测各管A值。蛋白定量采用考马斯亮蓝法。
LDH活性[U·(g protein)-1]=测定管A值-测定空白管A值/标准管A值-标准空白管A值×2 mmol·L-1÷蛋白浓度(g·L-1),LDH漏出率=A/(A+B)×100%。
2.7 MTT测定 大鼠海马神经元接种于96孔板,分组及干预同“2.3”方法,24 h后,每孔加入 5 g·L-1MTT溶液 20 μL。继续培养4 h,除上清,加150 μL DMSO(二甲基亚砜)振荡以溶解结晶。于570 nm波长处读取A值。
2.8 神经元病理形态学荧光观察 腺病毒转染原代神经元24 h后,荧光倒置显微镜观察细胞形态。
3 统计学处理
结 果
1 腺病毒滴度
测得COX-2特异性干扰腺病毒滴度=1012U/L,RFP空载腺病毒滴度=1012U/L,然后根据下列公式计算转染神经元需要加入的病毒量:
MOI=病毒滴度×V(需加入的病毒液体积)/神经元细胞数,即当 MOI=100 时,V=100 μL。
2 COX-2特异性干扰对海马神经元COX-2蛋白表达的影响
Western blotting结果显示,单纯RNAi组的COX-2蛋白水平明显低于空载组。铝+空载腺病毒组COX-2蛋白水平明显增加,而RNAi+铝盐组COX-2蛋白水平明显下降,见图1。
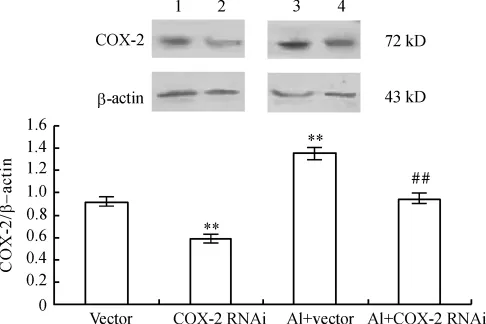
Figure 1.Changes of COX-2 protein expression in primary cultured rat hippocampal neurons.1:vector - treated group;2:COX-2 RNAi-treated group;3:vector and aluminum-treated(Al+vector)group;4:COX-2 RNAi and aluminum-treated(Al+COX-2 RNAi)group.±s.n=3.**P<0.01 vs vector group;##P <0.01 vs Al+vector group.图1 COX-2 RNA干扰对海马神经元COX-2蛋白表达的影响
3 COX-2干扰对海马神经元SOD活性、MDA含量、LDH漏出率及神经元活性的影响
与空载组相比,单纯RNAi组SOD活性无显著改变,而铝+空载腺病毒组SOD活性显著降低,COX-2 RNAi+铝盐组的SOD活性显著升高,见表1。
与空载组相比,单纯RNAi组MDA含量无显著改变,而铝+空载腺病毒组MDA含量显著增加,COX-2 RNAi+铝盐组的MDA含量明显下降,见表1。
与空载组相比,单纯RNAi组LDH漏出率无显著差异,而铝+空载腺病毒组LDH漏出率明显增加;与铝+空载腺病毒组相比,RNAi组LDH漏出率明显降低,见表1。
正常神经元RNAi组与空载组相比,MTT测定的吸光度值无显著差异;铝+空载腺病毒组MTT值明显降低,COX-2 RNAi+铝盐组MTT值明显上升,见表1。
4 COX-2干扰对海马神经元病理形态学的影响
转染空载腺病毒的海马神经元结构清楚完整,胞体饱满且胞核清晰,突触较长,并且相互连结形成网状结构,细胞数目较多。转染COX-2 RNA干扰片段进入正常的海马神经元中,细胞结构依旧完整,细胞数量多,提示单纯 COX-2 RNA干扰对神经元无明显损伤作用。
表1COX-2干扰对海马神经元SOD活性、MDA含量、LDH漏出率和MTT的影响Table 1.Changes of SOD,MDA,LDH and MTT in primary cultured rat hippocampal neuron(±s.n=6)

表1COX-2干扰对海马神经元SOD活性、MDA含量、LDH漏出率和MTT的影响Table 1.Changes of SOD,MDA,LDH and MTT in primary cultured rat hippocampal neuron(±s.n=6)
*P <0.05,**P <0.01 vs vector-treated group;#P <0.05,##P <0.01 vs vector and aluminium -treated group.
value Vector- treated 83.83 ±6.00 2.20 ±0.45 18.03 ±Group SOD[103U·(g protein)-1]MDA[μmol·(g proein)-1]LDH(%) A 3.81 0.779 ±0.080 COX -2 RNAi 84.08 ±4.50 2.85 ±0.34 20.20 ±2.43 0.768 ±0.100 Vector and aluminium -treated 46.38 ±4.04** 4.20 ±0.590** 39.68 ±4.82 ** 0.508 ±0.060*COX -2 RNAi and aluminium - treated 70.50 ±2.65## 3.27 ±0.27# 23.38 ±3.50## 0.600 ±0.060#
铝+空载腺病毒组海马神经元数量减少,且突起萎缩明显,并伴有部分死细胞。而转染了COX-2RNA干扰片段后,神经元突起较为明显,且能相互连接成网,细胞结构也较为清楚,死细胞较少,见图2。

Figure 2.Effects of COX -2 RNAi on pathomorphology in primary cultured rat hippocampal neurons(×200).A:vector group;B:COX-2 RNAi group;C:Al+vector group;D:Al+COX-2 RNAi group.图2 COX-2 RNA干扰对海马神经元病理形态学的影响
讨 论
目前,铝元素公认可在大脑诱导氧化应激,产生大量自由基,从而诱发神经退行性疾病的发生和发展。许多学者采用铝盐进行造模,病理学检查发现铝盐会导致神经元损伤和退变,并发现动物出现了学习记忆功能障碍,神经元细胞凋亡,DNA损伤等表现[9-12]。大量研究成果也表明COX-2的表达与脑损伤、神经元退变密切相关。AD患者脑内Aβ淀粉样物质水平与COX-2表达的增加具有一致性,临床上发现AD患者神经纤维缠结的神经元亦是COX-2表达增加的部位,提示COX-2的过表达可能是造成神经元死亡的原因之一[13-14]。进一步研究还提示 COX-2高表达是诱导Aβ淀粉样物质增加的因素之一[15],在经典的铝盐过负荷导致神经元损伤、退变的模型下,探究COX-2起着怎样的作用及其之间可能的内在联系必然会为治疗神经损伤和退行性变疾病开拓新的思路,并为开发新的药物提供可能的理论依据。
本研究发现,与空载腺病毒组相比,单纯COX-2 RNAi腺病毒转染神经元其各项生化酶学指标无明显的变化,神经元数目正常,细胞形成网状结构,且胞体饱满,胞核清晰。而Western blotting检测结果显示,其COX-2蛋白表达明显下降(P<0.01),一方面提示COX-2 RNAi腺病毒的转染神经元是成功的;另一方面,提示RNAi使海马神经元COX-2的表达适度沉默,并不明显影响海马神经元形态和生理功能。我们还发现,COX-2 RNAi能明显提高铝盐负荷海马神经元细胞存活力和 SOD活性(P<0.05或 P<0.01),降低细胞LDH漏出率和MDA含量(P<0.05或P<0.01),从而减轻了细胞损伤,并一定程度改善铝负荷神经元病理形态学改变。结果表明,COX-2在神经组织中过表达可能损伤神经元,COX-2 RNA干扰对神经元损伤有明显的保护作用。
[1]Meglio L,Oteiza PI.Aluminum enhances melanin - induced lipid peroxidation[J].Neurochem Res,1999,24(8):1001-1008.
[2]Matyja E.Aluminum enhances glutamate-mediated neurotoxicity in organotypic cultures of rat hippocampus[J].Folia Neuropathol,2000,38(2):47 -53.
[3]Dash PK,Mach SA,Moore AN.Regional expression and role of cyclooxygenase-2 following experimental traumatic brain injury[J].J Neurotrauma,2000,17(1):69 -81.
[4]Mancuso A,Derugin N,Hara K,et al.Cyclooxygenase-2 mRNA expression is associated with c-fos mRNA expression and transient water ADC reduction detected with diffusion MRI during acute focal ischemia in rats[J].Brain Res,2003 ,961(1):121 -130.
[5]Pasinetti GM,Aisen PS.Cyclooxygenase-2 expression is increased in frontal cortex of Alzheimer's disease brain[J].Neuroscience,1998,87(2):319 -324.
[6]Wu T,Wu H,Wang J,et al.Expression and cellular localization of cyclooxygenases and prostaglandin E synthases in the hemorrhagic brain [J].J Neuroinflammation,2011,8(3):22 -30.
[7]Kolh JY,Choi DW.Quantitive determination of glutame mediated cortical neuronal injury in cell culture by lactate dehydrogenase efflux assay [J].J Neurosci Methods,1987,20(1):83-90.
[8]江千里,王健民,温丽敏,等.批量快速测定法测定标志基因为GFP的重组病毒滴度[J].第二军医大学学报,2002,23(9):4301-5301.
[9]Mohamd EM,Ahmed HH,Estefan SF,et al.Windows into estradiol effects in Alzheimer's disease therapy [J].Eur Rev Med Pharmacol Sci,2011,15(10):1131 -1140.
[10]Ǒguz EO,Enli Y,şahin B,et al.Aluminium sulphate exposure increases oxidative stress and suppresses brain development in Ross broiler chicks[J].Med Sci Monit,2012,18(3):BR103 - BR108.
[11]傅洪军,董胜璋,林忠宁,等.JNK阻断剂CEP211004对铝诱导的大鼠皮层神经元凋亡的保护作用[J].中国药理学与毒理学杂志,2003,17(2):106–110.
[12]Cuello AC,Ferretti MT,Leon WC,et al.Early - stage inflammation and experimental therapy in transgenic models of the Alzheimer- like amyloid pathology[J].Neurodegener Dis,2010,7(1 -3):96 -98.
[13]Huong NQ,Nakamura Y,Kuramoto N,et al.Indomethacin ameliorates trimethyltin-induced neuronal damage in vivo by attenuating oxidative stress in the dentate gyrus of mice[J].Biol Pharm Bull,2011,34(12):1856 -1863.
[14]Li SY,Yang D,Fu ZJ,et al.Lutein enhances survival and reduces neuronal damage in a mouse model of ischemic stroke[J].Neurobiol Dis,2012,45(1):624 -632.
[15]Ofengeim D,Shi P,Miao B,et al.Identification of small molecule inhibitors of neurite loss induced by Aβ peptide using high content screening[J].J Biol Chem,2012,287(12):8714-8723.
