山楂总黄酮的逆流提取研究
2012-01-25戴晓燕余陈欢吴巧凤
戴晓燕,余陈欢,吴巧凤*
(1.浙江中医药大学药学院,浙江杭州310053;2.浙江省医学科学院,浙江杭州310013)
山楂系蔷薇科植物山里红Crataegus pinnatifida Bge.var.major N.E.Br.或山楂Crataegus pinnatifida Bge.的干燥成熟果实,具有健胃消食,行气散瘀之功效,属于我国药食同源的传统中药材。现代研究表明,黄酮类物质为山楂的主要活性成分[1],含有量较高[2],能够起到助消化[3]、降血脂[4]、保肝[5]、强心[6]及抗氧化[7]等作用。山楂在医用药品及保健品方面的开发利用较频繁,它的价值往往体现于其加工产品的附加值上,故加强山楂有效物质的产业化提取十分必要。目前,山楂黄酮的提取方法包括有热回流法、水煎法及渗漉法等方法,其中以热回流法最为常用,但这些方法存在着提取率低、提取时间长、溶剂用量大、后续工段能耗大等缺点[8]。逆流提取是一种基于传统单罐提取发展起来的新型提取方法,研究表明,该方法可确保药材与溶剂之间始终保持较大的有效成分浓度差,可大大增加提取效率[9]。本研究拟采用三级逆流提取、三效逆流提取工艺模型的实验室模拟方法及常规回流提取方法提取山楂总黄酮,并客观地将3种方法进行比较和评价,确定山楂总黄酮的最适提取方法,以期为山楂黄酮相关产品的产业化生产提供实验依据。
1 仪器与试药
1.1 仪器UV—2550紫外可见分光光度计(日本岛津公司),UV probe紫外工作站;HH—S型恒温水浴锅(巩义市瑛峪予华仪器厂);0412—1型高速离心机(上海手术器械厂);BS110S电子分析天平(北京赛多利斯天平有限公司);DHG—9035热风循环烘箱(上海林频仪器设备有限公司),WND—200A型高速中药粉碎机(上海微型电机厂)。
1.2 试药芦丁对照品(批号:100226)购自中国药品生物制品检定所;山楂饮片(产地:山东;批号:111118)购自浙江中医药大学饮片厂,经浙江中医药大学俞冰副教授鉴定属蔷薇科植物山楂Crataegus pinnatifida Bge.的干燥成熟果实;所用试剂均为分析纯,实验用水为蒸馏水。
2 方法与结果
2.1 不同提取方法提取山楂总黄酮
2.1.1 三级逆流提取精密称取干燥至恒定质量的山楂饮片3份,各10.0 g,分别置于3个圆底烧瓶中,以60%乙醇为提取溶媒,按照三级逆流提取工艺进行提取。具体方法如图1所示,第1阶段山楂饮片被提取3次,每次均加入新鲜溶媒50 mL,得溶液E1-1、E1-2、E1-3,其中E1-1储存。第2阶段提取,溶液E1-2、E1-3分别作为第1次、第2次提取的溶媒,得溶液E2-1、E2-2,其中E2-1储存;第3次则采用新鲜溶媒提取第2次所得药渣,得溶液E2-3。第3阶段,溶液E2-2、E2-3分别作为第1、第2次提取的溶媒,得溶液E3-1、E3-2均储存;第3次采用新鲜溶媒提取第2次所得药渣,得溶液E3-3储存。每阶段每次提取温度为80℃,提取时间20 min。最后合并各所得溶液,放凉得最终提取液。该提取方法平行试验3次。

图1 三级逆流提取过程示意图Fig.1 Schematic diagram of three-stage countercurrent extraction
2.1.2 三效逆流提取平行精密称取干燥至恒定质量的山楂饮片5份,各6.0 g,分别置于5个圆底烧瓶中以60%乙醇为提取溶媒,按照三效逆流提取工艺进行提取。具体提取方法如图2所示,方框中1-12分别代表第1至12提取步骤,方框上方符号代表每步骤所加入的溶媒,左侧符号代表被提取物,如:步骤1为加入新鲜提取溶媒与新鲜饮片进行提取;步骤2为新鲜提取溶媒与步骤1所得药渣进行提取,依此类推。每步提取温度为80℃,提取时间为15 min,凡需加入新鲜溶媒时其加入体积均为30 mL。最后合并各所得溶液,放凉得最终提取液。该提取方法平行试验3次。

图2 三效逆流提取过程示意图Fig.2 Schematic diagram of three-effect countercurrent extraction
2.1.3 常规回流提取精密称取干燥至恒定质量的山楂饮片30 g,置圆底烧瓶中,加入60%乙醇溶液300 mL,80℃热回流5 h,倾出放凉得最终提取液。该提取方法平行试验3次。
2.2 总黄酮的定量测定
2.2.1 对照品溶液的制备精密称取干燥至恒定质量的芦丁对照品5.58 mg置于25 mL量瓶中,以60%乙醇稀释至刻度线,摇匀,得质量浓度为0.223 2 mg/mL的芦丁对照品溶液,备用。
2.2.2 供试品溶液的制备量定2.1项下各最终提取液体积,均量取120 mL提取液浓缩至50 mL,以4 000 r/min的转速高速离心10 min,倾出上清液并将浓缩液用60%乙醇溶液定容成100 mL,备用。
2.2.3 检测波长的选择精密吸取对照品溶液1.0 mL于25 mL量瓶中,加入5%NaNO2溶液1.0 mL,摇匀,放置6 min后加入10%的Al(NO3)3溶液1.0 mL,摇匀,放置6 min后再加入10%NaOH溶液10 mL,摇匀后用60%乙醇溶液稀释至刻度线,放置15 min后,在波长400~600 nm范围内进行扫描,每隔10 nm测定吸光度。结果发现溶液在510 nm处的吸光度值最大,故本实验选择510 nm为检测波长。
2.2.4 标准曲线的建立精密吸取对照品溶液0.5、1.0、1.5、2.0、2.5、3.0、4.0、5.0 mL,分别置于25 mL的量瓶中,同2.2.3项下方法显色后,作同行试剂空白对照测定吸光度,以吸光度A为纵坐标Y,以芦丁质量浓度C(mg/mL)为横坐标X,绘制标准曲线,得回归方程:Y=13.064X-0.022 9(R=0.999 6)。结果表明,芦丁在0.004 464~0.044 64 mg/mL范围内与吸光度呈良好的线性关系。
2.2.5 精密度试验精密吸取对照品溶液2.0 mL,依2.2.3项中方法显色后于510 nm波长处连续测定6次吸光度。结果RSD为1.67%,表明仪器的精密度良好。
2.2.6 重复性试验精密称取山楂饮片,依照2.1项下各方法提取,并按2.2.2项下方法制备供试品溶液各6份,同2.2.3项中方法显色后分别测定吸光度。结果RSD分别为1.15%、0.74%、0.97%,表明方法的重复性良好。
2.2.7 稳定性试验精密吸取供试品溶液0.3 mL,依2.2.3项下方法显色后,每隔5 min测定吸光度,结果RSD为1.43%,表明溶液在30 min内显色稳定。因此,吸光度的测定应控制在30 min以内进行。
另精密吸取0.3 mL供试品溶液分别于0、1、2、3、4、5、6 h后,按2.2.3项下方法显色后测定吸光度,结果RSD为2.28%,表明供试品溶液在6 h内稳定。
2.2.8 加样回收试验适量量取已知总黄酮量的山楂提取液9份,分别精密加入相当于溶液中总黄酮含有量80%、100%及120%的芦丁标准品,按2.2.2项下方法制备供试品溶液,并依2.2.3项下方法显色后,测定吸光度,计算回收率,结果平均回收率为99.68%,RSD为1.60%,符合要求,见表1。
2.2.9 山楂总黄酮提取得率精密量取供试品溶液0.2 mL,依2.2.3项下方法显色,测定吸光度,代入回归方程计算总黄酮含有量,并进一步算得提取得率。
2.3 不同提取方法的比较为客观地比较不同提取方法,对上述各提取方法的饮片用量、溶剂用量、总提取时间及提取得率进行了罗列,见表2。

表1 加样回收试验测定结果(n=9)Tab.1 Results of recovery tests(n=9)
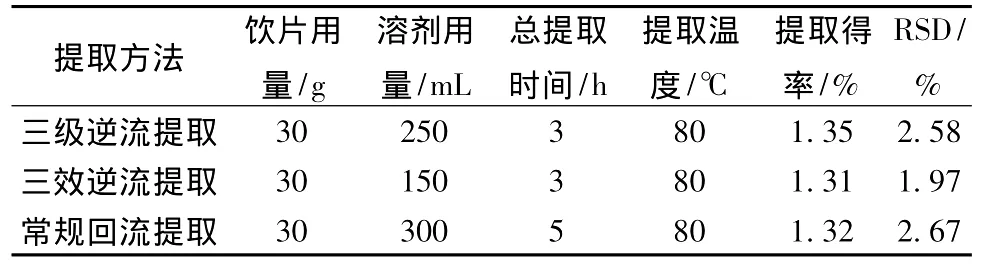
表2 不同提取方法药材用量、溶剂用量、提取时间及提取得率Tab.2 Usage,solvent usage,extract time and extract yield of different extract methods
由表2可知,三级逆流、三效逆流提取方法与常规回流提取方法相比,三者的总黄酮提取得率相当,但前两种提取方法的溶剂消耗量明显下降,其中三效逆流提取的溶剂消耗量仅为常规回流提取方法的1/2;较之常规回流提取,两种逆流提取方法的提取时间也大大缩短,为常规回流提取方法的3/5。表明逆流提取方法具有提取效果好、节省溶剂、节约实验成本以及缩短提取时间等优点,将逆流提取方法引入山楂黄酮类物质的实验室提取或推广至山楂黄酮相关产品的产业化生产均有可助于工作效率的大幅度提高。
为进一步说明逆流提取方法具有较高的提取效率,另取山楂饮片3份,各10 g,分别采用三级逆流、三效逆流及常规回流提取方法,以60%乙醇为溶剂,控制三者的总提取时间均为1 h,总溶剂用量均为100 mL,提取温度均为80℃,提取山楂中总黄酮。提取结束放凉后,取各提取液20 mL,以60%乙醇定容至50 mL量瓶中。采集用不同方法提取并定容后所得溶液的图像(见图3),运用Imagepro Plus 6.0(专业图像分析软件6.0)对各图像进行参数分析。
结果各溶液图像的像素密度大小依次为三效逆流(132.67)>三级逆流(115.66)>常规回流(92.67),表明在相同的提取条件下,逆流提取能更有效地使药材中的溶质扩散至溶剂中。

图3 不同提取方法所得提取液图像Fig.3 Solution images of different extract methods
3 讨论
药材有效成分的提取过程是溶质从固相药材高浓度向液相低浓度渗透的传质过程。有效成分的提取浸出扩散力来源于提取溶媒与固相药材组织内有效成分的浓度差,浓度差越大,扩散传质的动力越大,浸出速度越快,有效成分浸出率越大[10]。逆流提取方法可始终保持两相间较大的浓度梯度,从而维持较好的提取推动力来达到提高提取效率的目的。本实验分别采用了传统回流提取与两种逆流提取方法来提取山楂中总黄酮,结果显示逆流提取可大大减少提取的溶剂用量和时间,在节省提取成本的同时也保证了提取的质量,且对提取设备无过高要求,既适合推广应用于山楂黄酮类相关药品、食品的生产也适用于实验室的中药成分提取。此外,考虑实际生产或实验的方便性及可操作性,与三效逆流相比之下,三级逆流提取的操作步骤相对简便,亦能较好的提高提取效率,值得进一步推广应用。
[1]吴世杰,李秋津,肖学凤,等.山楂化学成分及药理作用的研究[J].药物评价研究,2010,33(4):316-319.
[2]蒋福勇.山楂资源的开发与利用简述[J].南方园艺,2011,22(1):56-58.
[3]刘家兰,徐晓玉.山楂的药理作用研究进展[J].中草药,2009,40(S1):63-66.
[4]杨宇杰,林静,王春民,等.山楂叶总黄酮对大鼠高脂血症早期干预的实验研究[J].中草药,2008,39(12):1848-1850.
[5]李晶,冯五金.生山楂、泽泻、莪术对大鼠脂肪肝的影响及其交互作用的实验研究[J].山西中药,2006,22(3):57-59.
[6]鞠晓云,方泰惠,张文通.山楂叶总黄酮冻干粉对麻醉犬冠脉结扎所致心肌梗死的影响[J].南京中医药大学学报,2005,21(6):381-383.
[7]Liu T X,Cao Y N,Zhao M M.Extraction optimization,purification and antioxidant activity of procyanidins from hawthorn(C.pinnatifida Bge.var.major)fruits[J].Food Chem,2010,119(4):1656-1662.
[8]柳唐镜,张棵,刘国英,等.中国山楂属植物资源研究和利用现状[J].南方农业学报,2011,42(8):847-852.
[9]Gaile A A,Saifidinov B M,Kolesov V V,Koldobskaya L L.Multistep countercurrent extraction of organic sulfur compounds and arenes from the high-sulfur diesel fraction[J].Russian J Applied Chem,2010,83(3):473-476.
[10]韩平,张燕,何荣.逆流提取工艺在中药提取中的应用[J].西部医药,2009,21(2):284-285.
