猪轮状病毒OSU株的培养特性与致病性研究*
2012-01-24黄小波曹三杰文心田
黄小波,徐 璐,曹三杰,文心田
猪轮状病毒OSU株的培养特性与致病性研究*
黄小波,徐 璐,曹三杰,文心田
目的开展猪轮状病毒OSU株的细胞培养特性及致病性研究,确定轮状病毒培养的关键技术与致病规律。方法以MA104细胞培养病毒,对预处理病毒的胰酶浓度与时间、维持液中最佳胰酶浓度等关键条件进行优化,透射电镜观察病毒粒子形态,测定病毒TCID50,口服感染3 d龄仔猪进行致病性试验。结果病毒经20μg/m L胰酶预处理1 h,37℃吸附细胞2 h,维持液最佳胰酶浓度为4μg/m L,病毒典型细胞病变为病变细胞葡萄串状堆积、胞浆相连、拉网等病变。透射电镜下病毒粒子呈圆形车轮状,直径约80 nm。病毒感染3日龄仔猪10h后出现典型的黄色水样腹泻,感染42 h后死亡,剖检可见胃内有凝乳块、肠壁变薄充满液体,盲肠、结肠充气。主要病变为:肠上皮细胞变性、坏死、脱落;固有膜高度扩张、充血和伴有轻微出血;粘膜上皮脱落,粘膜下层水肿、炎性细胞浸润等。结论研究阐明了轮状病毒OSU株的培养特性与致病特征。
猪轮状病毒;培养特性;人工感染;致病性
轮状病毒(Rotavirus,RV)是引起幼儿和各种幼龄动物腹泻的最常见病原之一,在世界范围发生非常普遍。RV属呼肠病毒(Reoviridae)科轮状病毒属,为双链RNA病毒。猪轮状病毒(PRV)是轮状病毒引起的一种以腹泻为特征的猪的传染病,主要引起悉生猪和未食初乳的猪发生严重的胃肠炎和绒毛萎缩[1]。RV的分离培养条件非常苛刻,一直以来都是个难题,也是阻碍RV研究的主要原因。尽管最初分离的几个轮状病毒株如猴SA11株、牛Nebraska株和O株都易在细胞培养上增殖,但其他一些动物轮状病毒如牛、猪和人的轮状病毒培养时,通常不易成功或增殖率不高,或者不易传代[2]。为探讨猪轮状病毒的细胞培养特性和致病性,本试验以A群猪轮状病毒OSU株为材料,对猪轮状病毒的细胞培养关键技术、病毒增殖特性及病毒的人工感染致病性进行研究。
1 材料与方法
1.1 毒株与细胞 猪轮状病毒OSU株,购自中国兽医药品监察所;恒河猴胚肾细胞(MA104),购自武汉大学中国典型培养物保藏中心。
1.2 试验动物 3日龄未吃初乳的健康新生仔猪,由四川农业大学种猪场提供。
1.3 主要试剂与仪器 MEM(GIBCO),新西兰新生牛血清(HyClone),胰蛋白酶(1∶250,GIBCO)购自成都金线科技有限公司;超纯水仪;倒置显微镜,Olympus(ModelCK40-200);Thermo Orion-Model868型p H仪;日立 H-600型透射电镜;QUEUE型二氧化碳培养箱;SW-CJ-2FD型无菌操作工作台等。
1.4 猪轮状病毒的细胞增殖特性
1.4.1 细胞培养 用含10%新生牛血清和1%非必须氨基酸的 MEM(p H7.0)作为生长液培养MA104细胞,48 h长成良好致密单层即可用于传代培养。
1.4.2 胰酶最佳浓度的筛选 在细胞培养维持液中加入不同浓度的胰酶(2、2.5、3、3.5、4、4.5、5μg/m L,待细胞长成单层后,不接种病毒,直接换加上述浓度的胰酶的细胞维持液,根据细胞的生长情况来优化筛选最佳的胰酶浓度,以培养24 h后有50%细胞单层未脱壁的胰酶浓度为最佳浓度。
1.4.3 病毒接种[3-5]病毒预处理,将病毒液与40 μg/mg胰酶1∶1混合,置于37℃温育1 h。取生长状态良好单层MA104细胞,弃去培养液,PBS液清洗3次,接种预处理的病毒混合液量0.5 m L,37℃,5%CO2培养箱中静止培养2 h,每30 min摇晃1次,然后补足不含血清的 MEM(p H7.4)至10 m L。37℃,5%CO2培养箱中培养,逐日观察细胞病变(CPE)情况,当CPE达90%时收取病毒液。
1.5 病毒粒子电镜观察[5]病毒细胞培养物反复冻融3次后,12 000 r/min离心20 min收集上清,45 000 r/min超速离心2 h,弃上清液。用少量PBS重悬沉淀,取10μL重悬液滴于铜网,然后用磷钨酸染色,采用透射电镜观察病毒粒子形态。
1.6 病毒TCID50的测定 将处于对数生长期的细胞消化,制成细胞悬液,加入到96孔细胞培养板内,每孔加40μL,将病毒液作10倍梯度稀释(10-1、10-2、10-3、10-4、10-5、10-6、10-7、10-8),然 后 每 孔 加 入40μL不同梯度的病毒液,每个梯度加15孔,并设一正常细胞生长对照孔。置37℃培养,逐日观察记录CPE,按照 Reed-Muech氏法计算病毒的TCID50值。
1.7 病毒的致病性试验
1.7.1 人工感染试验 选择2头健康新生仔猪,人工饲喂牛奶。试验猪3日龄人工灌服1×106.8TCID50细胞病毒毒液2 m L,对照猪人工灌服正常对照细胞培养液2 m L,接种后逐日观察试验猪的症状。
1.7.2 病理变化观察 对感染猪轮状病毒后死亡仔猪进行剖解,观察记录剖检肉眼病变,同时取空肠用10%福尔马林固定,石蜡包埋切片,经HE染色,显微镜下观察组织病变。
2 结 果
2.1 病毒的细胞增殖特性 正常MA104细胞呈扁平不规则的多边形,中有2~3个胞核,培养48h即可长成致密细胞单层。初次接种轮状病毒,不产生CPE,连续盲传培养5代后开始出现CPE,病毒培养至第10代开始,CPE开始稳定而有规律。以细胞培养维持液中含有4μg/m L胰酶时CPE出现的时间最短,稳定的CPE主要表现为:细胞拉长变形,再逐渐变圆,折光性增强,随后病变细胞出现葡萄状堆积、胞浆相连、出现拉网变化,并伴随着细胞空斑的形成。最后堆积细胞萎缩脱落,出现细胞融合现象,见图1。
2.2 电镜观察 电镜下可见典型的轮状病毒颗粒,大小为80 nm左右,略呈圆形,具有双层衣壳,见图2。
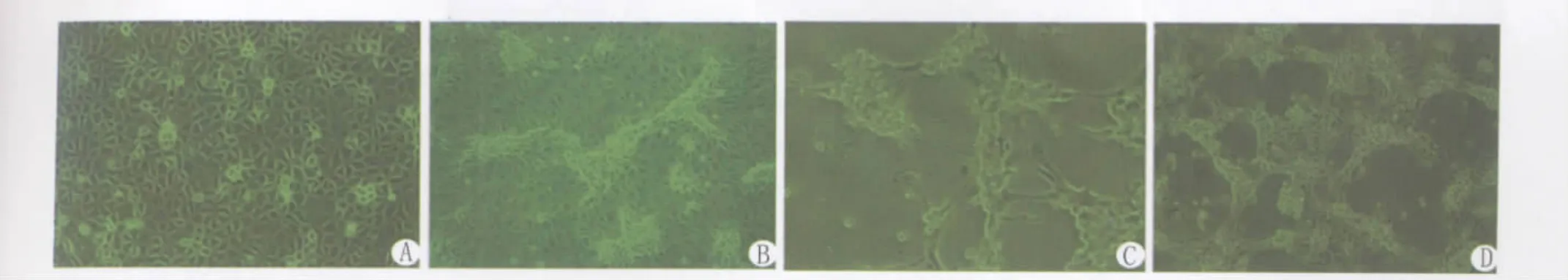
图1 轮状病毒OSU株的细胞培养特性Fig.1 Cell culture characteristics of the rotavirus OSU strain A:The normal MA-104 cells,×200;B:Welling,glazing and accretion of infected MA104 cells after 18h infected with PRV.×200;C:Kytoplasm connecting,botryoidalis accretion of infected MA104 cells after 28h infected with PRV.×400;D:Net-balloon and lacuna of infected MA104 cells after 28h infected with PRV.×200
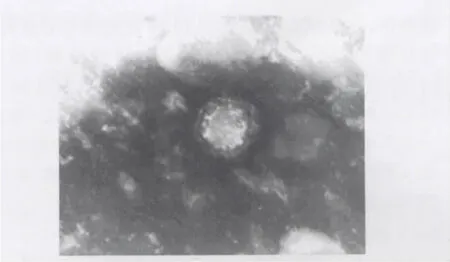
图2 透射电镜下的PRV病毒粒子(×17000)Fig.2 Virus pellets of PRV under electron microscope (×17000)
2.3 病毒TCID50测定结果 将病毒倍比稀释后分别接种96孔细胞培养板,记录出现细胞病变和没有出现细胞病的孔数,统计结果见表1。由表中数据可看出,使半数细胞出现CPE的病毒稀释倍数度(即 TCID50)介于10-6和10-7之间,然后根据Reed-Muech氏方法计算病毒的TCID50,稀释倍数根据公式来计算:距离比=(高于50%的百分数-50)/(高于50%的百分数-低于50%的百分数)=(89.4-50)/(89.4-43.8)=0.86;TCID50=高于50%的病毒最高稀释倍数的负对数+距离比=6+0.86=6.86。根据结果判定病毒的 TCID50为10-6.86/0.05 mL。
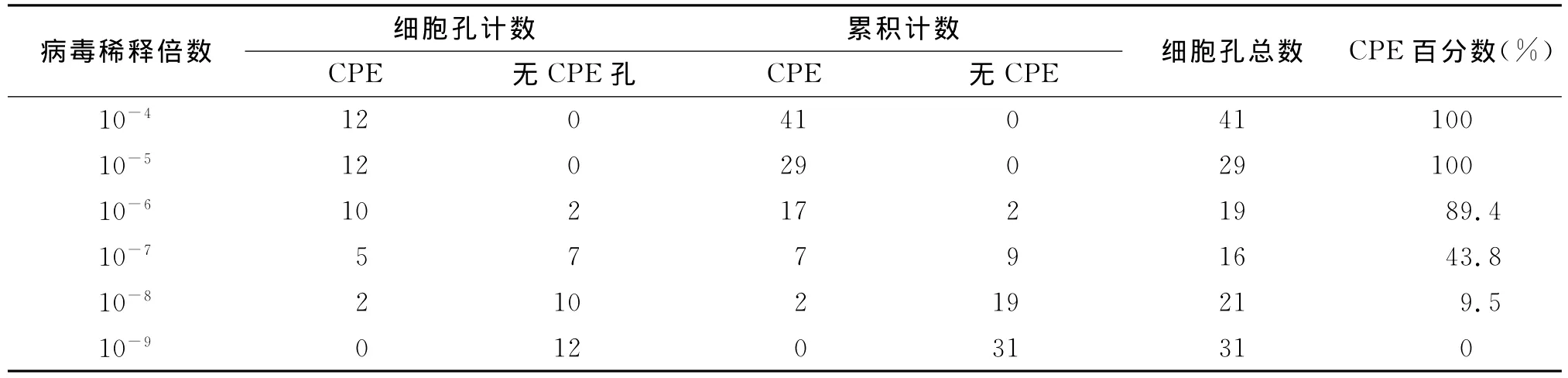
表1 病毒感染细胞的CPE的统计表Tab.1 Statistics of CPE after PRV infection
2.4 病毒的人工感染试验结果
2.4.1 临床症状 试验仔猪接种病毒10 h后开始出现腹泻,拉黄色水样稀粪夹杂白色絮状物。采集肛门粪便测定其p H值为6.0;接种病毒28 h后,仔猪精神变差,开始出现脱水,拉凝胶状腹泻物的次数增加,凝胶状腹泻物呈白色、黄色、深黄色的蛋花状。接种病毒42 h仔猪死亡,死亡时脱水非常明显,皮肤呈青紫色。整个试验过程对照猪健康正常。
2.4.2 解剖病变 剖解见胃充气,内有白色、黄色、绿色乳凝块;空肠、回肠部分充气,肠壁变薄,内有黄色内容物;盲肠、结肠肠壁变薄,充气扩张,充满黄色液体;胆囊充盈,见图3。

图3 轮状病毒OSU株感染仔猪的症状与解剖病变Fig.3 Symptoms and lesions of piglets infected with rotavirus OSU strain A.piglet developed diarrhea by post inoculation(PI)10h;B.During post mortem,yellow fluid in thinner intestines and ectocolon were observed.;C.yellow,green and white ziega in gaster,D.cholecystis turgor
2.4.3 病理变化 空肠病理切片结果显示,肠腔内有多量脱落的上皮细胞和炎性渗出物,并混有红细胞;肠上皮细胞变性、坏死、脱落;肠固有膜毛细血管高度扩张、充血并伴轻微出血;严重者粘膜上皮大量脱落,裸露出固有膜;粘膜下层水肿、增厚,炎性细胞浸润;肌层轻微水肿。
3 讨 论

图4 轮状病毒OSU株感染仔猪的病理变化Fig.4 Pathological changes of piglets infected with rotavirus OSU strains A.cytonecrosis and exfoliation of enterocyte(HE 200×);B.cytonecrosis and exfoliation of enterocyte(HE 400×)
3.1 猪轮状病毒OSU株的细胞培养特性 猪轮状病毒在猪群中感染非常普遍,在有腹泻的猪群经常可以检测到轮状病毒的存在,该病常与冠状病毒、大肠杆菌等混合感染而导致猪群严重的经济损失。从临床发病猪群的病料中分离轮状病毒难度较大,一直制约着该病的深入研究,主要原因是轮状病毒在细胞培养物上很难生长,目前除了A群轮状病毒外,其他血清群的轮状病毒的许多毒株迄今未能适应细胞培养,分离成功率约为40%~70%[6],而A群轮状病毒中仅有猴SA11株、牛Nebraska株和O株易于培养,牛、猪和人的轮状病毒均难以在细胞上生长。猪轮状病毒最初适应于经过胰蛋白酶或胰酶预处理的猪原代肾细胞[7]。后来Bohl等[8]在恒河猴胚肾细胞系MA-104上成功增殖了猪轮状病毒。采用细胞培养增殖轮状病毒需要用一定浓度的胰酶处理激活,而 胰 酶 浓 度 控 制 是 关 键[3,9],Clark 等[10]认为轮状病毒是通过胞浆膜直接进入胞浆,其穿入依赖于VP4,VP4需在胰酶作用下特异性裂解成VP5和VP8(60 k D,28 k D),从而使病毒获得感染力。Yann等[11]证实胰酶能结合轮状病毒颗粒,并溶解其外壳蛋白,而增强病毒感染性。大多数轮状病毒在细胞培养物中增殖时,一般不产生细胞病变或只产生轻微而不稳定的细胞病变,且可能需要传代几次才能见到细胞致病作用。本研究采用MA-104细胞进行病毒培养,确定了最佳胰酶浓度,即首先采用终浓度为20μg/m L胰酶对病毒预处理1 h,维持液中添加4μg/m L胰酶为培养的最适条件。连续传代7代后,出现稳定的细胞病变,一般在细胞培养18 h后产生明显的细胞病变。细胞病变表现为细胞折光性增强、圆缩、葡萄串状聚集,而后聚集细胞皱缩、脱落等特征。本研究还对病毒接种时吸附细胞单层的时间进行研究,即比较吸附1 h和2 h的效果,结果发现吸附2 h出现细胞病变时间更快,而且CPE程度也更高。本研究最终确定了培养猪轮状病毒关键条件:采用MA-104细胞培养;病毒接种前用终浓度20μg/m L胰酶37℃预处理1 h,后吸附2 h;维持液中不加血清,添加4 ug/m L胰酶,在此条件下培养可获得理想的病毒培养结果。
3.2 猪轮状病毒OSU株的致病特性与发病机制
猪自然感染轮状病毒常引起不太严重的临床疾病或亚临床疾病。对非免疫猪进行轮状病毒接种试验更能 表 现 轮 状 病 毒 所 致 临 床 疾 病 的 特 性[12-13]。Ciarlet等[14]认为A群轮状病毒具有年龄依赖性,自然感染时常感染7~14 d龄仔猪或断奶7 d内仔猪,人工感染1~5日龄仔猪症状最严重。本研究以A群的代表毒株OSU株感染3日龄初生仔猪,能引起严重的腹泻症状,同时可引起小肠上皮细胞发生急性炎性反应,并使小肠绒毛发生变性、坏死、断裂,从而引起仔猪发生严重的胃肠炎临床症状。结果显示OSU株对新生仔猪具有较强的致病性。
本研究构建了人工感染仔猪急性轮状病毒的动物模型,观察了猪轮状病毒导致的发病过程。轮状病毒进入动物体内后,主要在分化成熟的小肠绒毛上皮细胞的胞浆中进行复制[15],并导致小肠绒毛上皮细胞功能减退、死亡;被感染的细胞发生溶解或脱皮,导致绒毛萎缩。绒毛萎缩的程度和萎缩的小肠绒毛在小肠内分布情况是决定临床疾病严重程度的主要因素[16]。分化成熟的小肠细胞丢失而致小肠的消化吸收功能降低,从而使小肠内乳糖酶活性下降,进而导致乳糖在小肠肠腔内滞留,乳糖过多使小肠内容物渗透压增高,引起渗透性腹泻。由于猪群轮状病毒的亚临床感染相当普遍,从而表明猪轮状病毒的致病机理中,其他因素如宿主、环境和其他病因等可能也起重要作用。
[1]Graham D Y,Sackman J W,Estes M K.Pathogenesis of rotavirus-induced diarrhea.Preliminary studies in miniature swine piglet[J].Dig Dis Sci,1984,29(11):1028-1035..
[2]殷震,刘景华.动物病毒学[M].北京:科学出版社,1997:562-571.
[3]陈淑红,王新生,师东方,等.猪轮状病毒的分离鉴定及部分特性研究[J].中国预防兽医学报,2004,(1):42-44.
[4]Sanekata T,Kuwamoto Y,Akamatsu S,et al.Isolation of group B porcine rotavirus in cell culture[J].J Clin Microbiol,1996,34(3):759-61.
[5]洪涛.生物医学超微结构与电子显微镜技术[M].北京:北京科学出版社,1990:174-176.
[6]Saif L J,Terrett L A,Miller K L,et al.Serial propagation of porcine group C rotavirus(pararotavirus)in a continuous cell line and characterization of the passaged virus[J].J Clin Microbiol,1988,26(7):1277-1282.
[7]Theil K W,Bohl E H,Agnes A G.Cell culture propagation of porcine rotavirus(reovirus-like agent)[J].Am J Vet Res,1977,38(11):1765-1768.
[8]Bohl E H,Theil K W,Saif L J.Isolation and serotyping of porcine rotaviruses and antigenic comparison with other rotaviruses[J].J Clin Microbiol,1984,19(2):105-111.
[9]高运东,崔仁海,等.猪轮状病毒的分离及弱毒株的培育[J].山东农业科学,2002(3):41-42.
[10]Clark SM,Roth JR,Clark ML,et al.Trypsin enhancement of rotavirus infectivity:mechanism of enhancement[J].J Virol,1981,39(3):816-822.
[11]Yann Benureau,Jean Claude Huet,Annie Charpilienne,et al.Trypsin is associated with the rotavirus capsid and is activated by solubilization of outer capsid proteins[J].Journal of General Virology,2005,86:3143-3151.
[12]Crouch C F,Woode G N.Serial studies of virus multiplication and intestinal damage in gnotobiotic piglets infected with rotavirus[J].J Med Microbiol,1978,11(3):325-334.
[13]Narita M,Fukusho A,Konno S,et al.Intestinal changes in gnotobiotic piglets experimentally inoculated with porcine rotavirus[J].Natl Inst Anim Health Q (Tokyo),1982,22(2):54-60.
[14]Ciarlet M,Conner M E,Finegold M J,et al.Group A rotavirus infection and age-dependent diarrheal disease in rats:a new animal model to study the pathophysiology of rotavirus infection[J].J Virol,2002,76(1):41-57.
[15]Graham D Y,Estes M K.Pathogenesis and treatment of rotavirus diarrhea[J].Gastroenterology,1991,101(4):1140-1141.
[16]Saif L J,Ward L A,Yuan L,et al.The gnotobiotic piglet as a model for studies of disease pathogenesis and immunity to human rotaviruses[J].Arch Virol Suppl,1996,12:153-161.
Culture characteristics and pathogenicity of porcine rotavirus OSU strain
HUANG Xiao-bo,XU Lu,CAO San-jie,WEN Xin-tian
(Laboratory of Animal Infectious Disease and Microarray;Key Laboratory of Animal Disease and Human Health of Sichuan Province,College of Veterinary Medicine,Sichuan Agricultural University,Ya′an 625014,China)
Porcine rotavirus was cultured successfully in MA-104 cells.The virus was treated for 1h by trypsin on final concentration of 20μg/m L,and then inoculated in maintain medium with 4μg/m L trypsin.The cytopathic effects such as kytoplasm connecting,botryoidalis accretion and net-balloon were clearly observed.Double capsid virus was detected by electron microscope.Healthy 3-day-old colostrums-deprived piglets were inoculated orally with 1×10(6.8)TCID50of porcine rotavirus.Piglets developed watery diarrhea 10h post infection,and died in 42h post infection.During necropsy,milk curd in stomach,fluid in thin walled small intestines,and ectocolon were observed.During his to pathological examination,slight to moderate villous stunting were observed.Bulging and sloughing of villous epithelial cells were prominent.Neutrophils were clustered in the lamina propria at villous tips subjacent to disrupted epithelium.In severity segment of villous destruction,necrosis and sloughing of exposed lamina propria resulted in complete loss of villous strcture.
porcine rotavirus;cell culture,;experimental infection;pathogenicity
R373
A
1002-2694(2012)02-0120-04
*国家高技术研究发展计划(863计划)(2009AA10Z402);国家农
业部公益性行业(农业)科研(201203056);教育部《长江学者和创新团队发展计划》创新团队项目(IRTO848)联合资助
文心田,Email:xintian3211@126.com
四川农业大学动物医学院动物传染病与基因芯片实验室
动物疫病与人类健康四川省重点实验室,雅安 625014
2011-09-25;
2011-11-12
