肺炎嗜衣原体Cpn0797蛋白的生物信息学分析及其单克隆抗体制备鉴定*
2012-01-24陈超群吴移谋刘良专
陈超群,吴移谋,任 林,刘良专
肺炎嗜衣原体Cpn0797蛋白的生物信息学分析及其单克隆抗体制备鉴定*
陈超群1,吴移谋1,任 林2,刘良专1
目的生物信息学分析肺炎嗜衣原体Cpn0797蛋白的结构,制备特异性的抗Cpn0797蛋白的单克隆抗体。方法用ProtParam、SignalP、NPS@ 、和PSORT等软件对Cpn0797蛋白的理化参数、信号肽、二级结构、蛋白亚细胞定位进行分析;原核表达纯化GST-Cpn0797融合蛋白,以其为免疫原免疫BALB/c小鼠,杂交瘤技术制备单克隆抗体,采用间接免疫荧光法鉴定单克隆抗体的亚类和特异性。结果生物信息学分析表明Cpn0797蛋白二级结构以无规则卷曲为主;成功地建立了能稳定分泌抗Cpn0797蛋白的单克隆抗体杂交瘤细胞株,单克隆抗体能特异性的识别Cpn0797内源性蛋白。结论成功制备特异性的Cpn0797单克隆抗体,为进一步探究Cpn0797蛋白的生物学功能提供实验基础。
肺炎嗜衣原体;Cpn0797;生物信息学;单克隆抗体
肺炎嗜衣原体(Chlamy dophila pneumoniae,Cpn)是一种严格细胞内寄生、具有独特发育周期的病原微生物,其感染不仅可引起肺炎、支气管炎和咽炎等呼吸道疾病[1],而且还与动脉粥样硬化等心血管疾病密切相关[2-4]。病原菌和宿主相互作用过程中,衣原体可通过Ⅲ型分泌系统(T3SS)或其他分泌机制将本身的蛋白质穿过真核细胞膜或包涵体膜而进入宿主细胞质[5-8]或定位于包涵体膜上[9],进而影响宿主细胞正常的新陈代谢和功能;衣原体蛋白酶(体)样活性因子(chlamydial protease/proteasomelike activity factor,CPAF)[10-11]是首个被发现的衣原体分泌蛋白,被分泌至宿主细胞质内发挥着蛋白酶活性,降解宿主细胞的转录因子RFX5和上游刺激因子1(USF-1)而下调宿主细胞 MHC I、II类分子的表达水平,使衣原体逃避宿主的免疫识别;Cpn0796[5]、Cpn0797[12]、Cpn0809和 Cpn1020[7]等衣原体分泌蛋白陆续被发现,但是分泌蛋白在Cpn和宿主细胞的相互作用过程中所发挥的作用目前少见报道。
沙眼衣原体感染单核细胞后可通过激活NLRP3炎性复合体(inflammasome)而刺激caspase-1活化,进而导致促炎细胞因子IL-1β的成熟和分泌[13],其可能的分子机制是沙眼衣原体T3SS效应蛋白等衣原体分泌蛋白作为胞内危险信号分子促进细胞内K+外流、或导致细胞内活性氧(reactive oxygen species,ROS)水平升高,进而调控NLRP3炎性复合体的激活。Cpn感染也可通过激活NLRP3炎性复合体而促进IL-1β的分泌[14],Cpn分泌蛋白是否在其中发挥作用,尚不清楚。
本研究利用生物信息学分析Cpn0797蛋白的结构;利用基因重组技术表达Cpn0797融合蛋白,并且制备了特异性的单克隆抗体,为进一步认识Cpn0797等Cpn分泌蛋白在衣原体与宿主细胞的相互作用过程中的分子机制提供实验工具。
1 材料与方法
1.1 材料
1.1.1 菌株 Cpn标准株AR39由美国得克萨斯大学圣安东尼奥医学科学中心(UTHSCSA)钟光明教授实验室保存。
1.1.2 主要试剂 Glutathione Sepharose 4B纯化试剂购自Amersham Biosciences公司;弗氏完全佐剂、不完全佐剂,聚乙二醇(PEG),HAT和 HT选择性培养基为Sigma公司产品;兔抗Cpn抗体R12AR39由钟光明教授实验室制备并保存,Cy2-标记的羊抗兔Ig G、Cy3-标记的羊抗鼠IgG和Cy3-标记的羊抗鼠IgG 亚类抗体 (IgG1、IgG2a、IgG2b,IgG3)购自Jackson ImmunoResearch公司。
1.1.3 实验动物 BALB/c小鼠由 UTHSCSA实验动物部提供和饲养。
1.2 方法
1.2.1 一般生物信息学分析 利用ExPASy Proteomics tools (http://www.expasy.org/tools/)的ProtParam程序进行氨基酸序列组成、分子量、等电点等理化性质分析;用SignalP 3.0在线软件(http://www.cbs.dtu.dk/services/SignalP/)预测蛋白的信号肽;应用NPS@ 服务器 (http://npsapbil.ibcp.fr/)中的PHD 程序在线分析α螺旋、β转角、无规则卷曲及延伸链等;用PSORT软件(http://psort.hgc.jp/)中的 PSORT-B Prediction工具进行蛋白亚细胞定位预测。
1.2.2 GST-Cpn0797融合蛋白的表达与纯化 构建p GEX6p-2/cpn0797重组表达质粒,转化大肠杆菌XL1Blue,提取质粒测序鉴定。将鉴定后的单个阳性克隆菌落接种于20 m L含氨苄青霉素的TB液体培养基,37℃振荡过夜,次日按1%比例转种于400 m L含氨苄青霉素的TB液体培养基中,37℃振荡培养至OD600值达0.6~0.8时,加入IPTG至终浓度为200μmol/L,30℃诱导表达3 h后4℃7 000 r/min离心10 min收集菌体沉淀,将菌体重悬于预冷的含蛋白酶抑制剂的20 m L裂解缓冲液,4℃超声裂菌后,低温高速离心20 min,取上清与PBS预平衡的Glutathione Sepharose 4B Beads在室温转动吸附1 h,低速离心弃上清,经0.25%PBST和PBS洗涤后得到纯化的融合蛋白,分装保存。取10μL纯化的产物进行SDS-PAGE分析。
1.2.3 动物免疫和细胞融合 将纯化的GSTCpn0797融合蛋白与等体积弗氏完全佐剂超声乳化后,腹腔注射免疫6w龄BALB/c小鼠,初次免疫14 d后,每隔10 d用融合蛋白弗氏不完全佐剂加强免疫3次,第4次免疫7 d后,小鼠尾静脉采血,分离血清获得多克隆抗体,间接免疫荧光法(IFA)检测免疫效果;将不加佐剂的GST-Cpn0797融合蛋白腹腔注射进行冲击免疫,3 d后断颈法处死小鼠,无菌分离脾细胞。将免疫脾细胞与SP2/0细胞按10∶1比例混合,1 500 r/min离心5 min后弃上清,沉淀细胞在50%的PEG作用下于37℃进行细胞融合,融合后细胞悬浮于20%胎牛血清-HAT-DMEM培养液中,按200μL/孔转移至96孔细胞培养板,37℃、5%CO2培养箱培养,3 w左右观察克隆的形成,将克隆细胞转移至24孔细胞培养板进行扩大培养。
1.2.4 阳性克隆的筛选及克隆化 应用IFA筛选阳性克隆,Cpn标准株AR39感染HeLa细胞90h后,采用4%多聚甲醛(PF)室温固定1 h,2%皂角苷(Saponine)室温作用1h进行打孔处理,PBS洗涤后用含10%FBS的DMEM室温封闭,一抗用兔抗Cpn抗体R12AR39、杂交瘤细胞培养上清双染色,37℃孵育1 h;充分洗涤后加入二抗,二抗采用Cy2标记的羊抗兔IgG和Cy3标记的羊抗鼠IgG,Hoechst标记细胞核,37℃孵育1 h后充分洗涤,从24孔细胞培养板中取出盖玻片置于载玻片上,封闭液固定后荧光显微镜观察结果。应用有限稀释法对阳性克隆连续亚克隆,并进行放大培养,收集细胞培养上清,低温保存。
1.2.5 Ig类别及亚类的鉴定 应用IFA进行Ig类别及亚类的鉴定,方法同前,不同之处在于以Cy3标记的羊抗鼠IgG1、Ig G2a、IgG2b、IgG3抗体为二抗进行免疫荧光染色。
1.2.6 m Ab特异性的鉴定 用原核表达纯化的GST-Cpn0797、GST-Cpn0796N融合蛋白分别与细胞培养上清在室温转动吸附1h,离心收集上清后,应用IFA进一步观察经吸附后的细胞培养上清的染色情况。
2 结 果
2.1 Cpn0797蛋白一般生物学特征 ProtParam分析显示Cpn0797蛋白由365个氨基酸残基组成,分子式为C1697H2650N468O537S7,理论分子量为38.4 k Da,理论等电点(p I)为5.56;酸性氨基酸残基总数(Asp+Glu)为43,碱性氨基酸残基总数(Arg+Lys)为32;不稳定系数(instability index,Ⅱ)为26.93,表明此蛋白性质稳定;其亲疏水性平均值(Grand average of hydropathicity,GRAVY)为-0.112,表明其为亲水性蛋白。应用SignalP 3.0在线软件分析蛋白的信号肽,结果表明N端含有23个氨基酸的信号肽序列,见图1。

图1 SignalP-NN对Cpn0797信号肽的预测Fig.1 The signal peptide prediction of Cpn0797 by SignalP-NN
通过PSORT软件分析未能成功地预测Cpn0797蛋白在细胞内的定位。
应用NPS@ 服务器中的PHD程序在线分析Cpn0797蛋白的二级结构,提示其二级结构由6.58%α-螺旋(Alpha helix,Hh)、37.81%延伸链(Extended strand,Ee)、55.62%无规则卷曲(Random coil,Cc)构成,见图2。α-螺旋位于氨基酸序列的氨基端;该蛋白不易形成β-转角。

图2 Cpn0797蛋白的二级结构预测Fig.2 Secondary structure prediction of Cpn0797 Note:h:Alpha helix;e:Extended strand;c:Random coil
2.2 GST-Cpn0797融合蛋白的表达与纯化
pGEX6p-2/cpn0797阳性克隆菌经IPTG诱导后,采用Glutathione Sepharose 4B纯化试剂纯化目的蛋白,得到可溶性的融合蛋白,经SDS-PAGE检测显示在相对分子质量50 k Da与90 k Da处可见一清晰蛋白条带,与预测融合蛋白分子量基本相符(GST相对分子质量为26 k Da,Cpn0797相对分子质量约38.4 k Da)。
2.3 分泌抗Cpn0797蛋白m Ab的杂交瘤细胞的建立 以纯化的GST-Cpn0797融合蛋白免疫BALB/c小鼠,经杂交瘤技术建立杂交瘤细胞株,以Cpn感染细胞后所表达的内源性蛋白为抗原借助IFA鉴定阳性杂交瘤细胞克隆,共获得2株分泌抗Cpn0797蛋白m Ab的杂交瘤细胞。杂交瘤细胞液氮冻存、复苏后,仍然可稳定分泌m Ab。
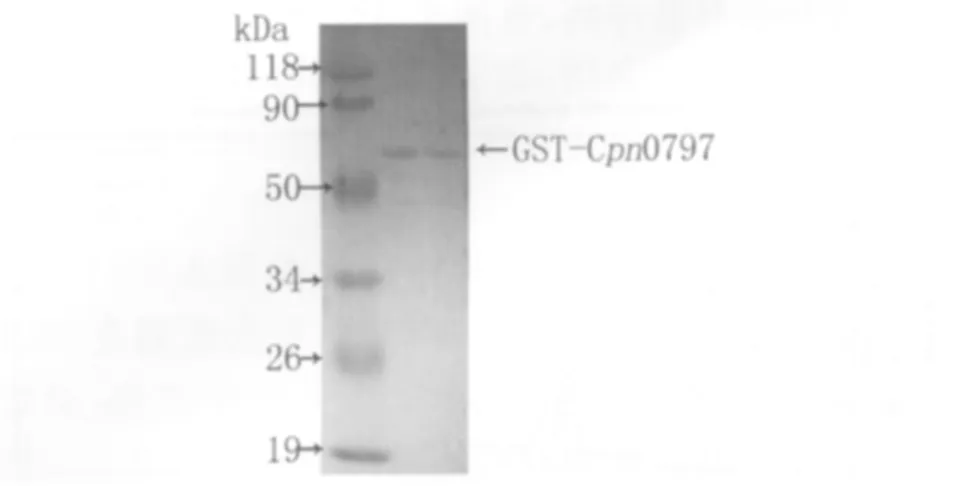
图3 GST-Cpn0797融合蛋白纯化产物的SDS-PAGE分析Fig.3 SDS-PAGE analysis of purified GST-Cpn0797 fusion protein Note:1.Protein marker;2,3.purified GSTCpn0797 fusion protein(64k Da)
2.4 抗Cpn0797蛋白m Ab的亚类鉴定 IFA检测抗Cpn0797单克隆抗体的亚类,结果表明2株m Ab均为IgG2a。
2.5 IFA鉴定抗Cpn0797蛋白m Ab的特异性IFA结果显示:抗Cpn0797蛋白m Ab与GSTCpn0797融合蛋白吸附后不能识别Cpn0797内源性蛋白,细胞质特异性染色消失(图4B),而与非特异性GST-Cpn0796N融合蛋白吸附后,未发现有交叉反应,仍然可见GST-Cpn0797抗体的细胞质染色特征(图4C)。

图4 间接免疫荧光法检测mAb的特异性Fig.4 Detection of the specificity of mAb by using an indirect immuno fluorescence assay Note:C.pneumoniae-infected HeLa cells were processed for immunostaining with m Ab visualized with a goat antimouse IgG conjugated with Cy3(red).A rabbit anti-chlamydia organisms antiserum plus Cy2-conjugated goat anti-rabbit IgG(green)was used to visualize the C.pneumoniae,and the DNA Hoechst stain(blue).The m Ab anti-Cpn0797 detected strong cytosolic signals(A).The cytosolic signals detected by the anti-Cpn0797 m Ab was removed by preabsorption of m Ab with the GST-Cpn0797 fusion protein(B)but not GST-Cpn0796N fusion protein(C)
3 讨 论
在感染宿主细胞过程中,衣原体借助原体(EB)附着于易感细胞表面,通过胞吞作用进入细胞内形成包涵体,在包涵体内完成EB→RB(网状体)→EB的独特发育周期。在发育周期过程中根据衣原体蛋白在包涵体上的分布情形,可将衣原体蛋白区分为几种类型:包涵体蛋白,分布于EB和/或RB上;包涵体膜蛋白(inclusion membrane protein,Inc蛋白),借助T3SS或其他分泌机制而分布于包涵体膜上;分泌蛋白,借助T3SS或其他分泌机制而分布于宿主细胞质。分泌蛋白CPAF在衣原体各种之间均有其同源蛋白[15];Cpn0796、Cpn0797蛋白是 Cpn的特异性蛋白,在衣原体其他种内未发现同源蛋白,Cpn0796通过自主转运蛋白系统(autotransporter)将其氨基端(Cpn0796N)分泌至宿主细胞质[5],Cpn0797蛋白与Cpn0796N具有一定的同源性,SignalP预测在其氨基端均具有信号肽序列,PSORT软件分析未能成功地预测Cpn0797蛋白在细胞内的定位,预测概率不是100%,所以关于Cpn0797蛋白在Cpn感染细胞内的定位,需要实验进一步验证。董峰[12]等已证实Cpn0797蛋白是Cpn的分泌蛋白,根据Cpn0797蛋白与Cpn0796N蛋白结构的相似性,提示Cpn0797蛋白的分泌机制可能也是自主转运蛋白系统。
NPS@PHD程序分析Cpn0797蛋白的二级结构,无规则卷曲所占比例高达55.62%,提示可能具有多个抗原表位。本研究利用基因重组技术表达了可溶性GST-Cpn0797融合蛋白,为抗体的制备提供了抗原;因GST基因与衣原体基因没有同源性,以衣原体感染细胞后所表达的内源性蛋白为抗原筛选单克隆抗体,能消除针对GST抗原的单克隆抗体杂交瘤细胞株的干扰,较好地筛选到针对于衣原体自身蛋白抗原的杂交瘤细胞株。
Cpn0797蛋白单克隆抗体特异性的分析:用原核表达纯化的GST-Cpn0797融合蛋白与细胞培养上清孵育吸附后,IFA染色检测Cpn感染细胞细胞质染色消失,用GST-Cpn0796N融合蛋白吸附后仍然可见细胞质染色特征,这符合Cpn0797蛋白在Cpn感染细胞内的定位分布[11],进一步说明该抗体是针对Cpn0797蛋白特异性表位的特异性m Ab。本研究制备的抗Cpn0797蛋白特异性的m Ab,为后续认识Cpn0797等分泌蛋白在衣原体与宿主细胞之间的相互作用过程中的机制提供了有力的实验工具。
(本研究部分实验在美国UTHSCSA钟光明教授实验室完成,感谢钟教授的实验指导和帮助)。
[1]Blasi F,Tarsia P,Aliberti S.Chlamydophila pneumoniae[J].Clin Microbiol Infect,2009,15(1):29-35.
[2]Campbell LA,Kuo CC.Chlamydia pneumoniae-an infectious risk factor for atherosclerosis[J].Nat Rev Microbiol,2004,2(1):23-32.
[3]梅春丽,何平,成蓓,等.肺炎衣原体通过下调ABCA1和ABCG1诱导THP-1源性泡沫细胞形成[J].中国免疫学杂志,2009,25(2):108-113.
[4]Sessa R,Nicoletti M,Di Pietro M,et al.Chlamydia pneumoniae and atherosclerosis:current state and future prospectives[J].Int J Immunopathol Pharmacol,2009,22(1):9-14.
[5]Vandahl B,Stensballe A,Roepstorff P,et al.Secretion of Cpn0796 from Chlamydia pneumoniae into the host cell cytoplasm by an autotransporter mechanism[J].Cell Microbiol,2005,7(6):825-836.
[6]Peters J,Wilson DP,Myers G,et al.Type III secretion a`la Chlamydia[J].Trends Microbiol,2007,15(6):241-251.
[7]Kleba B,Stephens RS.Chlamydial effector proteins localized to the host cell cytoplasmic compartment[J].Infect Immun,2008,76(11):4842-4850.
[8]Beeckman DS,Vanrompay DC.Bacterial secretion systems with an emphasis on the chlamydial Type III secretion system[J].Curr Issues Mol Biol,2010,12(1):17-41.
[9]Cortes C,Rzomp KA,Tvinnereim A,et al.Chlamydia pneumoniae inclusion membrane protein Cpn0585 interacts with multiple Rab GTPases[J].Infect Immun,2007,75(12):5586-5596.
[10]Fan P,Dong F,Huang Y,et al.Chlamydia pneumoniae secretion of a protease-like activity factor for degrading host cell transcription factors required for major histocompatibility complex antigen expression[J].Infect Immun,2002,70(1):345-349.
[11]牛玉宏,董峰,史剑慧,等.肺炎衣原体蛋白酶样活性因子在急性感染期的表达和分泌[J].中华微生物学和免疫学杂志,2004,24(4):272-274.
[12]Dong F,Flores R,Chen D,et al.Localization of the hypothetical protein Cpn0797 in the cytoplasm of Chlamydia pneumoniae-infected host cells[J].Infect Immun,2006,74(11):6479-6486.
[13]Abdul-Sater AA,Saïd-Sadier N,Padilla EV,et al.Chlamydial infection of monocytes stimulates IL-1βsecretion through activation of the NLRP3 inflammasome[J].Microbes Infect,2010,12(8/9):652-661.
[14]He X,Mekasha S,Mavrogiorgos N,et al.Inflammation and fibrosis during Chlamydia pneumoniae infection is regulated by IL-1 and the NLRP3/ASC inflammasome[J].J Immunol,2010,184(10):5743-5754.
[15]Dong F,Zhong Y,Arulanandam B,et al.Production of a proteolytically active protein,chlamydial protease/proteasome-like activity factor,by five different Chlamydia species[J].Infect Immun,2005,73(3):1868-1872.
Bioin formatic analysis of Chlamydo phila pneumoniae Cpn0797 protein and the preparation of its monoclonal antibody
CHEN Chao-qun,WU Yi-mou,REN Lin,LIU Liang-zhuan
(Department of Microbiology and Immunology,Institute of Pathogenic Biology,School of Medicine,University of South China,Hengyang 421001,China)
In order to analyze the protein structure of Chlamydophila pneumoniae Cpn 0797 protein and to prepare specific monoclonal antibodies(m Ab)against Cpn0797 protein,ProtParam,SignalP,NPS@and PSORT software packages were used to predict the physical and chemical properties,signal peptide,secondary structure and protein localization sites in cells according to the amino acid sequence of Cpn0797.The gene cpn0797 was cloned into the prokaryotic expression vector p GEX6p-2,and expressed in E.coli and then purified.The m Abs against Cpn0797 were prepared with the hybridoma technique after mice were immunized with purified GST-Cpn0797 fusion protein.The isotype and specificities of the m Abs were determined by indirect immuno fluorescence assay(IFA).The bioin formatical analysis results showed that Cpn0797 protein mainly consisted of random coils.Hybridoma cell lines stably secreting m Abs against Cpn0797 protein are obtained.The m Abs reacted with Cpn0797 endogenous protein.In conclusion,the specific m Abs against Cpn0797 protein were obtained,which provides a basis for further study in the biological function of Cpn0797 protein.
Chlamydophila pneumoniae;Cpn0797;bioinformatics;monoclonal antibody
R374+.3
A
1002-2694(2012)02-0103-05
*国家自然科学基金 (No.81072417)和湖南省卫生厅科研课题(B2007093)联合资助
吴移谋,Email:yimouwu@sina.com
1.南华大学医学院微生物学与免疫学教研室,病原生物学研究所,衡阳 421001;2.南华大学附属第一医院,衡阳 421001
2011-09-14;
2011-11-16
