急性胰腺炎的CT表现及其扩散途径的解剖基础
2012-01-24覃志龙
覃志龙
广西大化县人民医院放射科 530800
急性胰腺炎(acute pancreatitis,AP)是常见的急腹症之一。按病理分类可分为水肿性和出血坏死性两类[1]。但两者并无截然分界线,而且两者并不一定是一个病的两个发展阶段。AP临床表现和预后差别很大,仅根据临床症状和实验室检查可遗漏。CT扫描不仅可显示胰腺本身改变,还能显示AP的扩散途径。据廖家智摘译的美国急性胰腺炎临床诊断指南,如果患者具备急性胰腺炎特征性的腹痛,血清淀粉酶水平高于正常值上限3倍,必须行CT检查以确诊急性胰腺炎[2]。因此CT扫描是确诊AP的必不可少的检查方法。熟悉并掌握AP的CT表现及腹部相应的解剖结构至关重要。本文对我院2004年7月-2011年4月经临床证实、资料完整的94例AP患者的CT扫描资料进行回顾性分析,现报道如下。
1 资料与方法
1.1 一般资料 收集2004年7月-2011年4月期间,我院收治的经临床证实并行螺旋CT扫描的AP患者共94例,其中男65例,女29例,年龄16~81岁,平均年龄50.3岁。所有患者临床均表现为上腹部持续性疼痛及发热,有40例向背部放射性疼痛,71例有恶心、呕吐等胃肠道症状,7例出现低血压和休克。实验室检查除白细胞计数升高外,91例血、尿淀粉酶明显升高。伴有胆道疾病者51例,有明确酗酒及暴饮暴食病史者32例,无明显病因者11例。94例患者中,79例行保守治疗治愈或好转出院,9例经手术治疗并治愈,死亡4例,病情危重放弃治疗2例。
1.2 检查方法 采用飞利浦公司的PHILIPS PMX8000 4层螺旋CT扫描机,运用容积式扫描。扫描范围:由于胰腺炎极易向周围扩散,以胰腺为中心,扫描范围比较广泛,从下胸部(肺静脉平面)至盆底区域。常规扫描层厚和层距10mm,胰腺区域采用层厚和层距5mm;必要时行CT增强扫描,选用非离子型造影剂,使用Nemoto A-60型程控高压注射器,经前臂静脉注入,注射速度为2~3ml/s(60岁以上及病情危重者采用2ml/s,其余采用3ml/s),总剂量为80~100ml。照相窗宽为350~420Hu,窗位30~50Hu。
1.3 图像分析及观察指标 由2位高年资的腹部影像诊断医生共同分析患者CT图像,意见分歧时通过讨论达成共识。观察内容包括:胰腺局部改变、炎症扩散累及范围及并发症的CT表现。
1.4 CT分级标准 所有患者的CT影像学表现按Balthazar分级标准(见表1)进行统计[3]。
2 结果
94例中36例(38.3%)经CT诊断为急性水肿性胰腺炎,其中2例(5.6%)属A级,胰腺无明显异常;21例(58.3%)属B级或C级,其中2例呈局限性胰头增大,3例胰体增大,2例呈局限性胰尾增大,其余均为弥漫性增大;13例(36.1%)为D级,8例伴有少量胸水。死亡1例(2.8%)。急性出血坏死性胰腺炎58例,占总数的61.7%,其中有16例(27.6%)属D级,42例(72.4%)属E级。58例均有不同程度胰外液体贮留,大部分累及双肾前间隙及伴有吉氏筋膜增厚;胰周间隙渗出及积液33例,8例并发胰周脓肿,25例假囊肿形成。死亡3例占5.2%(1例继发感染,2例死于多器官功能衰竭)。

表1 Balthazar分级
3 讨论
3.1 AP的病因及发病机制 AP的病因甚多,常见的病因有胆石症、大量饮酒和暴饮暴食,其他原因包括胰管和十二指肠疾患、外伤、手术损伤、继发感染、某些药物以及内分泌代谢异常。AP的发病机制较为复杂,目前比较趋于一致的认识是胰腺管道系统暂时或永久性阻塞,胰液渗漏到胰腺的间质组织而引发自溶,胰腺自身消化,以致大量坏死组织进入周围血管形成血栓,引起微循环障碍,组织缺血、缺氧及坏死[4]。胰酶的释放外渗,它的溶组织作用,除可使胰腺及胰周受累并可超出胰腺及胰周,向胰外区域扩散,甚至可以达到距胰腺很远的区域[5]。
3.2 AP的CT表现及其扩散途径的解剖基础
3.2.1 胰腺局部改变:单纯水肿性胰腺炎CT表现为胰腺正常和胰腺局限性或弥漫性增大,以弥漫性增大多见,密度可正常或轻度减低,均匀或不均匀,反映水肿的程度,胰腺轮廓清楚,炎症渗出明显可出现轮廓不清,CT增强扫描胰腺均匀强化,无坏死区(图1)。而急性出血坏死性胰腺炎CT扫描表现为胰腺体积明显增大,常为弥漫性,轮廓不规则。胰腺体积增大的程度一般与临床严重程度成正比。当胰腺体积指数(胰头、胰体最大前后径的乘积)≥10cm2时,77%为重症胰腺炎[6]。因胰腺水肿、出血、坏死密度呈不均匀。胰腺的炎性水肿和坏死CT平扫均表现为胰腺的低密度影,呈点状、斑片状、大片状。AP时,胰腺包膜水肿、增厚,当胰腺发生坏死或炎性渗液在包膜下形成胰内积液,导致胰腺包膜被掀起,厚约1mm,规则,由于胰头无明显包膜,所以多见于胰腺体尾部之前面[7](图2);坏死常累及胰腺体、尾部,很少累及胰腺头部,因为后者有丰富的侧支循环;胰腺出血则表现为高密度,多为胰腺实质或包膜下的小片状散在分布的高密度影,广泛出血时胰腺密度普遍升高,CT值50~70Hu。CT增强扫描可以准确显示胰腺实质内的水肿、出血及坏死灶,胰腺炎性水肿可以为均匀密度的强化,但强化程度较正常有所下降[7],坏死表现为动脉期、门静脉期和实质期持续存在的无强化、不规则形低密度液化区,与周围正常强化的胰腺组织形成明显的密度差(图3)。有时,坏死区域可以累及整个胰腺,形成一个外形与胰腺一样的低密度“水袋”,并伴有可强化的包膜[8](图4)。由此可见,CT增强扫描在诊断急性坏死性胰腺炎中具有十分重要的价值。

图1 胰周少量渗出
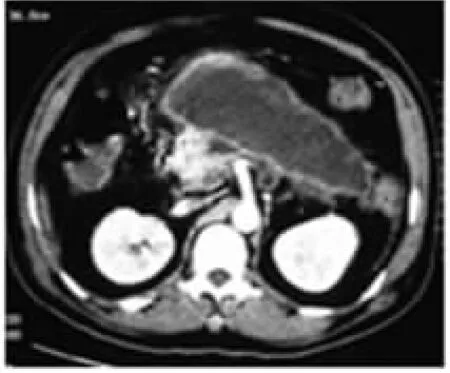
图2 胰腺包膜下积液
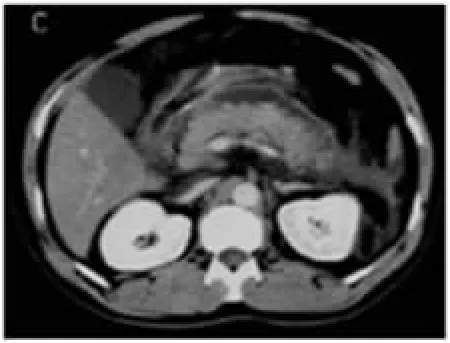
图3 胰尾部坏死并胰周积液

图4 胰腺坏死,胰腺包膜强化
胰腺坏死一般在发病2~3d内即可通过CT增强扫描明确其坏死范围。此后,在多数情况下(特别是在积极、有效的治疗时)胰腺坏死灶一般不会进一步发展或扩大。胰腺实质内的多数小坏死灶可自行吸收,少数残留一些含脂肪成分的瘢痕组织。但由于较大的胰腺实质坏死灶常常伴有主胰管或其分支的断裂,在外渗胰液的炎性刺激下,可在坏死区或相邻区域形成假性囊肿。
应该注意的是,CT扫描中的发现与临床表现和检验室检查结果不一定相对应。因为约1/3的AP,其CT扫描中胰腺的异常表现非常明显,但其血清淀粉酶可以正常。另一方面,急性胰腺炎Balthazar分级的A级,其CT表现又可以是无异常表现的。
3.2.2 胰腺周围改变:胰腺位于腹膜后肾旁前间隙内,其周围缺乏坚固、完整的纤维包膜,胰腺发生炎症时,胰液容易超出胰腺范围,引起胰腺周围改变,如胰腺周围水肿、积液、蜂窝组织炎、脓肿等改变。胰腺周围水肿是较早且十分常见的CT表现。主要表现为肾旁前间隙内原脂肪组织密度增高,间隙因水肿而范围扩大,水肿区可为局部,但多数为弥漫性,即水肿的范围甚宽、大,水肿区内密度不大均匀,也可有斑片状表现(图5)。水肿和积液都可在病变区内显示少许纤细的间隔,是由纤维组织或其他解剖结构所致。积液区域的密度较均匀。水肿和积液,病变部位的CT值都接近于水。胰周水肿、积液常为一过性的,积液常未很好包裹,这不同于假性囊肿。
AP所致的蜂窝组织炎是一个很常见的CT表现(图6)。1973年Kune等描述AP的蜂窝组织炎改变,在病理上界定为:“由水肿、炎症细胞浸润及组织坏死使胰腺及其相邻的腹膜后间隙组织变硬所形成的实性肿块”。因此它包含有水肿的成分。它既可发展成脓肿也可完全吸收。蜂窝组织炎在腹膜后的扩散就如同胰周积液的扩散一样,可累及较宽范围。蜂窝组织炎与积液的区别在于以下几点:(1)CT值大于低密度的积液(它是一个炎性肿块);(2)密度可以不均匀,这主要是由于蜂窝组织炎包含有坏死组织、已破碎的腹膜后脂肪和出血等的缘故;(3)蜂窝组织炎的变化较慢甚至可发展成脓肿,而积液常为暂时性的[5]。
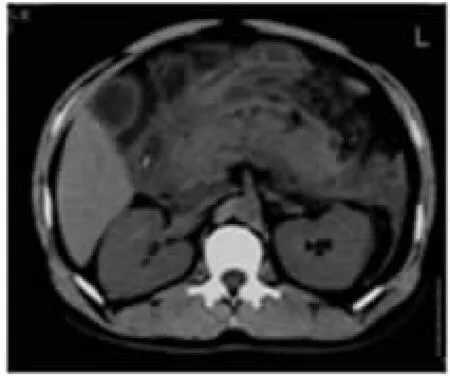
图5 胰周水肿及积液,左侧肾前筋膜增厚

图6 小网膜囊蜂窝组织炎
胰周蜂窝组织炎,约75%可以随AP的好转而逐渐吸收、消散,但若未很好控制,在病程2~3周可进入到化脓阶段,3~5周即可形成脓肿。当然,胰腺及胰周积液并发感染,不经过蜂窝组织炎阶段,也可发展成脓肿。胰腺脓肿可发生于胰内和胰外,是由于胰腺内、外积液,坏死的组织和蜂窝组织炎继发感染后形成。CT扫描脓肿表现为一个不太均匀的积液或肿块,有不太清晰、完整的边界(即脓肿壁),比较可靠的征象为病灶区域出现气体,尤其是多个散在小气泡或气液平面,但脓肿表现气体阳性率低,在29%~64%[6]。因脓肿内容物为坏死组织,蛋白质含量高,故其CT值通常都高于一般无菌性的积液和假性囊肿内的液体。对于缺乏气体的脓肿,有时难以与局部性的蜂窝组织炎和假性囊肿区别。它们区别要点在于:脓肿具有厚薄不太均匀,甚至不太完整的脓腔壁,增强扫描可出现轻微强化(图7),而假性囊肿的壁较薄且较均匀一致。当临床有感染征象、CT表现不典型时可在CT定位下经皮细针穿刺进行细菌学检查。
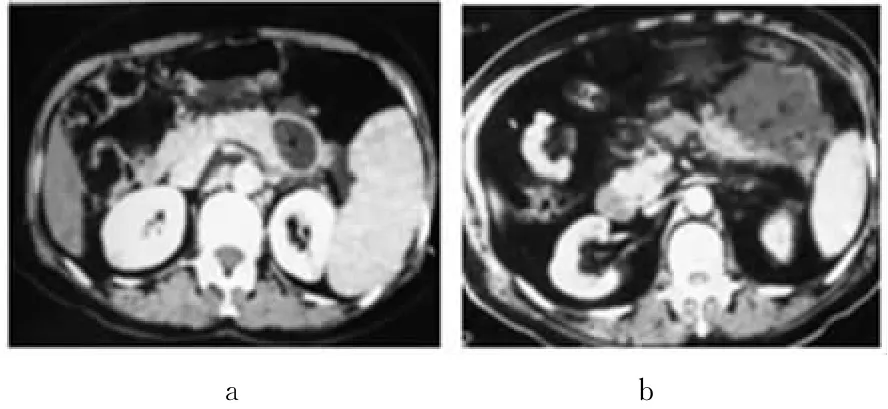
图7 胰腺脓肿a.胰尾部脓 b.腹腔脓肿
3.2.3 AP腹膜后间隙扩散改变:腹膜后间隙是以壁层腹膜为前界,腹横筋膜为后界,上起横膈,下达盆腔的立体间隙。以肾筋膜为主要标志将其分为肾旁前间隙、肾周间隙和肾旁后间隙。肾旁前间隙两侧潜在相通,头尾方向范围很宽广,含有较多的脂肪组织及少量结缔组织,并有十二指肠、结肠的腹膜后部分。AP在腹膜后间隙的扩散主要包括2种途径[9]:(1)沿同一解剖间隙或相通间隙扩散;(2)因胰酶破坏筋膜或病灶直接通过筋膜薄弱处(如血管、神经穿行处)而导致跨筋膜扩散。因此,胰腺发生炎症时,很容易渗透到肾旁前间隙,同时还可以扩散至肾周间隙及肾旁后间隙,甚至纵隔、盆腔等。
AP最常侵入小网膜囊。网膜囊位于胰腺前方,与胰腺只隔一层后腹膜,由于胰腺分泌的高侵袭性液体可突破后腹膜进入网膜囊,造成网膜囊受侵、积液(图8)。
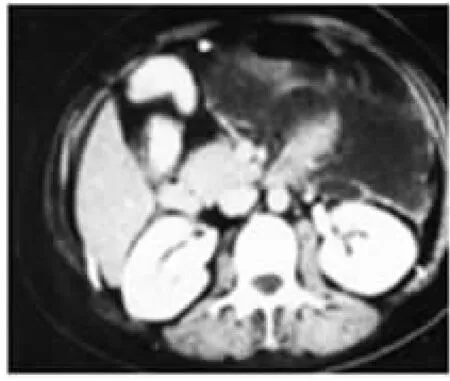
图8 小网膜囊积液

图9 胰腺坏死,胰周及肾旁间隙积液,肾旁筋膜增厚,肾后筋膜分两层
正常肾筋膜一般仅1~2mm厚,纤细均匀。AP时,因水肿、炎症浸润而使筋膜受到分割,因此,炎症可在肾筋膜内扩散而表现出筋膜增厚改变。肾前筋膜增厚是胰腺炎的重要标志,尤其是在胰腺本身的改变不明显时,即可出现肾前筋膜的增厚,但它并非AP的独有特征,也可见于其他后腹膜病变[10]。左肾前筋膜增厚是常见的表现。由于胰酶的破坏与溶组织作用,炎性的胰液很容易先波及到肾前筋膜,然后沿肾筋膜扩散至肾后筋膜和锥侧筋膜,使其增厚。同时,胰酶的破坏使得肾筋膜间的炎症水肿或积液突破肾前或肾后筋膜从而浸润肾旁前间隙、肾周间隙及肾旁后间隙。据Raptopoulos等研究,肾后筋膜分为前后两层,前层与肾前筋膜延续,后层与锥侧筋膜相续,AP产生的肾旁前间隙积液很容易破坏肾前筋膜与锥侧筋膜间菲薄的纤维间隔,进入肾后筋膜两层之间,导致肾后筋膜两层间的积液(图9)。肾旁前间隙的积液可通过以下3条途径进入肾旁后间隙[9]:(1)积液向后先进入肾后筋膜两层之间,再通过肾后筋膜后层或锥侧筋膜的破口处进入肾旁后间隙,该破口的形成主要与胰酶的破坏作用有关;(2)肾后筋膜间的积液沿着肾旁后间隙内的脂肪间纤维隔进入;(3)肾旁前间隙的积液量多时,可先向下进入肾圆锥下方,随后反折而向上达肾旁后间隙。肾旁后间隙的受累被认为能在一定程度上反映AP的严重程度,可作为一种排除急性轻症胰腺炎的简单可靠方法。肾周间隙的桥隔与肾前、后筋膜或肾筋膜间平面相通连。AP的炎性胰液先渗透到肾周及肾筋膜间平面,随后,肾筋膜间平面的炎性水肿或积液通过桥隔扩散至肾周间隙。AP在肾周间隙内的扩散表现为肾周积液、纤维桥隔增厚以及脂肪组织内的片状影(图10)。由于肾后筋膜的内侧只融合于腰方肌筋膜,并不融合于腰大肌筋膜[10],因此肾或肾周间隙内的炎症可直接侵犯腰大肌(图11)。

图10 胰周、肾周间隙及肝肾隐窝积液

图11 右侧腰大肌及骶棘 肌脓肿
3.2.4 AP的常见并发症:AP最常见的并发症是假性囊肿和脓肿形成。有学者将胰腺出血、坏死也归入常见并发症,但笔者认为它是AP的不同发展阶段,因此未将其列入并发症加以讨论。假性囊肿是指AP发生后所形成的包括坏死组织,陈旧血液和分泌物积聚的囊性病变,它可以存在于胰腺内,也可以存在于胰腺周围或较远一些的腹膜后间隙的间质组织内,可以局限于某一部位,但也可向腹后间隙的不同方向扩散达到不同部位。假性囊肿的壁最初由它扩展推压的组织结构组成,继后逐渐有由它所引起的炎性反应所致的肉芽及纤维组织形成的壁将其包绕,因此有一个比较完整的壁,此时可以认为是一个成熟的假性囊肿。假性囊肿一般于AP 4周以后才能形成,约20%~44%的假性囊肿在6周内消散,6周后有较坚实的包膜形成,进一步吸收的机会减少,持续12周以上则不能自发吸收,需进行外科手术或介入手术处理。若采取非手术性治疗,其合并症发生率及病死率均较高。CT扫描中,无感染的假性囊肿表现为胰内或胰外的壁薄而光滑的水样密度占位,可推挤邻近脏器移位,增强扫描无强化,合并出血或坏死组织较多时,其内在密度不均匀,呈混合性结构(图12),容易误诊为囊腺性肿瘤或脓肿。脓肿是AP病程晚期危险的合并症,死亡率高,约有10%的AP合并感染发生脓肿[11]。发生于胰内或胰外扩散部位的脓肿的CT表现与发生于胰周的脓肿基本相同。前已叙述过,此处从略。胰腺脓肿的病死率较高,据报道达40%。要求早期明确定位及定性诊断,及时进行引流处理。定性诊断有困难时需结合临床或进行穿刺以确诊。
3.2.5 AP的少见并发症:除假性囊肿和脓肿常见并发症外,AP还可出现如下不常见并发症:(1)胰瘘:假性囊肿可自溃或手术使它与胃肠道或体外相通引流,形成胰瘘。与体外相通表现为腹壁缺损,结合局部体检可以诊断;与胃肠道相通时,在胰周出现较长大的气液面或较大量的积气(图13)。故胰及胰周大量积气或长大的气液面,除脓肿以外还存在着假性囊肿或积液与胃肠道相通的可能性。(2)血管并发症:在西方国家,AP的血管并发症较常见,但国人相对较少。这可能与对它的认识不够有一定关系。小血管的糜烂(erosion)可导致出血性胰腺炎,但大血管破裂可发展成假性动脉瘤或血管闭塞,脾、胃十二指肠和肝动脉均可能受累。AP也可使相邻的静脉系统受到影响,主要是脾静脉和门静脉,导致门静脉系统血管闭塞和静脉血栓形成,随后出现其属支的扩张。在CT增强扫描中可以显示。本组资料中只有4例出现脾静脉扩张(图14),未见有其他血管并发症。若拟手术治疗,术前常需另作血管造影或DSA。(3)胆囊出血:是因急性胰腺炎影响门静脉系统,导致门静脉系统血管闭塞和血栓形成,门静脉系统压力增高,以致胆囊静脉回流受阻而引起胆囊出血,可归为血管并发症,但其表现与胆囊结石相似,容易漏诊或误诊,在此单独提出引起注意(图15)。
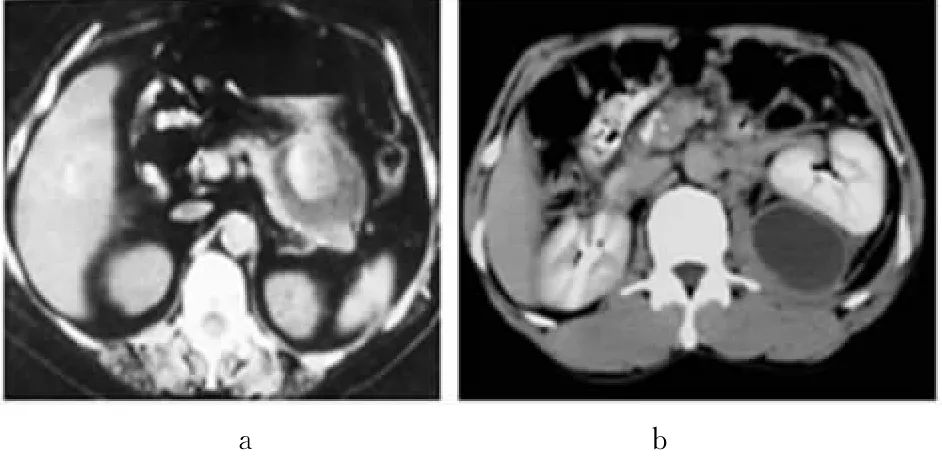
图12 无感染的假性囊肿表现a.假性囊肿合并出血 b.左侧肾周间隙假性囊肿

图13 假性囊肿并发横结肠瘘

图14 脾静脉扩张

图15 同一病例入院前后状况a.入院前胆囊正常 b.4d后复查示胆囊出血
3.2.6 AP的其他伴有征象:AP除外造成上述改变外,亦可造成与胰腺毗邻或相距较远的脏器的继发性改变。这些器官和结构的改变,在AP早期多为对炎性物质(含胰酶的分泌物)刺激的反应性变化,如:(1)胃肠改变:AP水肿、炎症影响十二指肠及小肠产生麻痹性肠胀气、肠梗阻等,亦可影响相邻胃壁产生灶性胃壁增厚改变及CT征象,据报道其发生率可高达70%。但应注意与胃癌、淋巴瘤等区别。AP时,常并有其他胰腺及胰周改变,结合临床表现,综合考虑加以鉴别。(2)腹腔积液:AP向前扩散可累及后腹膜引起腹腔积液,腹膜增厚,也可由网膜囊积液经网膜孔而进入腹腔,引起腹腔积液。(3)胸腔积液:炎症通过淋巴引流从膈下到膈上至胸腔,通过食管主动脉裂孔进入纵隔、心包腔、胸腔,通过胰胸膜瘘进入胸腔[5],引起胸膜的增厚及下肺局限性膨胀不全、胸腔积液、心包积液等,胸腔积液以左侧更为常见,多数伴有两下肺局限性膨胀不全。随着病情的稳定和好转,上述改变逐步减轻或消散。在AP中晚期,有些器官和结构的改变会持续存在,甚至加重而演变成AP的并发症。由此可见,在AP的CT复查及术后随访中,这些伴有征象的出现、进展与消失是提示病情进展或好转的参考指标。
以上整个AP及其扩散的过程表明,AP的发生和发展与腹膜后间隙的解剖结构及它们之间的相关性,即它们之间的通连、分隔关系,存在着非常紧密的直接联系。AP的CT表现复杂而多样,CT对AP诊断特别要注意并发症,CT能对AP的定性定量诊断作出客观评价。要全面正确认识AP的CT表现,必须熟悉腹部相关结构的解剖基础及相互通连关系。另一方面,AP向腹膜后间隙及腹膜腔扩散,就像一个“指示剂”,让我们有机会准确、清楚的认识各潜在的腹膜后间隙。
[1] 吴在德,吴肇汉.外科学〔M〕.北京:人民卫生出版社,2007:602- 606.
[2] 廖家智,摘译.美国急性胰腺炎临床指南(诊断部分)〔J〕.临床内科杂志,2007,24(2):136-139.
[3] Balthazar EJ.Acute pancreatitis:assessment of severity with clinical and CT evaluations〔J〕.Radiology,2002,223(3):604-613.
[4] 樊建平.急性胰腺炎的CT诊断〔J〕.华西医学,2010,25(5):959-960.
[5] 闵鹏秋.急性胰腺炎病变及其扩散途径的CT表现〔J〕.中国医学计算机成像杂志,2002,8(4):238-242.
[6] 陈再智,王志,谭晔,等.急性胰腺炎严重度的多层螺旋CT评价-Balthazar CT评分与APACHEⅡ评分的相关性〔J〕.中华急诊医学杂志,2003,12(7):492-494.
[7] 周荣康.腹部CT〔M〕.上海:上海医科大学出版社,2000:105.
[8] 段承祥,王培军,李建丁,等.肝胆胰影像学〔M〕.上海:上海科技文献出版社,2004:213-227.
[9] 闵鹏秋,严志汉,杨恒远,等.急性胰腺炎累及肾旁后间隙的螺旋CT表现及其解剖基础〔J〕.中华放射学杂志,2005,39(4):379-382.
[10] 李果珍.临床CT诊断学〔M〕.北京:中国科学技术出版社,2001:462-463,550-554.
[11] 郭俊渊.现代腹部影像学〔M〕.北京:科学出版社,2001:817.
