UPA与VEGF在乳腺癌中的表达及意义
2012-01-20胡晓峰邢静王晓寅聂双发郭飞梁峰
胡晓峰 邢静 王晓寅 聂双发 郭飞 梁峰
近年来,乳腺癌在女性中的发病率呈逐年上升趋势,侵袭和转移是导致患者死亡主要原因,而肿瘤侵袭转移有赖于细胞外基质的降解及肿瘤血管形成。研究表明,尿激酶型纤溶酶原激活物(urokinase-type plasminogen cultivator,uPA)介导的纤维蛋白溶解作用及血管内皮生长因子(VEGF)介导的血管形成作用,都能促进乳腺癌的发生,发展及播散[1]。故本研究通过检测乳腺癌组织中uPA和VEGF蛋白的表达状况,以探讨二者在乳腺癌侵袭转移中的作用及关系。
1 材料与方法
1.1 标本来源 收集张家口市三所市级医院2006至2009年间经病理确诊的乳腺癌手术切除标本70例均为女性患者,年龄25~75岁,平均年龄48岁,均未接受术前化疗。
1.2 主要试剂 免疫组化试剂盒购自武汉博士德生物工程有限公司,DAB显色试剂盒,鼠抗人uPA单克隆抗体,鼠抗人VEGF单克隆抗体均购自北京中杉金桥生物技术有限公司。
1.3 方法 将存档的石蜡标本重新制备5 μm厚度切片进行免疫组化SP染色,操作步骤严格按照说明进行,阳性对照采用已知乳腺癌阳性组织切片,阴性对照用PBS代替Ⅰ抗。
1.4 结果判定 在光镜(×400)取10个视野平均阳性细胞数>10%为阳性病例,<10%为阴性病例。
1.5 统计学分析 计数资料采用χ2检验和四格列联表法,P<0.05为差异有统计学意义。
2 结果
VEGF和uPA在乳腺癌中的阳性率分别为68.57%(48/70)和60%(42/70)二者在乳腺癌中的阳性表达与年龄、病理类型及淋巴结转移情况的关系见表1。UPA与VEGF表达的关系见表2。
3 讨论
肿瘤的侵袭、转移是一个多步骤,多环节过程,其中细胞外基质及基底膜的破坏是肿瘤转移的重要前提[1]。UPA是一种丝氨酸蛋白水解酶,基因定位于 10q24,长度 6.5 kB[2]。UPA通过与uPAR特异性结合,而与受体结合的uPA又对纤溶酶原有很强的催化能力,使纤溶酶原活化成纤溶酶,从而非特异性地溶解基质中的多种成分如纤维蛋白,纤维连接蛋白,蛋白多糖,板层素等,促进肿瘤浸润转移[3]。血管生成是肿瘤生长转移的又一种重要因素,VEGF是一种能特异性地作用于血管内皮细胞的生长因子,具有促进新生血管形成和增强血管通透性的功能[4]。Mandriota 等[5,6]研究认为 VEGF-C 还可能介导淋巴管的形成。因此,uPA与VEGF的水平高低,可能直接影响着乳腺癌的预后。
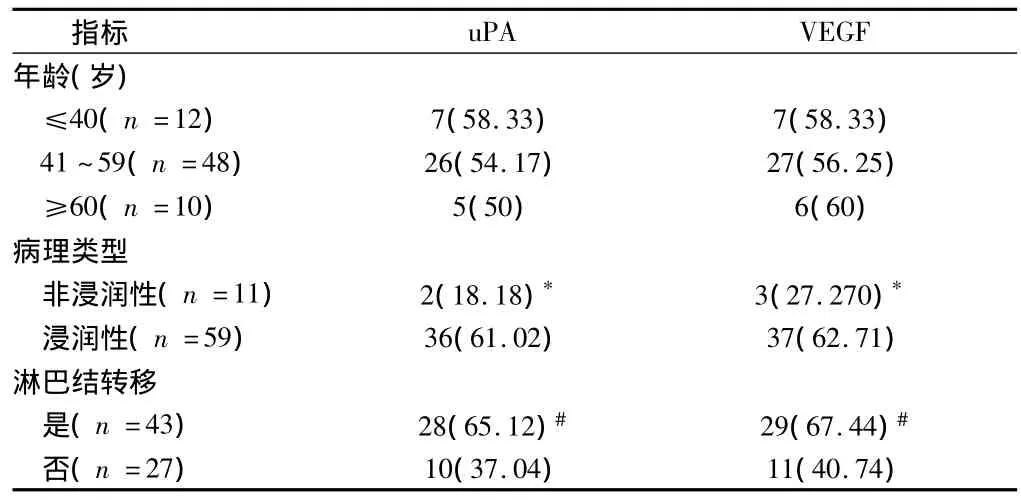
表1 UPA和VEGF在乳腺癌组织中的表达与乳腺癌生物学特性的关系 例(%)

表2 UPA与VEGF表达的关系 例
本实验结果显示uPA和VEGF均与乳腺癌组织病理类型和淋巴结转移状况有关,但均与年龄及肿瘤发生位置无关,其中uPA和VEGF在浸润性癌中的阳性率分别为61.02%和62.71%明显高于非浸润癌中的阳性率18.18%和27.27%,差异有统计学意义(P<0.05),并且他们在有淋巴结转移组中的阳性率也明显高于无淋巴结转移组,差异有统计学意义(P<0.05),提示uPA和VEGF均可促进肿瘤细胞浸润转移,与前人报道一致。另外提示对于uPA和/或VEGF阳性的乳腺癌患者即使无淋巴结转移也应扩大切除,并做好术后放化疗和定期检查工作。
另外,实验结果还显示40例VEGF阳性患者中uPA阳性者27例,阳性一致率为67.5%,30例VEGF阴性患者中uPA阴性者19例,阴性一致率为63.3%,总一致率为65.7%,提示uPA与VEGF表达有关,与本实验结果(r=0.3063)相一致。
UPA和VEGF是影响无病生存期和总生存期的独立预后因子,有报告认为高水平的EGFR、uPA等基因可能通过上调VEGF水平,在细胞外基质降解同时,促进肿瘤新生血管形成和癌细胞血管侵袭作用,这样通过两者各自的作用以及相互促进作用,最终可引起肿瘤进展和出现远处转移[7]。因此检测uPA和VEGF水平对于乳腺癌患者的预后及制定治疗方案有重大意义,另外近年国内外许多学者都在研制以uPA和VEGF为靶点的合成抑制剂[8-10]。相信不久会为人类的抗癌治疗开辟一条令人鼓舞的新途径。
1 程伟华,黎才海.uPA系统与肿瘤侵袭转移的关系.实用癌症杂志,2008,23:310-315.
2 Giannopoulou I,Mylona E,Kapranou A,et al.The prognostic value of the topographic distribution of uPAR expression in inva-sive breast carcinomas.Cancer Lett,2007,246:262-267.
3 沈倩雯,金冶宁.UPA系统在肿瘤患者中的检测意义及研究进展.现代肿瘤医学,2008,12:2207-2209.
4 张瑞鹏,郭平凡.血管内皮生长因子最新研究进展.医学综述,2008,14:2258-2260.
5 Mandriota SJ,Jussila L,Jeltsch M,et al.Vascular endothelial growth factor C-mediated lymphaugiogensis prmotes tumor metastasis.EMBO J,2001,20:672-682.
6 Jussila L,Alitalc K.Vascular growth factors and lymphangiogenesis.Physial Rev,2002,82:673-700.
7 丁佩剑,杨阳,王波,等.脂氧合酶-5及血管内皮生长因子在乳腺癌中的表达及临床意义.疑难病杂志,2011,10:278-281.
8 Gerber HP,Ferrara N.Phanuacology and pharmacodynamics of beacizumab as monotherapy or in ambination with cytotoxic therapy in preclinical studies.Cancer Res,2005,65:671-680.
9 黄金凤,何志明,李炜霞.乳腺癌组织uPA和nm23表达及其临床意义的研究.中华肿瘤防治杂志,2008,11:829-831.
10 丁友成,朱正纲.uPA合成抑制剂及其在肿瘤治疗中的研究进展.国外医学外科学分册,2004,31:8-11.
