Survivin基因启动子区-31C>G功能性多态与卵巢癌遗传易感性的关联研究
2012-01-20靳丽娟霍京丽张素花
靳丽娟 霍京丽 张素花
卵巢癌是妇科三大恶性肿瘤之一,因其起病隐匿,恶性程度高,多数患者就诊时已是晚期,尽管近年来手术、化学药物治疗和放射治疗技术不断改进,5年生存率仍无明显提高。因此,研究卵巢癌的发病机制、寻找新的诊断和治疗靶点,已经成为提高其预防和治疗效果的当务之急。Survivin基因位于人类染色体17q25,是凋亡抑制蛋白(IAP)家族的新成员,具有抑制细胞凋亡和调节细胞增殖的双重功能[1]。已有研究证实,Survivin蛋白在卵巢上皮性癌组织中呈异常高表达,与卵巢癌的发生、发展密切相关[2-4]。存在于Survivin基因上的多态位点可能影响survivin基因的转录活性和表达水平。例如,位于survivin基因启动子区的-31C>G多态可通过改变CDE/CHR调控元件结合位点的特异序列,增加阻遏蛋白与CDE/CHR元件结合,进而影响肿瘤的遗传易感性[5,6]。已有报道显示-31C>G多态与肺癌[5]、肾癌[7]、膀胱癌[8]、胃癌[9]、食管癌[10]、结肠癌[11]等多种恶性肿瘤的发病风险相关,但未见与卵巢癌发病风险的病例对照研究。本研究采用聚合酶链式反应-连接酶检测反应(polymerase chain reaction-ligase detection reac-tion,PCRLDR)技术,通过基于医院的病例-对照研究,探讨中国北方汉族人群survivin基因启动子区-31C>G多态与卵巢上皮性癌(epithelial ovarian cancer,EOC)发病风险的关系。
1 资料与方法
1.1 一般资料 138例卵巢上皮性癌患者(病例组)为2006年至2011年在笔者所在医院进行手术治疗的北方汉族女性,术前未行放射或化学治疗,术后标本均经病理学证实,其中浆液性癌52例,黏液性癌17例,宫内膜样癌50例和低分化腺癌19例;临床分期采用国际妇产科联盟(FIGO)标准(2000年),其中早期(Ⅰ~Ⅱ期)卵巢癌47例,晚期(Ⅲ~Ⅳ期)卵巢癌91例;确诊时年龄<50岁患者49例,≥50岁患者89例。另选择同一地区138例健康妇女作为对照组,对照组女性均无肿瘤和遗传病史。所有研究对象均有知情同意。
1.2 DNA提取 抽取患者及对照个体静脉血5 ml,以枸橼酸钠抗凝,采用Miller等[12]的蛋白酶K-氯化钠盐析法提取白细胞DNA。
1.3 基因多态性检测 采用PCR-LDR方法进行基因型检测。扩增-31C>G SNP位点的上、下游引物序列分别为5’-CGCCTCTACTCCCAGAAGGC-3’和 5’-GAGATGCGGTGGTCCTTGAGAA-3’,扩增片段为187 bp。PCR 反应体系为 15 μl,其中模板 DNA 1 μl,10 × PCR 缓冲液和 MgCl2各 1.5 μl,Taq-DNA聚合酶 0.2 μl,dNTPs(10 mmol/L)0.3 μl,DMSO 0.2 μl,上、下游引物各0.25 μl。PCR反应条件为:94℃ 2 min预变性后,94℃变性15 s、60℃退火15 s、72℃延伸25 s,35 个循环后,72℃继续延伸3 min。根据LDR探针设计原则设计LDR的荧光探针,特异性探针1(针对C碱基)为5’-CATTAACCGCCAGATTTGAATCGCC-3’;特异性探针2(针对G碱基)为5’-TTTCATTAACCGCCAGATTTGAATCGCG-3’。通用探针为的 5’-P-GGACCCGTTGGCAGAGGTGGCGGCG-FAM-3’。LDR反应体系:1×Buffer缓冲液 1 μl,探针混合液 0.03 μl,连接酶 0.125 μl,PCR产物2 μl,PCR 专用水补齐至10 μl。反应条件:95℃ 30 s,56℃2 min,进行35个循环。基因分型如图1所示。
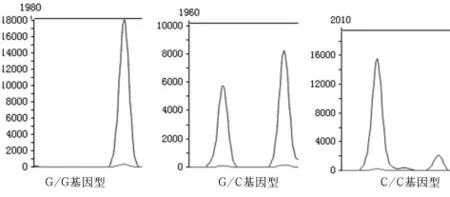
图1 Survivin基因-31C>G多态分型(PCR-LDR法)
1.4 统计学分析 应用SPSS 11.5统计软件,拟合优度χ2检验(df=1)进行Hardy-Weinberg平衡分析2组的基因型频率及等位基因型分布比较采用χ2检验,应用非条件Logistic回归模型计算OR值和95%CI,P<0.05为差异有统计学意义。
2 结果
2.1 研究对象的一般特征 病例组年龄19~64岁,中位年龄51岁;对照组年龄22~62岁,中位年龄49岁;2组年龄比较,差异无统计学意义(P>0.05)。对照survivin基因-31C>G多态的基因型分布均符合 Hardy-Weinberg平衡(χ2=0.44,P=0.51)。
2.2 Survivin基因-31C>G多态与卵巢癌的关系 Survivin基因-31C>G多态三种基因型(GG、CG、CC)频率在病例组中分别为 17.4%、46.4% 和 36.2%,与对照组(28.3%、47.1% 和24.6%)相比差异有统计学意义(χ2=6.627,P=0.036);病例组C等位基因频率(59.4%)显著高于对照组(48.2%),差异有统计学意义(χ2=7.004,P=0.008)。见表1。
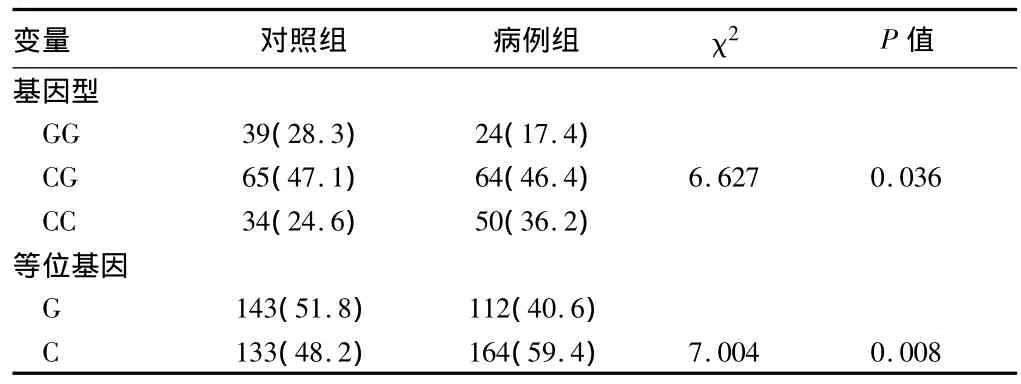
表1 Survivin基因-31C>G多态的基因型及等位基因型频率分布n=276,例(%)
2.3 Survivin基因-31C>G多态与卵巢上皮性癌发病风险的关联 与GG基因型相比,CC基因型能增加EOC的发病风险(OR 值为2.39,95%CI为 1.22-4.67);与 G 等位基因相比,C等位基因亦能增加EOC的发病风险(OR值为1.57,95%CI为1.12~2.21);同时进行基因的显性模型和隐性模型分析发现,C等位基因无论作为隐性基因还是显性基因均能增加EOC的发病风险。见表2。
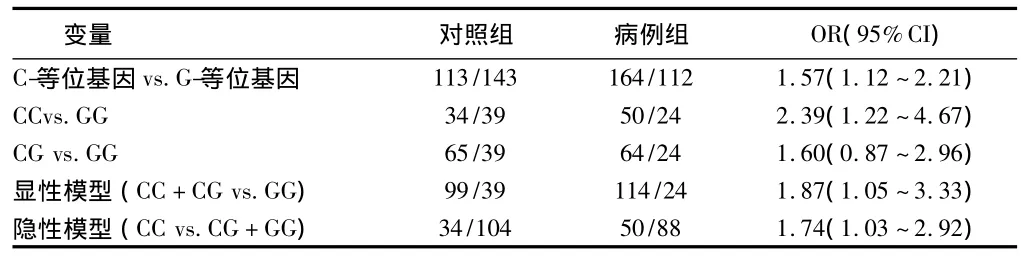
表2 Survivin基因-31C>G多态与卵巢上皮性癌发病风险的关联n=276,例
3 讨论
卵巢癌是病死率最高的妇科恶性肿瘤,其发病隐匿、进展迅速,70% ~80%的患者发现时已为晚期[1]。但迄今为止,卵巢癌的发病机制尚不清楚。研究显示遗传易感性可能在其发生中起重要作用。Survivin基因作为一个重要的遗传候选基因,由于具有抑制细胞凋亡和调节细胞增殖的双重功能,近年来成为研究的热点。
肿瘤是一个多基因参与的与细胞周期紊乱和凋亡受阻密切相关的疾病。Survivin基因位于人类染色体17q25,基因全长为14.7 kb,由3个内含子和4个外显子组成,是凋亡抑制蛋白(IAP)家族的新成员,广泛表达于人类胚胎组织和恶性肿瘤组织中,但不表达于正常组织和终末分化的成人组织。大量的研究证实,Survivin蛋白的高表达在肿瘤发生发展过程中起着重要的作用[2-4]。
存在于Survivin基因上的SNP位点可能影响基因的转录活性和表达水平,从而影响肿瘤的发生。-31C>G多态位于启动子区细胞周期依赖性元件(cell cycle dependent element,CDE)/细胞周期同源区(cell cycle homology region,CHR),-31G变异等位基因通过改变CDE/CHR调控元件结合位点的特异序列增加阻遏蛋白与CDE/CHR元件结合,从而降低survivin的表达,进而影响肿瘤遗传易感性[5-6]。
国内外有关Survivin基因与肿瘤关系的研究多集中在mRNA表达和蛋白表达水平上。例如,夏爽等[2]的研究显示Survivin基因表达与卵巢上皮性癌的病理类型和淋巴结转移显著相关。高庆等[3]的研究显示Survivin蛋白在卵巢癌组织中的表达显著高于良性上皮性卵巢肿瘤组织和正常卵巢组织,且与病理分期、细胞分化程度有关(Survivin蛋白在Ⅲ~Ⅳ期恶性上皮性卵巢肿瘤组中的阳性表达高于Ⅰ~Ⅱ期肿瘤组织,在低分化恶性上皮性卵巢肿瘤组织中的阳性表达高于中、高分化肿瘤组)。马志松等[4]的研究也显示Survivin表达和癌细胞分化程度、淋巴结转移存在相关性。但关于Survivin基因启动子区-31C>G功能性多态位点与肿瘤发病风险关系的研究国内外报道还很少,共查到相关文献20余篇,多为和胃癌、结直肠癌等消化道肿瘤的相关报道,未见与卵巢癌发病风险的病例-对照研究。其中Han等[13]进行了该位点和卵巢癌发病年龄的研究,发现携带CC基因型的患者发病年龄平均为57.1岁,较GG基因型携带者发病年龄提前(62.8岁)。
本研究结果提示survivin基因-31C>G功能性多态可能与中国北方汉族女性EOC的发病风险有关,这与程正江等[14]和黄俊等[15]对胃癌和结直肠癌的研究结果相似。这就从蛋白水平、转录水平和基因水平同时验证了该多态与卵巢癌的关系:-31C等位基因影响CDE/CHR调控元件结合位点的特异序列,减少阻遏蛋白与CDE/CHR元件结合,从而上调survivin蛋白表达,进而在卵巢癌的发生发展中发挥作用。
总之,本研究结果显示,survivin基因-31C>G多态与卵巢癌的发病风险相关,提示该功能性位点可能是卵巢上皮性癌的一个有意义的分子标志物。
1 Li F,Brattain MG.Role of the Survivin gene in pathophysiology.Am J Pathol,2006,169:1-11.
2 夏爽,傅芬.COX-2、Survivin蛋白在卵巢上皮性癌中的表达及与临床病理因素的关系.江西医学院学报,2006,46:70-73.
3 高庆,邢兰英,王咏雪,等.P-糖蛋白、Survivin蛋白在卵巢上皮性癌中的表达及其与卵巢癌耐药的关系.西安交通大学学报(医学版),2007,28:578-581.
4 马志松,黄永生,苏悦.卵巢上皮性癌组织中survivin与p53表达的研究.实用医药杂志,2011,28:301-304.
5 Jang JS,Kim KM,Kang KH,et al.Polymorphisms in the survivin gene and the risk of lung cancer.Lung Cancer,2008,60:31-39.
6 Xu Y,Fang F,Ludewig G,et al.A mutation found in the promoter region of the human survivin gene is correlated to overexpression of survivin in cancer cells.DNA Cell Biol,2004,23:527-537.
7 Qin C,Cao Q,Li P,et al.Functional promoter-31G > C variant in survivin gene is associated with risk and progression of renal cell cancer in a Chinese population.PLoS One,2012,7:e28829.
8 Jaiswal PK,Goel A,Mandhani A,et al.Functional polymorphisms in promoter survivin gene and its association with susceptibility to bladder cancer in North Indian cohort.Mol Biol Rep,2012,39:5615-5621.
9 Borges Bdo N,Burbano RR,Harada ML.Survivin-31C/G polymorphism and gastric cancer risk in a Brazilian population.Clin Exp Med,2011,11:189-193.
10 Yang X,Xiong G,Chen X,et al.Polymorphisms of survivin promoter are associated with risk of esophageal squamous cell carcinoma.J Cancer Res Clin Oncol,2009,135:1341-1349.
11 Gazouli M,Tzanakis N,Rallis G,et al.Survivin-31G/C promoter polymorphism and sporadic colorectal cancer.Int J Colorectal Dis,2009,24:145-150.
12 Miller SA,Dykes DD,Polesky HF.A simple salting out procedure for extracting DNA from human nucleated cells.Nucleic Acid Res,1988,16:1215-1215.
13 Han CH,Wei Q,Lu KK,et al.Polymorphisms in the survivin promoter are associated with age of onset of ovarian cancer.Int J Clin Exp Med,2009,2:289-299.
14 程正江,胡丽华,黄少军.Survivin启动子区域-31G/C多态性与胃癌发生的关系(英文).癌症,2008,27:258-263.
15 黄俊,汪建平,王磊,等.survivin基因启动子区-31C/G多态性与散发性结直肠癌遗传易感性的关系.中国病理生理杂志,2009,25:2344-2348.
