核酸检测技术在南昌地区无偿献血血液筛查中的应用
2012-01-14徐晶
徐晶
(南昌市血站输血研究室,江西 南昌330025)
核酸检测技术在南昌地区无偿献血血液筛查中的应用
徐晶
(南昌市血站输血研究室,江西 南昌330025)
目的病毒核酸检测技术(Nucleic Acid Technology,NAT)应用于献血者血液筛查,探讨缩短病毒检测“窗口期”的检测方法,保障临床输血安全。方法将2011年9月至2012年5月我站14203例无偿献血标本经血清学筛查合格的标本进行HBV、HCV和HIV三项联合NAT检测,并对NAT筛查阳性标本做确证试验。结果HBsAg、抗HCV、抗HIV ELISA检测均为阴性的血液标本13843例,NAT共检出阳性25例,阳性率为0.18%。其中HIV-DNA检出1例,HBV-DNA检出24例。结论核酸检测技术应用于献血者血液筛查中,有效地缩短了病毒检出“窗口期”,有力地保障了临床输血安全。
核酸检测;血液安全;无偿献血
HBV、HCV和HIV的经血传播一直是国内外输血领域关注的热点之一。虽然通过对血液进行输血相关病毒的抗原或抗体的检测,使输血传播疾病的发生率明显降低,但输血传播疾病仍时有发生。近年来发展的高度敏感、特异的核酸检测这项实验技术已在我国血液筛查方面得到逐步推广和应用,为进一步保证输血安全,提高血液质量,我站从2011年9月开始对所有的无偿献血血液标本进行HBV、HCV和HIV的核酸检测,现将检测情况报告如下。
1 材料与方法
1.1 标本来源与处理 2011年9月至2012年5月我站共采集无偿献血者标本14203份。采血结束后立即对每位献血者留取3份标本:其中2管(带分离胶EDTA-K2抗凝)用于核酸检测;另一管(EDTA-K2抗凝)用于血清学检测。所有标本保存于2℃~8℃,在4h内离心,24h内进行ELISA和NAT检测。
1.2 仪器 瑞士TECAN Freedom EVO 150全自动加样器,瑞士Hamilton FAME 24/30酶联免疫分析仪,罗氏诊断COBAS S-201血液核酸筛查平台(Hamilton STAR全自动混样仪、COBAS Ampilprep核酸提取仪、COBAS Taqmen Analyzer核酸扩增检测仪)。
1.3 试剂 核酸检测主要试剂为Cobas Taqscreen MPX试剂盒(美国罗氏公司),ELISA检测主要试剂由上海科华、北京万泰、厦门新创提供。
1.4 检测方法
1.4.1 按照国家《献血者健康检查要求》(GB18467-2001)对血液进行常规的HBsAg、抗-HCV、抗-HIV、梅毒抗体、ALT等项目2次检测,2次检测均合格的血液才继续进行NAT检测。
1.4.2 标本混合(Pooling)和检测 标本实行6人份混合检测模式。每个 pool包含6个无偿献血者标本,每个标本取167μl血浆至标记好的pool中,全自动混样仪加样。采用Cobas Taqscreen MPX检测试剂,在全自动核酸提取仪中应用MGP磁珠分离技术提取核酸,核酸扩增检测仪扩增检测HBV、HCV、HIV靶序列,在PDM服务器 (罗氏诊断COBAS S-201系统自带的服务器)中自动判读结果。每个pool均有内部参照品和外部质控品进行质量控制。有反应性pool拆分为6个组,对标本进行单检,单标本检测阳性判定为NAT阳性,单标本检测阴性判定为NAT阴性。
1.4.3 NAT有反应性标本的确证 将NAT检测有反应性的标本送至武汉血液中心作HBV-DNA、HCV-RNA和HIV-RNA的分项确证 (该实验室已通过验收考核,获得卫生部临床检验中心颁发的《临床基因扩增检验实验室技术验收合格证书》)。
1.4.4 如果NAT检测有反应性的标本确认为HIV-RNA阳性,将献血者留样的血辫再次进行ELISA检测,在其献血4周后,重新对该献血者采样,并将血样送南昌市疾病控制中心进行HIV蛋白印迹确认试验(WB)。
2 结果
2.1 13843份合格血液NAT检测 结果见表1。
2.2 NAT确认HIV-RNA阳性献血员的追踪检测结果见表2。

表1 13843例合格血液NAT检测结果
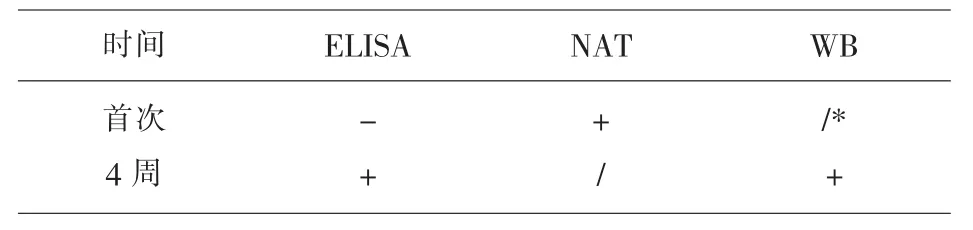
表2 NAT确认HIV-DNA阳性献血员的追踪检测结果
3 讨论
自开展核酸检测以来,我站从13843份合格血液中共检出24例HBV-DNA阳性血液,阳性率约为1/577,远高于江西省血液中心报道的1/2676[1]、青岛市中心血站报道的1/12000[2]、温州市中心血站报道的1/5806[3],与武汉血液中心报道的1/813[4]比较接近,可能是采用相同检测仪器和试剂的原因。各地检出阳性率差异较大,究竟是由试剂灵敏度差异造成还是人为操作因素,需要做进一步探讨。随着干扰素和核苷类抗病毒药物的不断发展应用,病毒不断变异以逃避宿主的免疫清除,虽然HBsAg ELISA检测试剂盒均针对高度保守区并增加了位点,但仍然不可避免地造成漏检。
13843份合格血液中未检测出HCV-RNA阳性血液,显然与ELISA试剂灵敏度较高有关系。广州血液中心曾对69份ELISA检测抗-HCV抗体双试剂阳性标本进行RIBA和Q-PCR确证,结果仅有39份HCV-RNA阳性(56.5%),而72份单试剂阳性的标本,Q-PCR结果均为阴性,RIBA结果为5份不确定[5]。深圳宝安区血站报道HCV残余风险为l/113639[6],北京血液中心曾联合5市进行大规模调查,报道HCV残余风险为l/43517[7],说明在HCV检测方面,血清学筛查有相当高的保障,而且ALT筛查对排除抗-HCV漏检血液仍有一定的作用。
13843份合格血液中共检出1例HIV-RNA阳性血液,与其它地区的报道基本相当[1,4,7],证明核酸检测实验有效的堵住了1例HIV窗口期感染的献血者。
通过输血传播的疾病有20余种,其中最严重的为艾滋病、丙型肝炎、乙型肝炎,这三种病毒的传播途径基本一致,主要是通过血液传播、性传播和母婴传播。所以应特别重视采取措施预防和控制着三大病毒的传播。当前,血清学检测HBsAg、抗HCV、抗HIV阴性不能排除这三种病毒的感染已成为共识,血清中存在病毒DNA(RNA)是诊断病毒感染最直接的依据。作为一种新型的筛查输血传播传染病因子的检测方法,NAT技术自1993年起已先后被欧美、日本以及我国香港等近20个国家和地区用来做献血者血液筛查。目前,输血安全面临的主要风险之一就是被筛查病毒的“窗口期”,研究表明,通过NAT检测,可将输血传播HBV、HCV和HIV的酶联免疫检测 “窗口期”分别由原来的 56d、70d 和 22 d 缩短 41d、12d 和 11d[8]。
也有研究者认为,从检测靶物质分析,ELISA指向抗原/抗体,NAT指向HIV/HCV RNA和HBV DNA,目前还没有证据明确显示病毒感染初期病毒RNA有效增值时间与抗原/抗体出现时间之间的关系,故认为两种方法的检测结果有互补之效,而不是简单的重复。
综上所述,NAT技术用于献血者血液筛查可以提高输血安全系数,保护献血者资源,保证用血安全,降低输血所引发的疾病传播的可能性。
[1]苗燕平,何华庆,后平钦.NAT检测在血液筛查中的应用[J].实验与检验医学,2010,28(3):326.
[2]吴玉清,郭 建,李金明,等.混合核酸检测法筛查HBV窗口期献血者[J].中华检验医学杂志,2008,31(5):566-567.
[3]陈筱华,林 碧,陈荣仓,等.无偿献血者HBsAg ELISA筛查阳性样本病毒核酸检测的研究[J].中国输血杂志,2008,21(6):439-440.
[4]余 谨,毕 昊,陆华新,等.核酸检测技术在酶联免疫吸附法漏检HIV和HBV血样筛查中的应用[J].国际检验医学杂志,2012,33(8):964-965.
[5]戎 霞,许 茹,王 敏,等.广州地区无偿献血人群抗-HCV初筛阳性结果的确证分析 [J].南方医科大学学报,2010,30(8):1967-1968.
[6]欧阳玲,黄建国,谢秀华,等.无偿献血人群HCV感染的检测和输血残余风险分析[J].实验与检验医学,2010,28(4):344-346.
[7]任芙蓉,王憬惺,赵海燕,等.我国5城市合格献血者血液HIV及HCV 残余风险研究[J].中国输血杂志,2007,20(6):469-475.
[8]刘 强,钱 榕,彭继红,等.病毒核酸检测在采供血机构血液筛查中的应用[J].实验与检验医学,2010,28(4):375-382.
R457.1+2
A
1674-1129(2012)05-0437-02
10.3969/j.issn.1674-1129.2012.05.006
