海南蒲桃果实原花青素的提取*
2012-01-12张镜刁树平
张镜,刁树平
(嘉应学院生命科学学院,广东梅州,514015)
原花青素是一类天然自由基清除剂与抗氧化剂,具有抗辐射、抗突变,防癌、增强免疫、延缓衰老、改善肠道菌群等多种生物活性,广泛应用于医药保健、功能性食品及化妆品等[1-6]。但生产原花青素的原料来源受季节与区域等的限制,产品供不应求,价格昂贵。原花青素的研发虽逾半个世纪,而寻求原花青素含量高、原料成本低廉的植物资源,仍是天然活性产物研发的重要课题[7-9]。
海南蒲桃[S.cumini],别名乌墨、楠木,是我国热带、南亚热带地区野生常绿乔木,喜温暖湿润气候,对土壤要求不高,适宜在5~10 cm以上的沙壤土及表层为红壤或黄壤土中生长,并有火烧不死之称[10]。海南蒲桃花多实丰,果实内含多种成分,具有治疗糖尿病、痢疾等疾病的药用价值,鲜果生食对慢性咳嗽和哮喘有治疗效果,是一种药效很好的野生水果。我国华南地区海南蒲桃大量用于行道及水源涵养林种植。但海南蒲桃果实一直没开发利用,大量海南蒲桃原花青素资源长期废弃。近年张亮亮等对海南蒲桃色素的提取及稳定性[11-13]、黄思梅等对海南蒲桃果实原花青素抗氧化活性的稳定性做了一定的研究[14],本文研究了海南蒲桃果实原花青素的提取工艺。
1 材料与方法
1.1 试验材料与主要仪器
1.1.1 材料来源及预处理
于广东梅州市采摘果皮颜色褪绿及淡红色的八成熟海南蒲桃果实,除去过熟、果皮软化的紫黑色果实以及伤果与杂物等,自来水洗净、晾干,冷冻干燥,粉碎,80筛目过筛粉末低温保存备用。
1.1.2 主要试剂
甲醇、无水乙醇、丙酮、正丁醇、浓盐酸、硫酸铁铵,均为分析纯。
1.1.3 主要仪器与设备
低速大容量多管离心机(JLL28-B),上海安亭科学仪器厂;冻干机(BT2K XL),美国VirTis公司;紫外-可见分光光度计(U-2800),日本日立公司;酸度计(PHS-2C),上海沪西分析仪器厂;电子分析天平(FA1604A),上海精天电子仪器有限公司。
1.2 试验方法
1.2.1 原花青素提取效果与含量的测定
原花青素提取液定容后,以正丁醇-盐酸法加热显色、测定各处理液A546值:取1 mL提取液于比色管中,依次加入6 mL体积比为95∶5的正丁醇-盐酸溶液及0.2 mL 2%硫酸铁铵溶液,沸水浴40 min,然后迅速冷却,以蒸馏水代替样液为参比,测定其A546值。以A546值为衡量提取效果的指标,以文献[15]公式计算原花青素的含量:
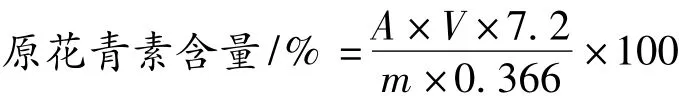
式中:A,吸光度;V,稀释倍数;m,样品质量(mg);0.366,在546 nm处原花青素的吸光度。
1.2.2 提取溶剂试验
准确称取适量海南蒲桃粉末,分别以不同体积分数的甲醇、乙醇、丙酮及水为提取剂按1∶10(g:mL)的料液比,室温浸提2 h,4 500 r/min离心20 min,收集上清夜,冻干后蒸馏水定容,得原花青素提取液,同1.2.1测定提取液A546值。
1.2.3 提取时间试验
准确称取适量海南蒲桃粉末,以60%丙酮为提取剂,料液比1∶10(g:mL),室温浸提至实验设定时间,4 500 r/min离心20 min,收集上清夜,同1.2.1方法测定提取液A546值。
1.2.4 提取料液比试验
准确称取适量海南蒲桃粉末,以不同的料液比体积分数与60%丙酮溶液混合,室温浸提2 h,4 500 r/min离心20 min,收集上清夜,同1.2.1方法测定提取液A546值。
1.2.5 提取液pH试验
准确称取适量海南蒲桃粉末,分别与不同pH值的60%丙酮溶液以料液比1∶10(g:mL)混合,室温浸提2 h,4 500 r/min离心 20 min,收集上清夜,同1.2.1方法测定提取液A546值。
1.2.6 提取温度试验
准确称取适量海南蒲桃粉末,以料液比1∶10(g:mL)与60%丙酮提取剂混合,于10~70℃ 内恒温水浴中浸提2 h,4 500 r/min离心20 min,收集上清夜,3次重复,同1.2.1方法测定不同料液比原提取液的吸光度。
1.2.7 提取参数的正交优化
根据单因素试验,对溶剂浓度、pH值、料液比及提取温度进行4因素、3水平的正交优化。
1.2.8 不同提取次数原花青素的提取率
以正交试验获得的优化参数提取八成熟果实物料原花青素5次,测定不同提取次数海南蒲桃原花青素的吸光度,以5次提取的吸光度总和为100%的提取率,然后计算不同提取次数原花青素的累计提取率。
1.2.9 果实不同成熟度原花青素的含量
八成熟度与充分成熟的海南蒲桃果实,冷冻干燥,粉碎,80筛目过筛,以正交优化所获参数提取的5次,同前述方法测定提取液A546值,计算原花青素的含量。
1.2.10 处理设置与数据分析
各处理重复3次,试验数据平均值以excel作图,用SPSS 11.0进行方差分析,相关数据进行Duncans’差异显著性分析,P<0.0 5表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 不同溶剂与浓度提取原花青素的效果
海南蒲桃果实物料以4种溶剂室温浸提原花青素2 h的相对效果见图1。从图1看出甲醇、乙醇及丙酮随着浓度增加原花青素的提取效果相应提高,达到一定浓度后提取效果又逐渐下降,但无水甲醇、乙醇及丙酮均无明显的提取作用;60%溶液丙酮浸提的效果为最佳,70%溶液乙醇溶液其次,甲醇溶液的提取效果更差。供试的3种有机溶剂原花青素提取液最大的吸光度间差异极显著(P<0.01)。蒸馏水具一定的提取作用,但远低于含适宜比例有机浓度的提取效果。
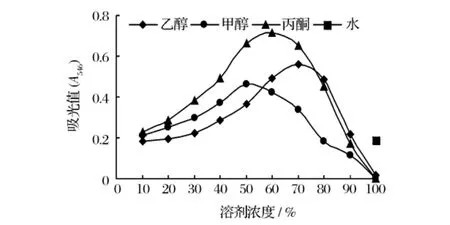
图1 溶剂种类及浓度对原花青素提取的影响
3种有机溶剂原花青素提取效果最佳的溶剂浓度不一。甲醇、丙酮与乙醇溶剂对原花青素提取效果最佳的浓度分别为50%、60%及70%,溶剂使用的浓度越高,提取过程中消耗的溶剂越多,提取费用越大。但因60%丙酮提取的原花青素达50%甲醇溶液的1.55倍,与乙醇相比不仅溶剂消耗量低而且提取的效果好,因而丙酮作为提取溶剂为最适。
2.2 浸提时间与原花青素提取效果的关系
以60% 丙酮溶液为提取溶剂,室温下不同时间原花青素的浸提效果见图2。
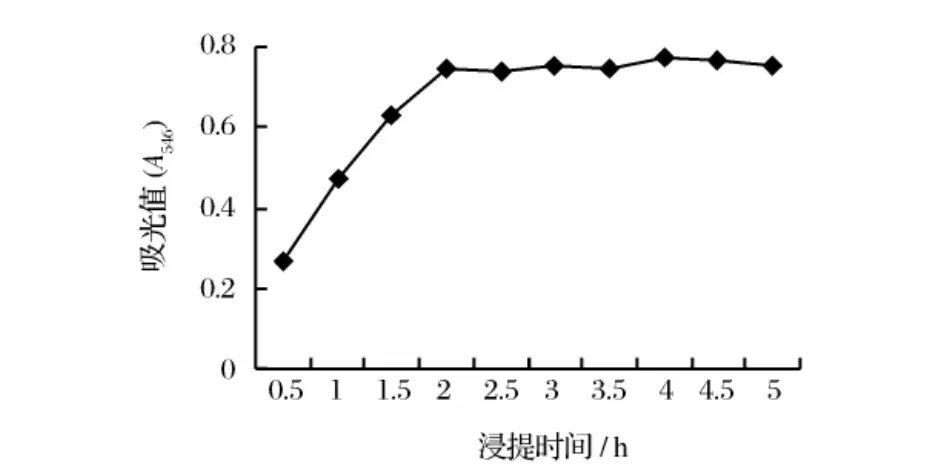
图2 浸提时间对原花青素提取的影响
从图2中可以看出,浸提时间在0.5~2.0 h内,随提取时间的延长原花青素的溶出量逐渐增加,且2相邻处理间提取液吸光度的差异显著(P<0.05)。浸提时间2.0~5.0 h内提取液原花青素的吸光度存在小幅波动,但彼此间差异不显著。结果表明,在实验条件下浸提2.0 h时物料中的原花青素的溶解已基本达到平衡,溶液中原花青素的量已达最大值。
2.3 料液比与原花青素提取效果的关系
海南蒲桃粉末与60%丙酮溶液以不同料液比(质量/体积)混合,浸提2 h后的吸光度见图3。结果料液比1∶4~1∶9内随料液比的增加,提取的原花青素量不断增加,料液比1∶9原花青素的提取量与其它料液比提取的原花青素的差异显著。结果表明,海南蒲桃原花青素以60%丙酮溶液浸提最适的料液比为 1∶9。
料液比的高低与提取液的极性无关,改变料液比不会改变目的物质在溶液中的溶解度。但料液比的变化影响提取物的浓度与溶剂的使用量,溶剂若是使细胞膜溶解及胶体物质变性而促进目的物质的溶出,则溶剂量越大对细胞膜的破坏作用越大、胶性物质沉淀越彻底,目的物质越容易从胞内扩散至溶液。而且料液比越大,目的物质胞内与胞外的浓度差越大,目的物质由胞内向胞外扩散的速度越快。
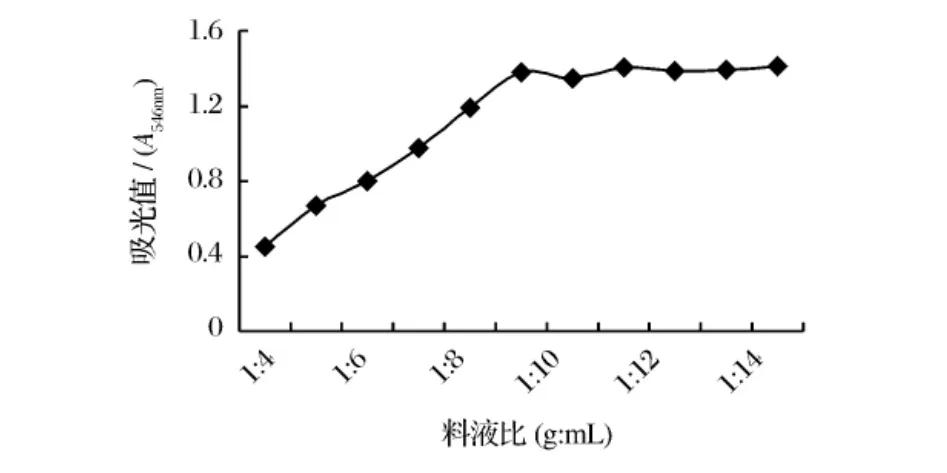
图3 料液比对原花青素提取的影响
2.4 溶液pH值与原花青素提取效果的关系
不同pH值的60%丙酮溶液原花青素的浸提效果见图4。
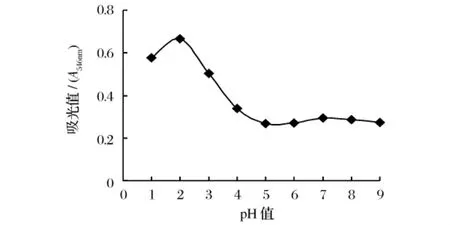
图4 pH值对原花青素提取的影响
由图4可见,pH=2时,原花青素的提取效果最好,提取液的吸光度分别为pH=1和pH=3提取液的1.16倍及1.67倍,而且与pH=1的差异显著、pH=3差异极显著。当提取剂pH>2时,提取原花青素的效果急剧下降,浸提液在pH在5~9内原花青素提取液吸光度间的差异不显著。结果表明酸性条件有利于海南蒲桃果核中原花青素的提取,弱酸、中性与强碱条件下对原花青素的提取效果均不佳,结果与原花青素提取相关文献的报道基本吻合[7]。
2.5 提取温度对提取效果的影响
不同温度浸提2 h提取液吸光度测定结果见图5。

图5 提取温度对原花青素提取的影响
结果表明,在50℃下提取对原花青素的提取效果最佳,提取液的吸光度为0.654,与40℃的提取液的吸光度差异极显著,且与60℃下提取的提取液的吸光度差异显著。提取温度若较低,与蛋白质、纤维素等结合的原花青素分离较慢,一定时间内原花青素溶出少,提取效率不高;温度升高,溶解速度加快,原花青素的提取率升高,而温度过高可能影响原花青素的稳定性差,聚合度降低、易氧化,得率低。植物活性物质的提取多为50℃左右为宜[13],也有少量以室温浸提或沸水提取的报道[16]。
2.6 正交优化实验
以溶剂浓度、料液比、提取温度及pH值进行的L9(34)正交结果见表1。由表1可知各种因素对提取效果影响的主次顺序依次为料液比>pH值>提取温度>溶剂浓度。在提取时间为2 h条件下,提取海南蒲桃果实原花青素效果最佳的组合是A2B2C3D1,即提取的最佳参数为丙酮浓度60%、料液比1∶9、提取溶剂pH=3及提取温度60℃,此提取参数使用的溶剂浓度与溶液的酸度较低,提取时间亦较短,但需要60℃的较高温度。正交试验方差分析与显著性检验见表2。由表2可知,料液比对原花青素提取与丙酮浓度、pH值及提取温度3因子相比的差异在显著水,而后3者间的差异不显著。

表1 正交实验结果
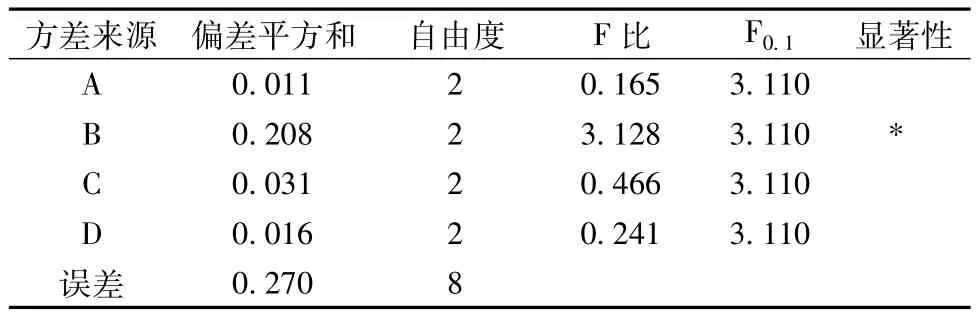
表2 正交实验方差分析表
2.7 提取次数与原花青素提取率的关系
海南蒲桃果实粉末以正交优化参数进行5次原花青素提取,结果见表3。从表3可以看出,以正交优化的参数进行原花青素提取,经1次提取的提取率为80.42%,2、3次提取的累计提取率分别为91.52%与95.29%,即经3次浸提后残渣中保留的原花青素甚微。研究表明浸提次数,以2~3次即可。

表3 不同提取次数原花青素的提取率
2.8 海南蒲桃果实原花青素的含量
八成熟与充分成熟的海南蒲桃果实以正交优化参数分别进行5次的原花青素提取后,测定其花青素含量(表4)。结果表明,八成熟的海南蒲桃果实的原花青素含量高,八成熟与充分成熟果实原花青素的含量分别为5.70%和4.48%。而且为充分成熟果实原花青素含量的127.23%,远高于充分成熟果实内的原花青素含量。

表4 海南蒲桃果实原花青素含量%
3 结论与讨论
研究表明从八成熟的海南蒲桃果实提取原花青素宜以体积分数的60%的丙酮水溶液为提取溶剂、pH=3、料液比 1∶9、温度 60℃、提取时间 2h,经 2 次浸提原花青素提取率91.52%。丙酮溶液提取海南蒲桃原花青素的效果优于乙醇及甲醇溶液,丙酮的酮基易于与原花青素中的羟基以氢键形式缔合,在水溶液中两者的氢键缔合作用较强。文献报道丙酮为溶剂提取原花青素的最佳浓度多为70% ~80%[17],而本实验结果是60%,溶剂消耗更少。
海南蒲桃果实原花青素开发宜以八成熟果实为原料。八成熟海南蒲桃果实原花青素的含量高,而且硬度大,采摘、干燥等中的损耗低。充分成熟果实中的部分原花青素转化为花青素,并与糖结合形成花色苷[12],但果实采摘、干燥时的损耗大,原料的利用率低。
海南蒲桃是开发活性产物的重要资源。八成熟海南蒲桃果实原花青素的含量达5.7%,而多数植物材料中原花青素含量不足1%。海南蒲桃是可鲜食的野生水果,果实中原花青素的安全性高。我国华南沿海省区海南蒲桃大量用于城市绿化与水源涵养林,开发海南蒲桃果实原花青素不仅可使资源变废为宝,而且不影响其园林绿化与水源涵养功能。
[1] 林启寿编.中草药成分化学[M].北京:科学出版社,1997:139-150.
[2] Kazumi M,Tatsuya H,Kai T,et al.Proanthocyanidin promotes free radical scavenging activity in muscle tissues and plasma[J].Appl Physiol Nutr Metab,2007,32:1 097-1 104.
[3] Jess R.Cranberry flavonoids,Atherosclerosis and cardiovascular health[J].Critical Reviews in Food Science and Nutrition,2002,42(Suppl):301-316.
[4] Mark A W,Barbara S H,Wilhelmina K,et al.Blueberry polyphenols increase lifespan and thermotolerance in Caenorhabditis elegans[J].Aging Cell,2006,5:59 - 68.
[5] Marta R,Eva N,Maria P,et al.Proanthocyanidins and the risk of colorectal cancer in Italy[J].Cancer Causes Control,2010,21:243 - 250.
[6] Shin M O,Sik Y,Moon J O.The Proanthocyanidins inhibit dimethylnitrosamine-induced liver damage in rats[J].Arch Pharm Res,2010,33(1):167-173.
[7] Dylan W P,Roshni C G,Francesca S,et al.Cinnamon extract inhibits tau aggregation associated with alzheimer’s disease in vitro[J].Journal of Alzheimer’s Disease,2009(17):585-597.
[8] Francoise M,Laura J,Riitta J T,et al.Phenolic composition and antioxidant capacity of bilberry(Vaccinium myrtillus)leaves in northern europe following foliar development and along environmental gradients[J]:J Chem Ecol,2010(36):1 017-1 028.
[9] Liza E L,Beatriz D R,Andres M,et al.Extraction of antioxidants from several berries pressing wastes using conventional and supercritical solvents[J].Eur Food Res Technol,2010,231:669 -677.
[10] 何和明.南方优良辅助蜜粉源一海南蒲桃[J].蜜蜂杂志,2006(9):39-40.
[11] 张亮亮,杨志伟,林鹏,等.海南蒲桃色素性质研究[J].食品科技,2007(12):158-161.
[12] Veigas J M,Narayan M S,Laxman Padmere M,et al.Chemical nature,stability and bioefficacies of anthocyanins from fruit peel of syzygium cumini Skeels[J].Food Chemistry,2007,105(2):619-627.
[13] Prince P S,Menon V P,Pari L.Hypoglycaemic activity of Syzygium cumini seeds:EffSRt on lipid peroxidation in alloxan diabetic rats[J].Journal of Ethnopharmacology,1998,61:1-7.
[14] 黄思梅,张镜.海南蒲桃原花青素DPPH自由基清除活性及稳定性的初步研究[J].食品科技,2010,35(3):204-207.
[15] 陈健,孙爱东,高雪娟,等.响应面分析法优化超声波提取槟榔原花青素工艺[J].食品科学,2011,32(4):82-86.
[16] 马龙,向阳.葡萄籽中原花青素提取工艺的研究[J].新疆医科大学学报,2005,28(3):215-217.
[17] 李春阳,许时婴,王璋.从葡萄废弃物中提取分离多酚类生物活性物质[J].食品科技,2004(6):88-93.
