聚酰胺吸附-HPLC测定饮料和糖果中的20种水溶性色素*
2012-01-12顾宇翔葛宇印杰虞成华陆志芸刘孟鲲马晓飞
顾宇翔,葛宇,印杰,虞成华,陆志芸,刘孟鲲,马晓飞
(上海市质量监督检验技术研究院/国家食品质量监督检验中心(上海),上海,200233)
现代食品加工中食用色素的使用十分普遍,天然色素存在成本高、着色力差、稳定性差等缺点,合成色素色彩鲜艳、稳定性好,价格便宜,广受食品生产厂的青睐[1-2],但部分合成色素存在一定安全隐患[3-5]。
由于法规允许使用的合成色素的种类和涉及的食品范围有限[6],一些不法食品生产者受利益驱动,会超量超范围地使用,甚至使用不可用于食品中对人体有害的色素和染料。在卫生部发布的食品中可能违法添加的非食用物质和易滥用的食品添加剂名单中色素类非法添加物就占到了9项。2012年发生的染色馒头事件提示不但要着力杜绝非食用色素的使用,对于超范围使用色素的情况也要加强监控。目前国内缺乏高通量筛选型测定方法,监督抽查中主要采用GB/T 5009.35-2003、GB/T 19681-2005、SN/T 1743 -2006 等标准[7-9],一次只能检测几种物质,效率较低,日常检测的批次数和涉及色素种类远远不能满足食品安全监控的需要。
鉴于此,建立准确、方便的色素污染物多组分检测方法迫在眉睫,这不但有利于提高检测效率、降低监督检验成本,而且能增强政府食品安全应急能力。参考国内外文献基础[10-13],本研究建立了一种适合于糖果、饮料的20种色素同时测定方法。之所以选取这2类产品,是因为儿童糖果、饮料消费量较大,鲜艳的颜色容易吸引他们的注意力,并且儿童的肝脏解毒功能尚不完善,更需要保护。
1 材料与方法
1.1 仪器与试剂
2695型Waters液相色谱仪带二极管阵列检测器,Waters公司。
柠檬黄、丽春红6R、苋菜红、胭脂红、诱惑红、赤藓红、亮蓝,购自国药集团;酸性品红6B、酸性红、酸性蓝1号、酸性绿、荧光桃红B、萘酚黄S、坚牢绿,购自Sigma公司;新红、偶氮红玉、靛蓝、专利蓝5号,购自Dr.Ehrenstorfer公司;酸性玫瑰红,购自东京化成工业株式会社;孟加拉玫瑰红,购自Alfa Aesar公司。
流动相乙腈和甲醇为色谱纯,聚酰胺粉末为柱层析专用级别,购自国药集团;其他试剂为分析纯,均购自国药集团;所用水为二级去离子水;样品从市场购得。
1.2 标准溶液制备
准确称取各标准样品20.0 mg至100 mL容量瓶中,以水定容,制成混合标准溶液(0.200 mg/mL),然后分别移取 1.00、2.00、5.00、10.0 和 25.0 mL 标准溶液至100 mL容量瓶中用水稀释配制成标准系列溶液(2.00、4.00 、10.0、20.0 和 50.0 μg/mL)。
1.3 前处理方法
1.3.1 饮料前处理
非碳酸饮料类:准确称取5 g(精确至0.01 g)样品,置于50 mL带盖聚丙烯离心试管中,用去离子水定容至50 mL,漩涡振荡器混合均匀样品。如果提取液混浊,需8 000 r/min离心5 min取上清液。然后向试样液中加入1.0~1.5 g聚酰胺粉末吸附色素,振荡混合后用布氏漏斗抽滤,保留漏斗中的粉末。用20 mL 1%醋酸分2-3次淋洗漏斗中的粉末,再用20 mL水分2~3次淋洗,接着用15 mL 1%V(氨水)∶V(甲醇)=1∶1分2~3次洗脱漏斗中吸附了色素的聚酰胺粉末。收集洗脱液后旋转蒸发至近干并用水定容,用0.45 μm微孔滤膜过滤器经一次性针筒压滤后即可得到澄清的样品溶液。
碳酸饮料类:准确称取5 g(精确至0.01 g)样品,置于50mL带盖聚丙烯离心试管中,在超声振荡仪中超声10 min除气,用去离子水定容至50 mL,之后处理方法同非碳酸饮料类。
1.3.2 糖果的前处理
取样5 g(精确至0.01 g)样品,置于50 mL带盖聚丙烯离心试管中,加入40 mL水后水浴加热超声溶解样品,完全溶解后用水定容至50 mL,之后处理方法同非碳酸饮料类。
1.4 色谱条件
色谱柱:XDB-C18(5 μm,4.6 mm × 250mm),柱温:30℃,流速:1 mL/mL,进样量一般为 20 μL。
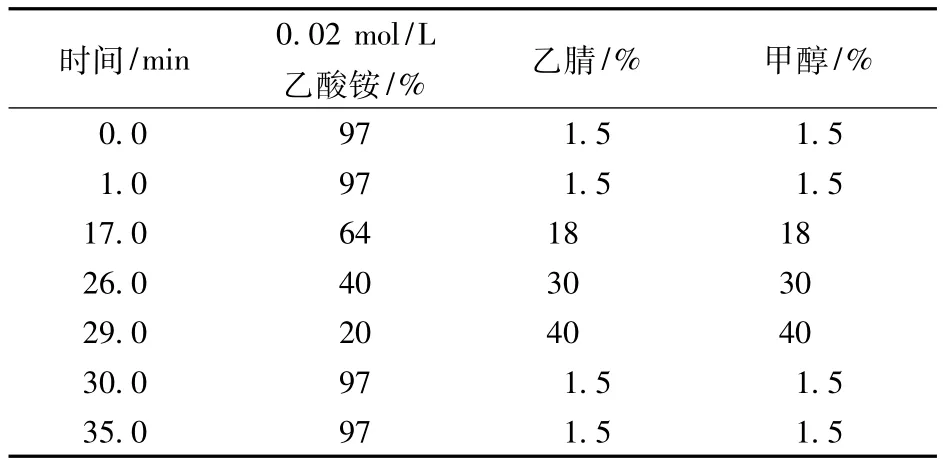
表1 流动相配比
1.5 检出限的确定
在所建立的前处理和色谱条件下,将不含任何色素的阴性样品提取后分别进样6次,以3、10倍阴性样品空白的标准偏差分别计算定性和定量检出限。
2 结果与分析
2.1 检测波长的确定
由于各种色素有不同的特征吸收波长,为了方便测定,根据这20种色素吸收峰的情况,确定了3个检测波长,分别为450、520和620 nm。它们的吸收光谱峰形可作为定性判定依据,但在极低含量时峰形会出现变化,需要注意辨别(图1~图3)。
2.2 前处理方法的影响
饮料类杂质少,易混合均匀,可以直接水浸提。采用聚酰胺粉末吸附-洗脱-浓缩是为了降低检出限,很多含色素量较高的饮料不需要此步骤亦可直接检测。但糖果基质较复杂,必须采取相应的提纯手段。
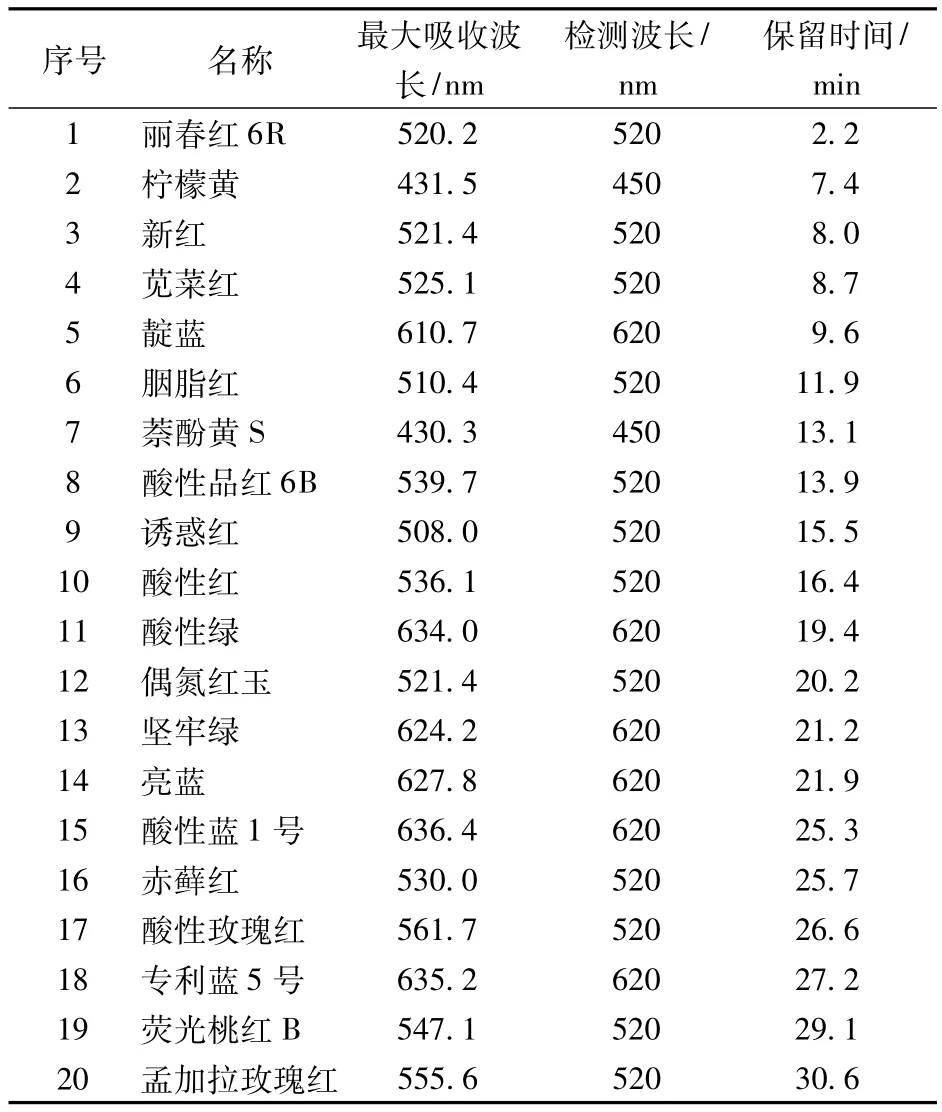
表2 色素的名称、吸收波长、检测波长和保留时间
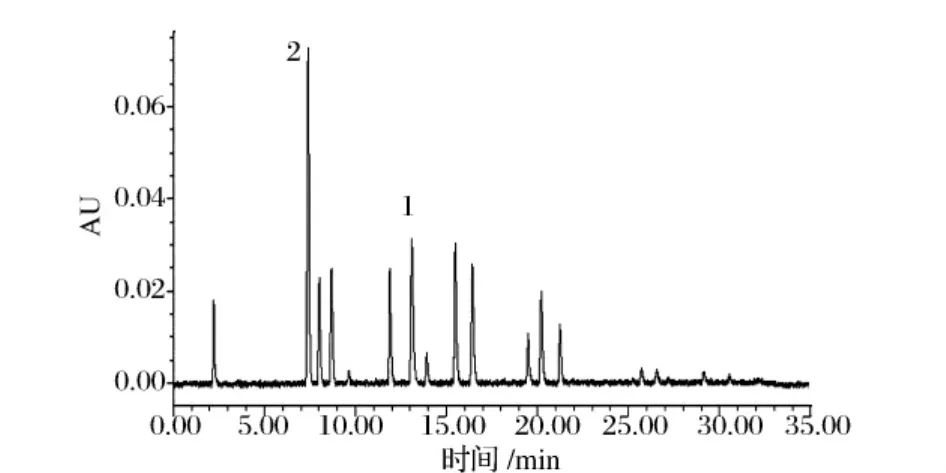
图1 450 nm波长下的标样色谱图
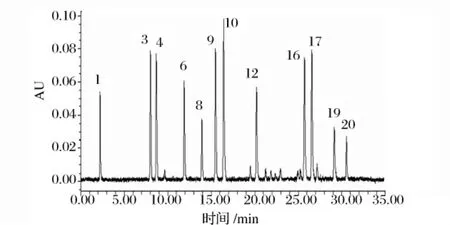
图2 520 nm波长下的标样色谱图
本研究对比了聚酰胺粉末吸附-洗脱-浓缩步骤使用与否对糖果检测的影响,图4为硬糖样品直接水浸提的色谱图,图5为该样品经提纯步骤的色谱图,可见该前处理方法对于降低基质干扰有较大帮助,色素基本未损失。
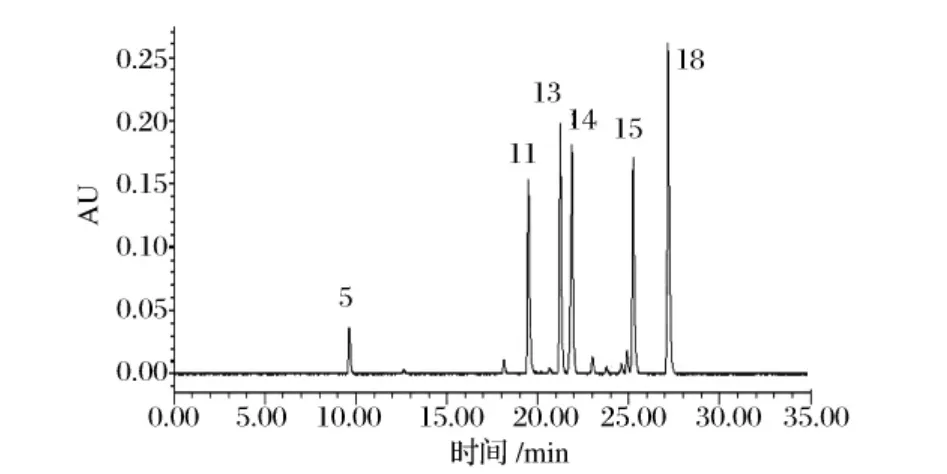
图3 620 nm波长下的标样色谱图
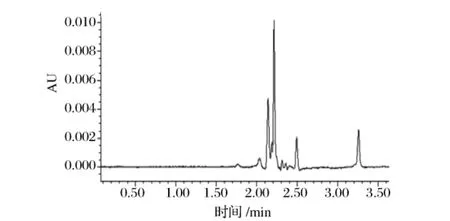
图4 硬糖样品直接水提色谱图
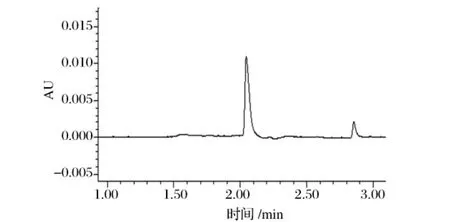
图5 硬糖样品经提纯后色谱图
2.3 检出限和标准曲线
在所建立的条件下,以3、10倍阴性样品空白的标准偏差计算出定性和定量检出限。考虑到实际样品基质的复杂性,故最终确定的检出限留有一定余量:定性检出限为0.03~0.3 mg/kg,定量检出限为0.1 ~1.0 mg/kg。
各色素在2.0~50 μg/mL之间其含量与响应值成正比,相关系数R2>0.999。
2.4 重复性
将某饮料和糖果分别按上述方法提取并测定6次,饮料和糖果样品计算所得的相对标准偏差(RSD)分别为0.77%~7.8%和0.51% ~7.6%。
2.5 回收率
取不同量的混合色素标准溶液,分别加入饮料和糖果样品中检测,得加标回收率在71.4% ~109.2%之间。
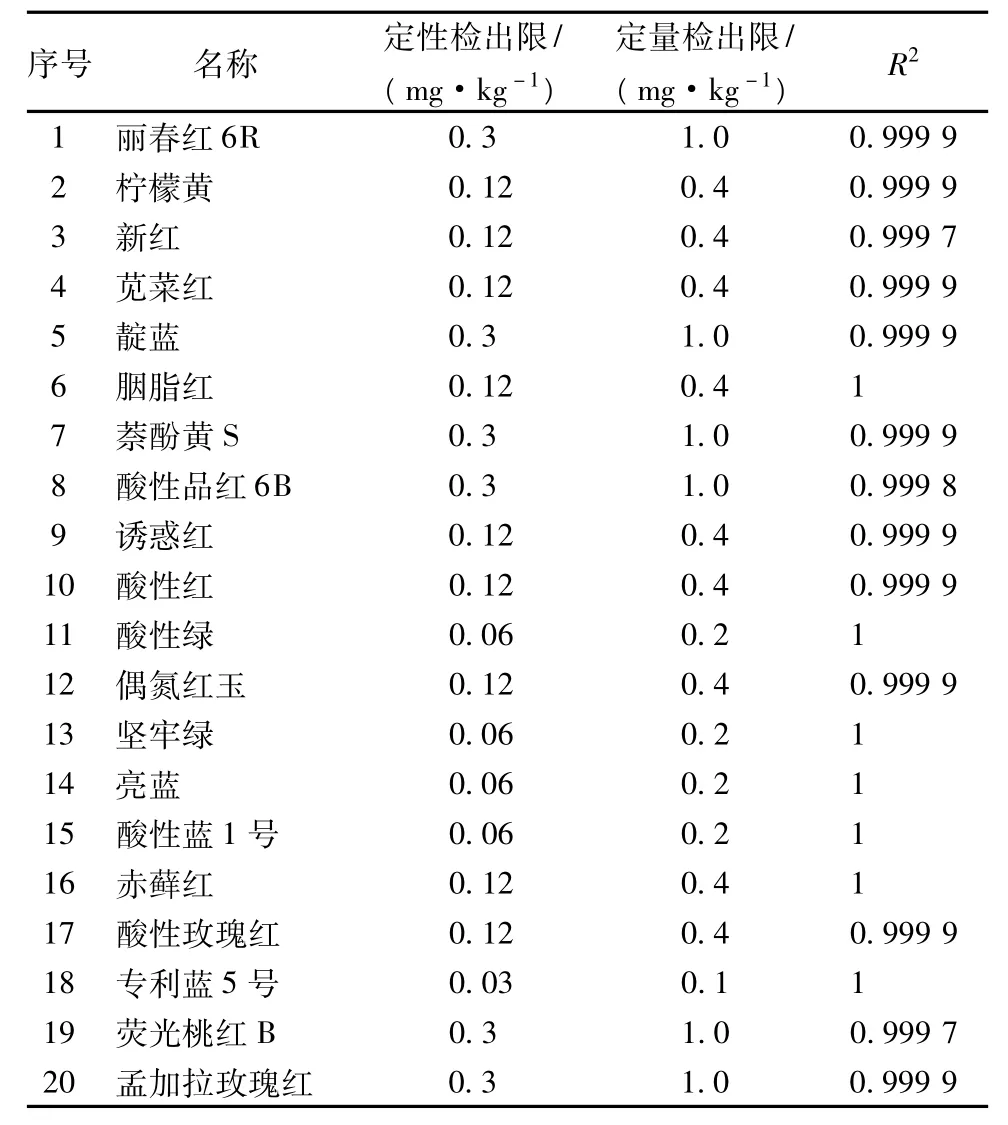
表3 检出限和标准曲线
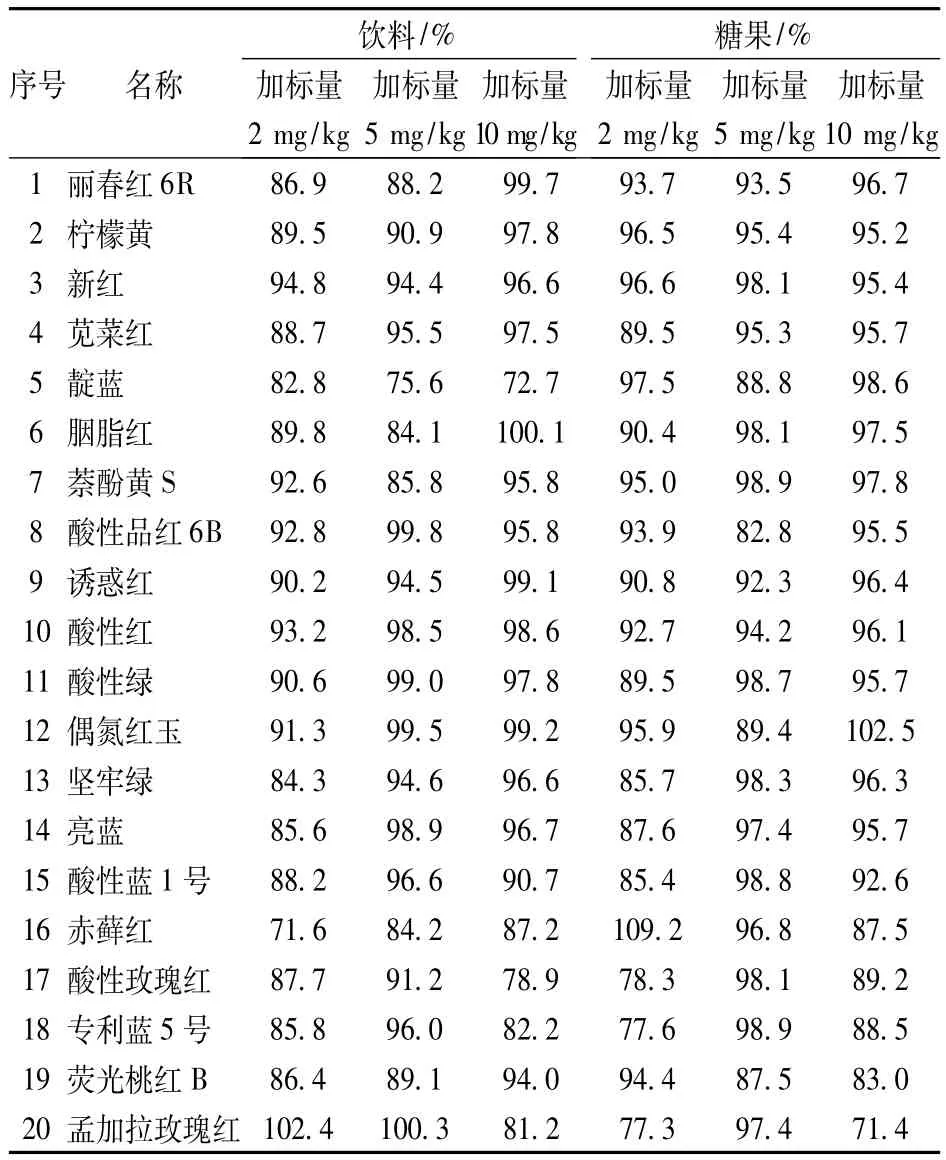
表4 样品加标回收率
2.6 稳定性
分别将标样和同一样品的提取液在制样后0,4,8和24 h测定,数据表明色素的含量并不存在显著性差异,稳定性良好。
2.7 实际样品分析
对市售50种饮料和糖果进行了测定,其中14种检出了柠檬黄、亮蓝、苋菜红和诱惑红中的一种或几种,含量在0.53~18.6 mg/kg。各样品添加的色素种类、范围及其用量都在法规允许的范围之内,未出现非食用物质的添加。此次样品主要购自大型超市,供货商均有一定规模,入市之前也经过了例行检测,以后采样因着眼于城乡接合部、农村等监管薄弱的地区,更易发现问题。
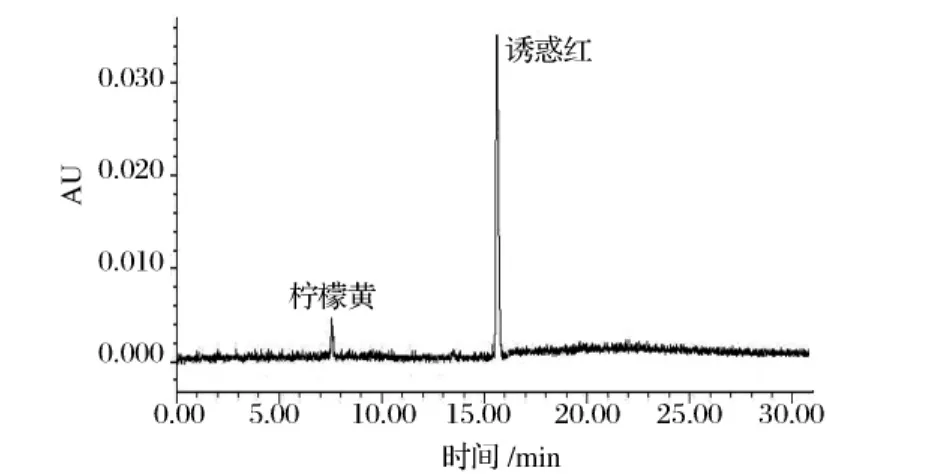
图6 水果糖果样品色谱图

图7 碳酸饮料样品色谱图
3 结论
本研究建立了聚酰胺吸附-HPLC测定饮料和糖果中的20种水溶性色素的方法,该方法准确、快速、有效降低基质干扰,适用于监管和检验部门对产品中色素的监测,有利于提高食品中色素污染物的检测效率、降低检验成本,对于规范市场上色素的标注和使用有重要的意义。
[1] 卢雪华,成坚,白卫东.我国食用色素工业的现状及对策[J].中国调味品,2010,35(5):35-39.
[2] 邹志飞,蒲民,李建军,等.各国(地区)食用色素的使用现况与比对分析[J].中国食品卫生杂志,2010,22(2):112-121.
[3] 朱海英,黄万琪.食品安全法背景下合成色素的问题及对策[J].现代医药卫生,2011,27(8):1259-1262.
[4] 徐亚新,肖海波.食品添加人工色素的危害性分析[J].中外医学研究,2009,7(6):124.
[5] 卢士英,邹明强.食品中常见的非食用色素的危害与检测[J].中国仪器仪表,2009(8):45-50.
[6] GB 2760-2011.食品安全国家标准食品添加剂使用标准[S].
[7] GB/T 5009.35-2003.食品中合成着色剂的测定[S].
[8] GB/T 19681-2005.食品中苏丹红染料的检测方法 高效液相色谱法[S].
[9] SN/T 1743-2006.食品中的诱惑红、酸性红、亮蓝、日落黄的含量检测高效液相色谱法[S].
[10] 周宏霞,韩喜东,于军强,等.食用色素及其检测方法的研究进展[J].检验检疫科学,2009,19(4):74-76.
[11] Simone Pereira Alves.Determination of synthetic dyes in selected foodstuffs by high performance liquid chromatography with UV - DAD detection[J].Food Chemistry,2008,107(1):489 -496.
[12] 于业志,周嘉明,赵春华,等.高胶质食品中合成色素检测方法的改进[J].食品与发酵工业,2011,37(1):142-145.
[13] 米迎波,黄蔚,刘国,等.高效液相色谱法同时测定糕点中4种食用合成色素[J].食品与机械,2011(4):78-81.
