单级连续发酵生产D-核糖*
2012-01-12张生克闫世梁黄惠英史小利李林朱腾跃崔凤霞
张生克,闫世梁,黄惠英,史小利,李林,朱腾跃,崔凤霞
(郑州拓洋实业有限公司技术中心,河南 郑州,450001)
D-核糖是五碳糖,生物体内核糖核酸、核苷酸辅酶类的构成成分,又是一种还原型诱导物,承担生物体内重要活性功能。可广泛应用于食品及医药工业,是合成VB2的重要原料,也是合成抗病毒、抗肿瘤药物的中间体[1]。分批发酵法是目前工业生产D-核糖最普遍的方法,但生产效率低、投资大,且劳动强度大,连续发酵是新兴的发酵工艺[2-4],具有简单、高效、稳定、连续的优点。因此,我们进行了D-核糖连续发酵过程的研究,探求工业生产上采用连续发酵的可能性,为提高D-核糖的发酵生产水平提供参考。
1 材料和方法
1.1 菌种
枯草芽孢杆菌(Bacillus subtilis)转酮醇酶(Transketolase)变异株XB02,由郑州拓洋实业有限公司技术中心保藏。
1.2 实验装置
采用GRJD型自控式发酵罐,由5L种子罐和30L发酵罐组成,镇江格瑞生物工程有限公司制造。
1.3 培养基
1.3.1 肉汤培养基
牛肉膏0.5%、蛋白胨1.0%、可溶性淀粉2.0%、NaC1 0.5%、酵母膏0.1%,pH 7.0,加入琼脂2.0%则为固体培养基。该培养基用于菌种的保藏、扩增及活化等。
1.3.2 种子培养基
葡萄糖2.0%、酵母膏 0.35%、K2HPO40.3%、KH2PO40.1%,pH 7.0。
1.3.3 发酵培养基
葡萄糖20%、玉米浆3%、(NH4)2SO40.6%、CaCO33.6%、MnSO4·4H2O 0.005%,pH 7.0。
1.4 实验方法
1.4.1 种子制备
将保藏菌种接入摇瓶培养基中36℃,200 r/min,培养12~20 h,然后转接至5 L种子罐中,设定搅拌转速400 r/min,温度 36℃,压力 0.06 MPa,通气量0.5(vvm),培养16~24 h。
1.4.2 连续发酵流程
单级连续发酵在30 L自控发酵罐中进行。在一定底物浓度下,先进行分批发酵,待菌体生长到达对数生长期末时转入连续发酵,控制稀释率,即将储罐中灭过菌的发酵培养基通过蠕动泵连续流加入发酵罐,同时溢流口连续溢出发酵液以保持发酵体积不变。发酵温度控制在(35±0.5)℃,罐压为0.08 MPa,搅拌转速 360 r/min,通气量为 1∶0.5(v/v/m)。
1.5 测定方法
D-核糖含量的检测:采用苔黑酚法[5]。
菌体生长量(OD值)的测定:用蒸馏水稀释发酵液40倍,以蒸馏水作空白,用721分光光度计测定发酵液在590 nm处的光密度。
残糖含量:采用SBA-40C型生物传感分析仪进行测定。
1.6 计算方法[6]

2 结果与分析
2.1 连续发酵起点的确定
研究表明,可以通过分批发酵的生长曲线和糖利用曲线等来判断连续发酵起点。Daniel[7]等判断连续发酵起点的标准是:正常分批发酵的条件下,当O2的吸收率快速上升、光密度达到分批发酵条件下可能达到的最大光密度的40% ~80%时,开始以一定的稀释率放料,随之转为连续发酵的操作方式。图1为分批发酵过程中OD590nm、溶氧、残糖和D-核糖产量随培养时间变化曲线,可以看到,发酵24 h时,O2吸收率最大,溶氧达到最低。且此时OD590nm达到最大值的约67%。按照上述标准,选择24 h作为连续发酵的起点,此时将储罐中灭过菌的发酵培养基通过蠕动泵以一定流速连续流加入发酵罐,同时从溢流口以相同的流速连续溢出发酵液,转为连续发酵。
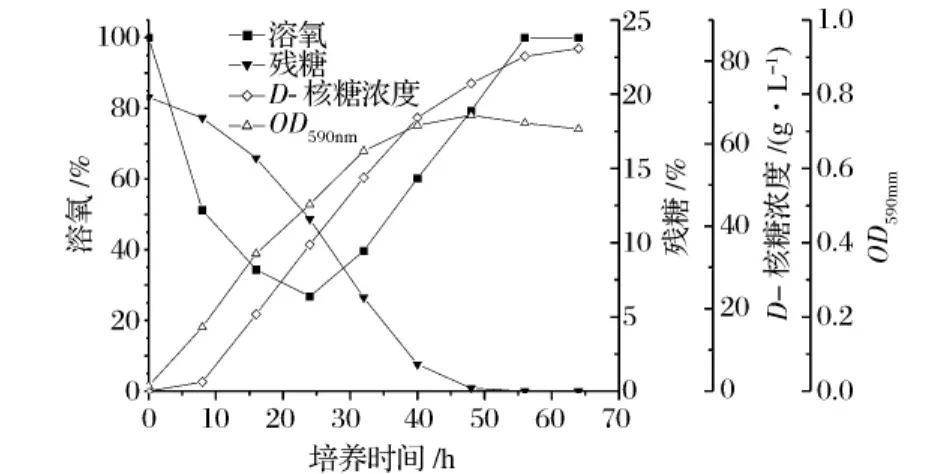
图1 分批发酵生产D-核糖的一般规律
2.2 稀释率对D-核糖单级连续发酵的影响
单级连续发酵流加底物糖浓度为200 g/L,通过改变不同稀释率研究其对D-核糖单级连续发酵影响,测定残糖浓度、菌体生长量(OD)、D-核糖浓度,并计算出D-核糖收率,结果如表l所示。可以看出,随着稀释率增加,发酵罐中的菌体生长量(OD)和D-核糖浓度不断下降,而残糖浓度逐渐升高。此外,随着底物流加速率提高,D-核糖收率也在不断下降。
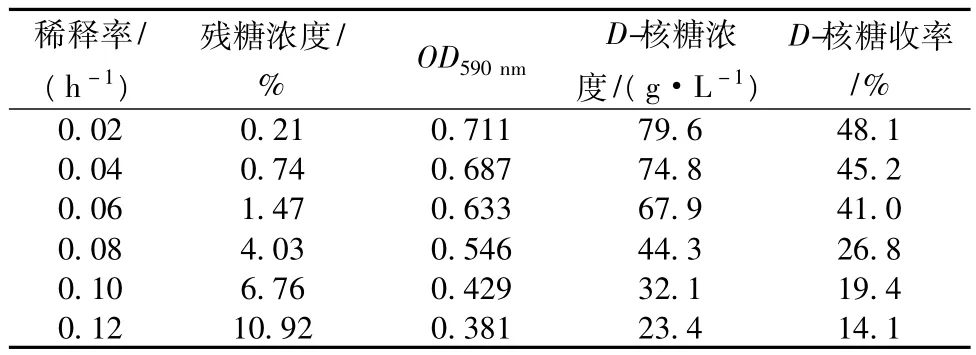
表1 不同稀释率对D-核糖单级连续发酵的影响
根据表1数据计算出不同稀释率下的糖消耗速率和D-核糖产率,结果如图2所示。可以看到,糖消耗速率随稀释率加大而提高。这主要是因为稀释率较低时,流加的还原糖在发酵罐中停留时间较长,被菌体利用得较为充分,糖消耗速率较低;在稀释率较高时,还原糖在发酵罐中停留时间较短,来不及被利用就流出罐外,因此糖消耗速率呈明显的增加趋势。而随着稀释率提高,D-核糖产率呈现先增加而后下降的过程,当稀释率为0.06 h-1时,D-核糖产率达到最大的4.07 g/(L·h)。
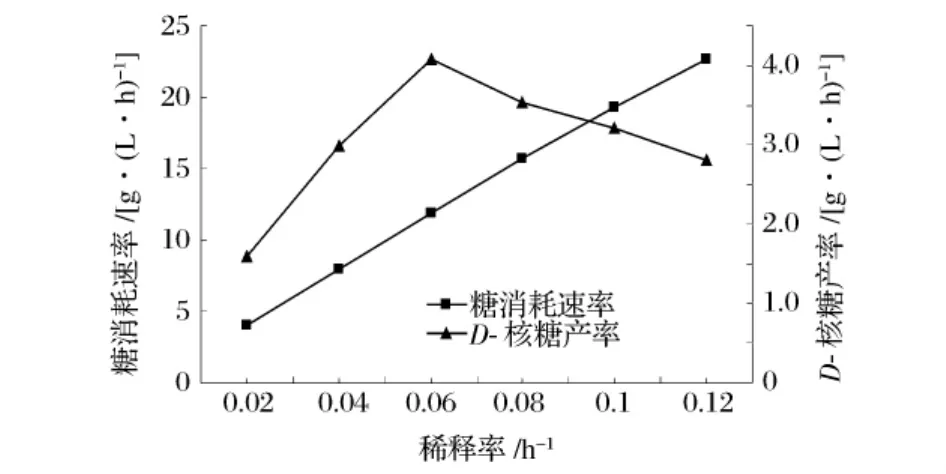
图2 稀释率对单级连续发酵糖消耗速率和D-核糖产率的影响
综上,稀释率对D-核糖单级连续发酵的影响较大,当稀释率为 0.06 h-1时,D-核糖产率最大,可达4.07 g/(L·h),为最佳稀释率。此时,发酵罐残糖浓度为1.47%,OD590nm为0.633,D-核糖浓度为67.9 g/L,D-核糖收率 41.0% 。
2.3 流加糖浓度对D-核糖单级连续发酵的影响
固定稀释率为0.06 h-1,改变流加糖初始浓度研究其对D-核糖单级连续发酵的影响。测定残糖浓度、糖利用率、菌体生长量(OD)和D-核糖浓度,结果见表2。由表2可见,连续发酵过程中,在底物糖流加速度一定的情况下,随着流加糖浓度提高,发酵醪液的残糖浓度不断增加,糖利用率却不断下降,菌体生长量(OD)从0.414增大到0.647,其后变化不大。D-核糖浓度则从最初的40.1 g/L增加到流加糖浓度为200 g/L时的68.7 g/L,糖浓度继续增加,D-核糖浓度始终保持在67 g/L左右。
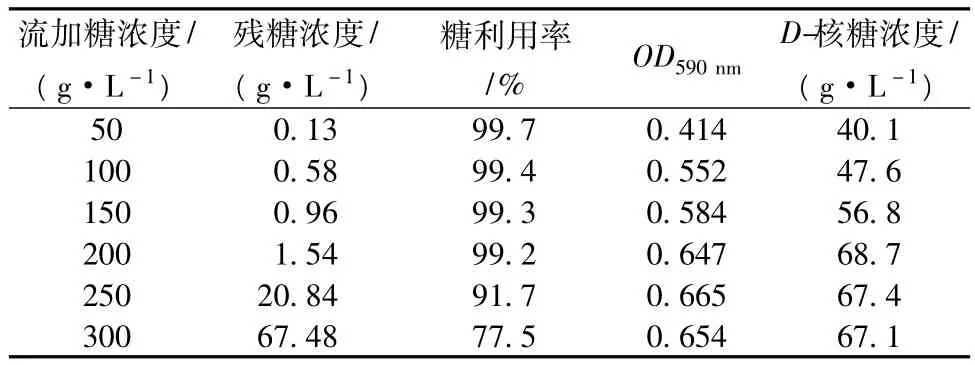
表2 不同流加糖浓度对对D-核糖单级连续发酵的影响
流加糖浓度对糖消耗速率、D-核糖产率的影响见图3。随着流加糖浓度由50 g/L增加到200 g/L,糖消耗速率由2.99 g/(L·h)快速增至11.90 g/(L·h),此后增加缓慢。D-核糖产率在流加糖浓度为50 g/L时为2.1 g/(L·h),200 g/L时达到最大的4.12 g/(L·h),此后略有下降。
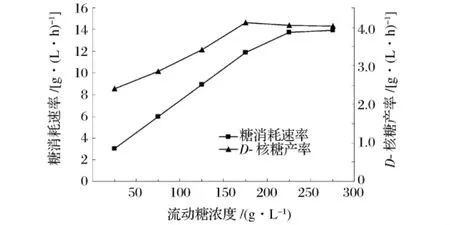
图3 流加糖浓度对单级连续发酵消耗速率和D-核糖产率的影响
因此,在一定的稀释率条件下,流加糖浓度对D-核糖单级连续发酵影响较大,并且流加糖浓度维持在一定范围内效果较好,继续提高流加糖浓度并不会使D-核糖产率加,反而导致糖利用率降低,造成浪费。稀释率为0.06 h-1时,最佳的流加糖浓度为200 g/L。
2.4 D-核糖单级连续发酵稳定性研究
单级连续发酵在30L自控发酵罐中进行,发酵温度控制在 (35±0.5)℃,罐压为0.08 MPa,搅拌转速360 r/min,通气量为1∶0.5。发酵罐中初始还原糖浓度为200 g/L,发酵24 h后开始以0.06 h-1的稀释率,将储罐中灭过菌的糖浓度为200 g/L的发酵培养基通过蠕动泵连续流加入发酵罐,同时溢流口以相同的速率连续溢出发酵液,连续发酵160 h,结果如图4所示。
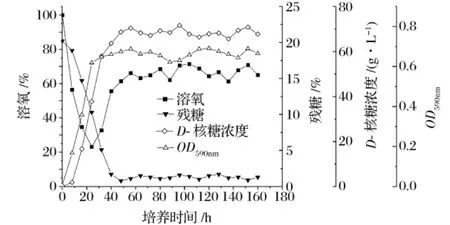
图4 连续发酵160 h各参数变化曲线
可以看到,D-核糖单级连续连续发酵约48 h后基本达到稳态,此后发酵醪液中的残糖浓度、溶氧、菌体生长量(OD)和D-核糖浓度均在一定的范围内波动,连续稳定发酵160 h,效果良好。
3 结论
(1)发酵24 h时,O2吸收率最大,溶氧达到最低,且此时菌体达到对数生长中期,因此选择24 h流加培养基,开始连续发酵。
(2)研究了稀释率、流加糖浓度对D-核糖单级连续发酵的影响,结果表明:稀释率为0.06 h-1,流加糖浓度为200 g/L时,D-核糖产率达到最大,可达4.0 g/(L·h)以上。
(3)以上述条件进行D-核糖单级连续连续发酵,约48 h后基本达到稳态,连续稳定发酵160 h,效果良好。
[1] 邱蔚然,高淑红.发酵法生产D-核糖[J].工业微生物,2003,30(1):58 -64.
[2] Lee W G,Park B G,Chang Y K,et al.Continuous ethanol production from concentrated wood hydrolusates in an internal membrane-filtration bioreactor[J].Biotechnol Prog,2000,16(2):302-304
[3] 李中兵,魏 转,杨晓军,等.连续发酵研究及其应用进展[J].食品科学,2007,28(11):624 -627
[4] Grootjen D R ,Jansen M L,Luyben K Ch A m,et al.Reaactors in series for the complete conbversion of glucose/xylose mixtures by Pichia stipitis and Saccharomyces cerevisiae[J].Enzyme Microb Technol,1991,13(10):829 -833.
[5] 彭其安,张西峰,吴思方,等.同源重组法构建枯草芽孢杆菌转酮酶缺失突变菌株[J].生物技术,2006,16(6):23-16.
[6] 王杏文,季更生,勇强,等.树干毕赤酵母单级连续发酵制取乙醇的研究[J].南京林业大学学报:自然科学版,2007,31(5):6 -10.
[7] Daniel N B.Enhanced product formation in continuous fermentations with microbial cell recycle[J].Biotechnol Bioeng,1981,23(2):373 -389.
