2种淀粉-壳聚糖-纤维素衍生物可食膜特性的对比*
2012-01-12方健罗小雪邹玉蕾
方健,罗小雪,邹玉蕾
(北京林业大学,北京,100083)
淀粉和壳聚糖都是自然界丰富的可再生资源,都有一定的生物相容性和生物降解性。近年来,人们对用淀粉与壳聚糖来制取各种环境友好材料进行了大量的研究。通过共混,可以使各组分高分子之间相互作用,以达到协同增效的目的。这种材料有极其广泛的应用领域,其中包括高附加值的吸附剂、膜材料等。尤其在人们普遍关注白色污染的今天,开展这方面的研究工作意义更大。但目前开发的淀粉/壳聚糖基材料虽然存在力学性能不高、抑菌性能不好和抗水性差等不足,但可以通过第三组分的添加,提高共混材料的性能。
本文主要对比研究2种壳聚糖-淀粉-纤维素衍生物可食膜的性质及结构。将羧甲基纤维素钠和甲基纤维素分别加入淀粉-壳聚糖膜中,制备出共混膜,对2种共混膜的力学性能、透湿性、透明性、耐酸耐碱性以及抗菌性等多种性能进行测试,并采用X射线衍射法、扫描电镜、热重分析对可食膜结构进行表征,将其与壳聚糖膜、淀粉-壳聚糖可食膜的各项性能、结构进行比较,从而研究不同纤维素衍生物对淀粉-壳聚糖可食膜性能的影响。
1 试验部分
1.1 材料与试剂
壳聚糖,脱乙酰度≥90.0%,国药集团化学试剂有限公司;羧甲基纤维素钠,分析纯,天津市津科精细化工研究所;甲基纤维素,国药集团化学试剂有限公司;马铃薯淀粉、乙酸、丙三醇、乙二醇、氢氧化钠、盐酸、氯化钠、无水磷酸氢二钠、磷酸二氢钾,均为国产分析纯试剂;牛肉膏、蛋白胨、琼脂粉均为国产生化试剂。
供试菌:金黄色葡萄球菌(Staphylococcus aureus)、大肠杆菌(Escherichia coli),由北京林业大学生物学院提供。
普通营养琼脂培养基和磷酸盐缓冲液按照GB/T21510-2008配置。
1.2 主要设备和仪器
精密增力电动搅拌器(JJ-1),北京市永光明医疗仪器厂;电热恒温水浴锅(DZKW-D-2),北京市永光明医疗仪器厂;脱泡机(TP-08),北京东方泰阳科技有限公司;循环水式多用真空泵(SHB-Ⅲ),郑州长城科工贸有限公司;智能电子拉力机(XLW(L)-PC),济南兰光机电技术有限公司;透湿性测试仪(TSY-T1),济南兰光机电技术有限公司;可见分光光度计(Spectrumlab 22pc),上海棱光技术有限公司;厚度计(7327),日本三丰公司;恒温振荡器(THZ-C),太仓市实验设备厂;手提式压力蒸汽消毒器(GMSX-C),北京市永光明医疗仪器厂;生化培养箱(SPX-250B),上海浦东荣丰科学仪器有限公司;单人单面净化工作台(SW-CJ-1FD),苏州净化。
1.3 薄膜的制备
1.3.1 羧甲基纤维素钠溶液的配制
将1 g羧甲基纤维素钠加入60 mL蒸馏水,在65℃的水浴条件下充分搅拌,直至完全溶解为透明状黏稠液体,即得到0.03 g/mL的羧甲基纤维素钠溶液。
1.3.2 甲基纤维素溶液的配制
取3 g甲基纤维素溶于100 mL蒸馏水中,在65℃的水浴条件下溶解,溶解过程中不断搅拌,溶解3h后从水浴中取出,静置12 h,用80目的标准筛过滤,得到0.03 g/mL的甲基纤维素溶液。
1.3.3 可食膜的制备
将壳聚糖溶于体积分数6%的乙酸溶液中,在45℃的水浴锅中溶解,溶解过程中进行机械搅拌,完全溶解后,制成质量分数为2%的壳聚糖溶液。将马铃薯淀粉溶于水溶液中,在80℃的水浴中充分糊化,糊化过程中不断进行搅拌,防止淀粉凝结,制成质量分数为5%的淀粉溶液。将淀粉溶液和壳聚糖溶液按固含量1∶1的比例充分混合,并加入适量增塑剂,使混合液在80℃恒温条件下共混一段时间,再分别加入羧甲基纤维素钠溶液和甲基纤维素钠溶液,制得两种混合液,使壳聚糖与羧甲基纤维素钠、壳聚糖与甲基纤维素的质量比均为2∶1。混合液冷却后放入真空脱泡机内脱泡。将膜液均匀铺在光滑干燥的聚酯涂硅膜上,静置直至膜自然脱落,制得淀粉-壳聚糖-纤维素衍生物可食膜。
1.4 薄膜物理性能测试
1.4.1 力学性能的测试
力学性能测试标准参照GB/T13022-1991。
1.4.2 透湿性的测试
透湿性测试标准参照GB/T 1037-1988。
1.4.3 透明性的测试
将膜切成10 mm×60 mm的矩形。用透明胶带纸贴于比色皿表面,用分光光度计,分别在460、480、540、600 nm下,以蒸馏水作为标准物,以比色皿作为空白参照物,分别测定膜的透光率(T),以透光率的大小间接表示膜的透明度。每种膜做4组平行实验,取平均值,作为试验结果。
1.4.4 耐酸耐碱性的测试
将膜切成若干个20 mm×20 mm的矩形,分别浸入不同的酸碱液中,观察记录膜在酸碱液中溶解的情况,记录观察溶解现象。酸碱溶液包括:2%乙酸、0.1 mol/L HCl、6 mol/L HCl、1%NaOH、4%NaOH。
1.4.5 抗菌性的测试
抗菌性试验参照国标GB/T 21510-2008,菌落计数按中华人民共和国卫生部《化妆品卫生规范》(2002版)中菌落总数测定方法,试验用标准菌种为金黄色葡萄球菌和大肠杆菌。
抗菌率R按式(1)计算:
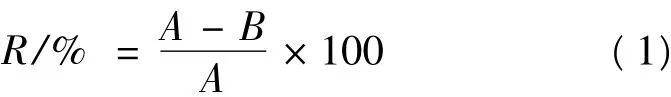
式中:R,抗菌率,%;A,对照样品与受试菌接触一定时间后平均回收菌数,单位为菌落形成单位每毫升(CFU/mL);B,试验样品与受试菌接触一定时间后平均回收菌数,单位为菌落形成单位(CFU/mL)。
1.5 薄膜结构观测与表征
1.5.1 X射线衍射(XRD)测定
采用日本SHIMADZU公司生产的XRD-6000型X射线衍射仪进行测定。XRD测试条件:辐射管电压40 kV,辐射管电流30 mA,扫描范围5~60°,步长0.2°,扫描速度2°/min。
1.5.2 扫描电镜(SEM)观察
用日本Hiachi公司S-3000N型扫描电镜观察可食膜,真空喷金后观察膜的表面、截面形貌并拍照。
1.5.3 热重(TGA)分析
采用岛津 DTG-60(H)分析仪测定,升温速率10℃ /min,通入 N2,流量为 20 mL/min,样品量 8 ~9 mg。
2 结果与分析
2.1 理化与生物学特性分析
2.1.1 可食膜的力学性能
将制备好的3种可食膜切成15 mm×150 mm,然后浸入1%或4%NaOH溶液中1 h后取出,自然干燥1 d后测其力学性能,试验结果见图1、图2。

图1 不同可食膜的抗拉强度
从图1可以看出,未经碱液浸泡的可食膜中,加入羧甲基纤维素钠溶液使膜的抗拉强度有所下降。可能的原因是CMCNa带有负电荷,而壳聚糖含有正电荷,混合后由于电荷的中和,减少了氢键的作用,所以膜抗拉强度有所下降。加入甲基纤维素溶液使膜的抗拉强度显著增大,这种现象的主要原因可能是壳聚糖分子中含有疏水键乙酰基,而在甲基纤维素中有大量的亲水性基团如羟基、甲基等。在成膜过程中,随着水分的不断散失,分子间的氢键结合更强烈了,同时分子间的力也随之增大。
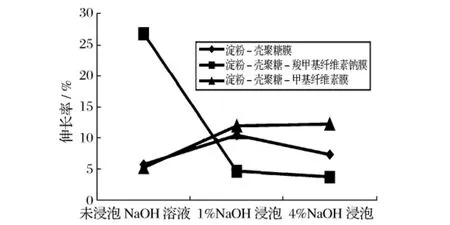
图2 不同可食膜的伸长率
经过1%和4%NaOH溶液浸泡的3种膜的强度非常接近。经过1%碱液浸泡的淀粉-壳聚糖膜和淀粉-壳聚糖-羧甲基纤维素膜的抗拉强度明显优于未处理膜,其原因可能是壳聚糖膜是酸处理膜,酸性条件下分子中第二位的—NH2上带有正电荷,在成膜过程中正电荷相互排斥,使膜的结构相对较为松散,而碱处理则使膜的结构更加致密。而加入甲基纤维素的膜经过NaOH溶液浸泡后抗拉强度比未浸泡的有所降低。从图2可以看出,未经碱液浸泡的可食膜中,加入羧甲基纤维素钠溶液使膜的伸长率明显增大。其原因是带负电荷的CMCNa与含有正电荷的壳聚糖通过静电作用形成高分子离子复合物。加入甲基纤维素溶液对膜的伸长率的影响并不大。淀粉-壳聚糖-羧甲基纤维素钠可食膜经过NaOH溶液浸泡后,伸长率比未经碱液浸泡的膜要小很多,与未加CMCNa的膜伸长率相当,柔度明显降低。淀粉-壳聚糖膜和淀粉-壳聚糖-甲基纤维素膜经过NaOH溶液浸泡后,其伸长率略有增大。
2.1.2 可食膜的透湿性
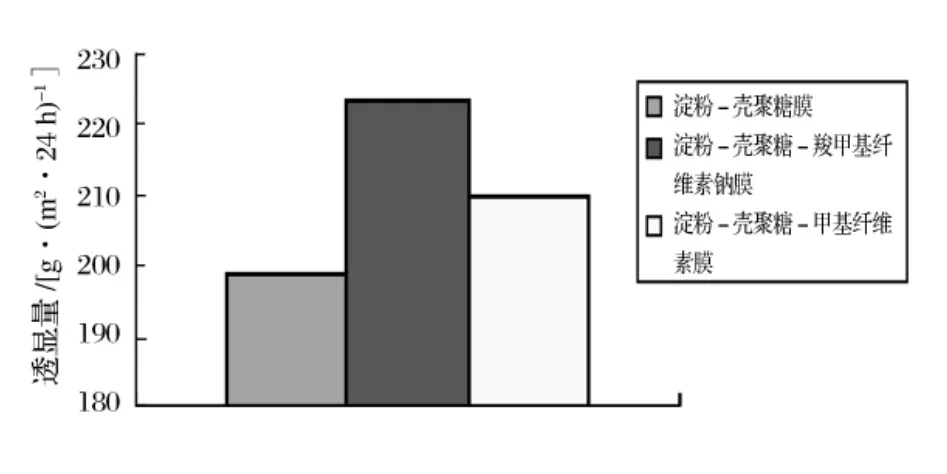
图3 可食膜的透湿量
从图3中可以看出,羧甲基纤维素钠和甲基纤维素的加入增大了淀粉-壳聚糖膜的水蒸气透过量,原因可能是纤维素衍生物中的亲水基团使水蒸气透过量上升。
2.1.3 可食膜的透明性
由图4可知,各膜在460 nm处对应的透光率最小,表明该波长为最大吸收波长。
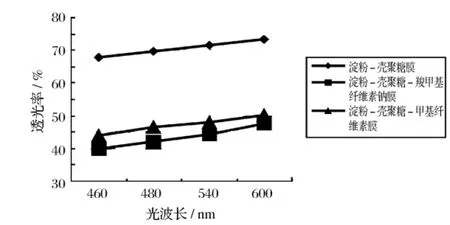
图4 可食膜的透明性
由试验得知,加入羧甲基纤维素钠和甲基纤维素的薄膜比淀粉-壳聚糖膜的透光率下降较多。原因可能是由于膜中的粒子粒度较大且不均匀,导致透光率下降,导致界面由于光的散射或反射而使膜的透明度降低。
2.1.4 可食膜的耐酸耐碱性
各种膜浸入酸碱溶液中,其现象基本一样。从表1中可以看出,膜在稀酸中明显溶胀,这是因为在稀酸中,壳聚糖的主链会缓慢水解。而在碱液中,膜缓慢卷曲,不溶胀。这是由于壳聚糖与淀粉都是亲水性的高分子材料,在碱液中,膜会吸湿卷曲,但并不溶解。

表1 可食膜的耐酸碱性
2.1.5 可食膜的抗菌性
通过公式(1)计算得出各种膜的抗菌率如图5所示。
由图5可以看出,各种壳聚糖膜对金黄色葡萄球菌和大肠杆菌均具有明显的抗菌性,抗菌率都达到90%以上,且对于金黄色葡萄球菌的抗菌性明显优于对大肠杆菌的抗菌性。其中纯壳聚糖膜和淀粉-壳聚糖膜对金黄色葡萄球菌的抗菌效果最好,抗菌率达到99.9%,淀粉-壳聚糖-甲基纤维素膜对大肠杆菌的抗菌效果最好,抗菌率达93.3%。壳聚糖的抗菌作用主要有以下2种机理:一种是壳聚糖通过吸附在细胞表面,形成一层高分子膜,阻止了营养物质向细胞内的运输,从而起到抑菌杀菌作用;另外一种机理是壳聚糖通过渗透进入细胞体内,吸附细胞体内带有阴离子的细胞质,并发生絮凝作用,扰乱细胞正常的生理活动,从而杀灭细菌。因为金黄色葡萄球菌和大肠杆菌的细胞壁结构不同,两种作用对其影响程度也不同。对于金黄色葡萄球菌,前一种作用机理起主导作用。而对于大肠杆菌来讲,后一种作用机理起主导作用。[1]本试验中采用的壳聚糖分子量较大,故在细胞表面形成的外层膜致密,能阻止营养物质进入细菌细胞,因而对金黄色葡萄球菌的抗菌作用效果更明显。

图5 可食膜的抗菌性
2.2 结构表征
2.2.1 X射线衍射分析
马铃薯淀粉、壳聚糖及各共混膜的X射线衍射光谱见图6和图7。马铃薯淀粉的衍射峰出现在17°处,壳聚糖的衍射峰位于12°、20.2°,羧甲基纤维素钠的衍射峰位于 27.4°、31.8°、45.6°,甲基纤维素的衍射峰位于 8.4°、13.2°、20.4°、44°。若羧甲基纤维素钠或甲基纤维素、马铃薯淀粉、壳聚糖之间没有相互作用或相互作用很弱,则在其共混膜中会有各自的结晶区,衍射峰则会表现为膜中各组分按共混比例简单的叠加。但实际上,由于共混物的晶体结构发生了变化,图6d中19.4°处的特征衍射峰、图7d中20.2°处的特征衍射峰变得更宽,马铃薯淀粉、壳聚糖、羧甲基纤维素钠、甲基纤维纤维素的特征峰几乎消失。这些变化证实了共混膜各组分之间存在强的相互作用并具有很好的相容性。

图6 壳聚糖(a)、淀粉(b)、羧甲基纤维素钠(c)和三元共混膜(d)的X射线衍射图
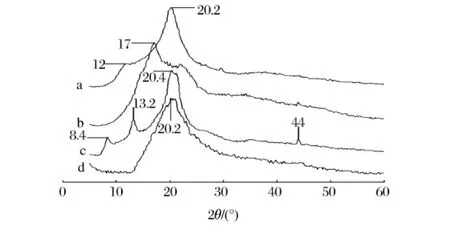
图7 壳聚糖(a)、淀粉(b)、甲基纤维素(c)和三元共混膜(d)的X射线衍射图
2.2.2 扫描电镜分析
采用SEM对壳聚糖膜,淀粉-壳聚糖-羧甲基纤维素钠可食膜、淀粉-壳聚糖-甲基纤维素可食膜表面和断面进行初步分析,扫描电镜照片如图8所示。

图8 纯壳聚糖膜(a)、淀粉-壳聚糖-羧甲基纤维素钠膜(b)、淀粉-壳聚糖-甲基纤维素膜(c)的扫描电镜照片(表面)
由图8可以看出,膜a和膜c表面均较光滑致密平整,所以甲基纤维素和淀粉、壳聚糖之间相容性较好。纯壳聚糖膜中的部分杂质可能是由于壳聚糖溶液过滤时,没有过滤完全,以致有少量壳聚糖固体残留。而膜b表面较粗糙。从肉眼直接观察看到的是3种膜都比较均匀平整。

图9 纯壳聚糖膜(a)、淀粉-壳聚糖-羧甲基纤维素钠膜(b)、淀粉-壳聚糖-甲基纤维素膜(c)的扫描电镜照片(断面)
在图9中,3种膜断面纹理清晰,虽然膜断面凸凹不平,但没有出现分层。以上说明,淀粉-壳聚糖-羧甲基纤维素钠膜及淀粉-壳聚糖-甲基纤维素膜有很好的相容性,并且各组分之间存在相互作用。
2.2.3 热重分析
由图10中可以看出,羧甲基纤维素钠、壳聚糖二者开始分解的温度相差不大,这主要是由纤维素与壳聚糖相似的结构决定的。羧甲基纤维素钠(图10b)开始分解的温度为233.98℃,分解速率在275.92~298.86℃内最大;壳聚糖粉末(图10a)开始分解的温度为210.65℃,分解速率在262.28~320.31℃内最大;淀粉粉末(图10c)开始分解的温度为258.16℃,其主要分解温度在288.19~328.57℃的范围内最大。羧甲基纤维素钠-淀粉-壳聚糖复合膜(图10d)开始分解的温度为86.80℃,其主要分解温度在130.10~313.17℃内,且其分解曲线在232.89℃处有明显的转折。结合四者的曲线图可以看出,在258.16~313.17℃内,壳聚糖粉末、淀粉粉末、羧甲基纤维素钠粉末的失重率均大于淀粉-壳聚糖-羧甲基纤维素钠膜,这说明羧甲基纤维素钠与淀粉、壳聚糖分子之间存在着较强的相互作用,这种作用是复合膜失重率较小的主要原因,而且复合膜分解完全时的温度介于壳聚糖、淀粉、羧甲基纤维素钠之间,且在232.89℃处失重的转折点也说明了羧甲基纤维素钠和淀粉、壳聚糖三者之间有强相互作用。
图11中甲基纤维素(图11b)开始分解温度为232.56℃,分解速率在294.61~378.40℃内最大;三元共混膜(图11d)开始分解的温度为76.65℃,其主要分解温度在139.84~351.59℃内,且其分解曲线在220.31℃处有明显的转折。结合四者的曲线图可以看出,在258.16~351.59℃内,壳聚糖、淀粉、甲基纤维素的失重率均大于三元共混膜,这说明甲基纤维素与淀粉、壳聚糖分子之间也存在着较强的相互作用,这种作用是甲基纤维素-淀粉-壳聚糖复合膜失重率较小的主要原因。

图10 壳聚糖(a)、羧甲基纤维素钠(b)、淀粉(c)和三元共混膜(d)的热重曲线

图11 壳聚糖(a)、甲基纤维素(b)、淀粉(c)和三元共混膜(d)的热重曲线
3 结论
(1)加入羧甲基纤维素钠使可食膜的抗拉强度有所下降,而伸长率却明显增大;加入甲基纤维素使可食膜的抗拉强度显著增大,而伸长率的变化并不大。羧甲基纤维素钠或甲基纤维素的加入都增大了淀粉-壳聚糖膜的水蒸气透过量,羧甲基纤维素钠的影响更大。复合膜的透明性随着羧甲基纤维素纳和甲基纤维素的加入而下降。2种可食膜均在稀酸中缓慢水解,在浓酸中不溶解;在碱液中吸湿卷曲,但不溶解。
(2)淀粉-壳聚糖-羧甲基纤维素膜与淀粉-壳聚糖-甲基纤维素膜对金黄色葡萄球菌和大肠杆菌都有明显的抗菌性,而且对前者的抗菌性明显优于后者。
(3)X射线衍射及热重分析结果表明可食膜中羧甲基纤维素钠、淀粉、壳聚糖及甲基纤维素、淀粉、壳聚糖有较强的相互作用;扫描电镜结果表明淀粉-壳聚糖-纤维素衍生物可食膜表面较均匀平整,断面无分层,说明各组分间相容性较好。
[1] 郑连英,朱江峰,孙昆山.壳聚糖的抗菌性能研究[J].材料科学与工程,2000,18(2):22-24.
[2] 赵国华,郑刚,刘丽丹,等.抗菌木薯淀粉可食膜的研究[J].食品与发酵工业,2010,36(4):84-87.
[3] 马浩,郑长青,李毅群.纤维素/壳聚糖复合膜的制备及结构表征[J].纤维素科学与技术,2010,18(2):33-37.
[4] 岳晓华,沈月新,寿霞,等.壳聚糖-甲基纤维素复合膜的制作研究与性能测定[J].农产品加工·学刊,2005,34(3):28 -30,34.
[5] 田春美,钟秋平.木薯淀粉/壳聚糖可食复合膜的制备及性能研究[J].食品研究与开发,2006,27(7):25-29.
[6] 邵自强,王飞俊,谭惠民,等.纤维素与壳聚糖混合体系膜的性能研究[J].纤维素科学与技术,2002,10(1):8-11.
[7] 王群,杜予民,樊李红,等.壳聚糖-淀粉-苯甲酸钠三元共混膜的结构和性能[J].武汉大学学报:理学版,2003,49(6):725 -730.
[8] 刘邻渭,陈宗道,王光慈.可食性甲基纤维素膜的制作及性质研究[J].食品工业科技,1995(5):7-9.
[9] Park S Y,Marsh K S,Rhim J W.Characteristics of different molecular weight chitosan films affected by the type of organic solvents[J].Journal of Food Science,2002,67(1):194-197.
[10] Jong-Whan Rhim,Seok-In Hong,Hwan-Man Park,et al.Preparation and characterization of chitosan-based nanocomposite films with antimicrobial activity[J].Journal of Agricultural and Food Chemistry,2006,54(16):5 814-5 822.
