氮源对2株海洋微藻生长及脂肪酸合成的影响*
2012-01-12吴伟伟隆小华刘兆普高影影王长海
吴伟伟,隆小华,刘兆普,高影影,王长海
(南京农业大学资源与环境科学学院江苏省海洋生物学重点试验室,江苏南京,210095)
三角褐指藻(Phaeodactylum tricornutum)与扁藻(TetraselmisChui)是分别属于羽纹硅藻(Pennate)和绿藻门(Chlorophyceae)的2种不同种类的海洋微藻,均具有适应性强、易于培养和含油量高等特点,尤其是在生长过程中其细胞内可大量积累多种高不饱和脂肪酸(polyunsaturated fatty acids,PUFAs)[1]。
氮源对海洋微藻的生长与脂肪酸合成过程具有重要的影响。为了进一步提高三角褐指藻与扁藻的产脂肪酸能力,探讨氮源对其生长和生产脂肪酸能力的影响,本试验选取了NaNO3、NH4Cl和尿素等3种氮源,较详细地研究其对三角褐指藻和扁藻生长、叶绿素含量、可溶性糖、可溶性蛋白、细胞干重及总脂的影响,着重分析了不同氮源对2种微藻脂肪酸组成及含量的影响,为进一步确定2株微藻的最适氮源和氮源利用方式提供基础[2]。
1 材料与方法
1.1 藻种
三角褐指藻(Phaeodactylum tricornutum)、扁藻(TetraselmisChui),藻种购自中科院青岛海洋研究所微藻种质库,经江苏省海洋生物学重点试验室分离纯化后备用。
1.2 培养条件
试验采用人工海水(称取31 g的海盐,溶于1 L蒸馏水中,配制成盐度为3.1%的人工海水),经脱脂棉过滤,高温高压灭菌20 min,并分别以 NaNO3、尿素、NH4Cl为氮源的F/2作为基础培养基。试验在500 mL三角瓶中进行,培养体积为250 mL,每个处理3个平行组。培养温度为(20±1)℃,光暗比为14∶10(光照强度为2500 lx)。每天定时摇瓶2~3次,随机变换三角瓶的位置。
1.3 微藻生物量的测定与收获
分别利用显微镜计数和分光光度计测定微藻细胞个数与培养液的吸光值,依据多天的测定结果得出2株微藻生物量(细胞密度)与吸光值之间的线性关系。微藻的相对生长速率计算:
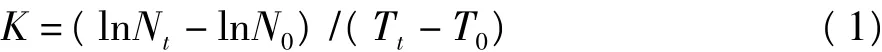
其中,N0是起始时藻液的吸光值;Nt是收获时藻液的吸光值[3]。
在指数生长期末期,利用超速冷冻离心机5 000 r/min离心15 min收集藻液,冷冻干燥,将得到的藻粉置于超低温冰箱中保存,以备测脂肪酸。
1.4 叶绿素测定
取相同体积指数生长末期的藻液,利用超速冷冻离心机于5 000 r/min离心15 min后加入等体积丙酮,黑暗条件下放置24 h,后于4 000 r/min下离心10 min,取上清液于645 nm和663 nm测OD值,计算叶绿素质量浓度(mg/L)[4]。
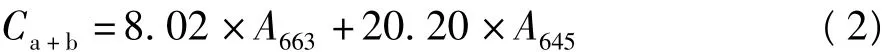
1.5 可溶性糖和可溶性蛋白测定
可溶性糖含量采用蒽酮比色法[5];可溶性蛋白含量采用考马斯亮蓝G-250染色法测定[5]。
1.6 干重
取一定体积指数生长末期的藻液,利用超速冷冻离心机,5 000 r/min离心15 min,弃上清液,后经冷冻干燥称重。
1.7 总脂
经冷冻干燥后的藻液,采用Bligh&dyer的方法提取脂质[6-7];后经真空蒸发后计算粗脂肪的含量[6]。
1.8 脂肪酸组成的气相色谱分析
向提取得到的脂质中加入1~2 mL的0.4 mol/L KOH-CH3OH溶液,40℃水浴10 min后加入2 mL正己烷,再将样品转移至10 mL具塞量筒中,加水至顶端,振荡后静置至溶液分层,取上层有机相进行气相色谱分析[8]。采用Agilent7890气相色谱仪,氢火焰离子化检测器,HP-5柱子,升温程序:170℃保持5 min,以5℃/min升至250℃,保持10 min。进样口,检测器的温度为250℃。载气为高纯度氮气,流速为90 mL/min,进样量1 μL。脂肪酸甲酯标准品为Simga 公司产品[6,8]。
1.9 数据统计分析
试验所有数据用平均值±标准差(x±s)表示,采用Excel 2003和SPSS16.0软件进行统计分析。
2 结果与分析
2.1 氮源对三角褐指藻和扁藻生长的影响
对2株微藻细胞密度与吸光值之间进行回归分析,得到二者的线性关系式,三角褐指藻为:Y=117.82×104X+529.25×104(R2=0.998 6),其中X为藻液吸光值A656,Y为藻细胞密度;扁藻为:Y=161.85×104X-105.24×104(R2=0.997 9),其中X为藻液吸光值A682,Y为藻细胞密度。可见,在本试验范围内,三角褐指藻及扁藻的细胞密度与吸光值均呈线性相关,可利用藻液的吸光值表示微藻的生长情况。
3种氮源对三角褐指藻相对生长速率的影响依次为:尿素>NaNO3>NH4Cl,且差异性显著;其中尿素对三角褐指藻生长的影响最大,生物量最高(图1)。
3种氮源对扁藻相对生长速率的影响依次为:NH4Cl>尿素>NaNO3;即NH4Cl对扁藻生长的影响最大,但是彼此间的差异性不显著(图2)。

图1 不同氮源对三角褐指藻吸光值(A)和相对生长速率(B)的影响

图2 不同氮源对扁藻吸光值(A)和相对生长速率(B)的影响
2.2 氮源对三角褐指藻和扁藻叶绿素含量的影响
从图3可知,氮源对2株海洋微藻叶绿素含量影响差异性显著。尿素为氮源时,三角褐指藻的叶绿素含量达到最大,依次为NaNO3,NH4Cl;其叶绿素含量分别下降了22.7%和43.0%(图3)。扁藻以NH4Cl为氮源时,获得最大的叶绿素含量,依次为尿素,NaNO3;其叶绿素含量分别下降了5.1%和11.5%(图4)。

图3 不同氮源对三角褐指藻叶绿素含量影响
2.3 氮源对三角褐指藻和扁藻可溶性糖、可溶性蛋白含量的影响
从图5可知,尿素为氮源时,三角褐指藻的可溶性糖含量达到最大,依次为NaNO3,NH4Cl;其可溶性糖含量分别下降了3.3%和6.0%,且差异性显著(图5A)。尿素为氮源时,三角褐指藻可溶性蛋白含量达到最大,依次为NH4Cl,NaNO3;其可溶性蛋白含量分别下降了2.9%和21.3%。尿素与NH4Cl为氮源时,对三角褐指藻可溶性蛋白含量影响差异不显著(图5B)。
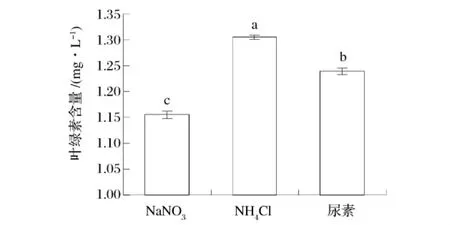
图4 不同氮源对扁藻叶绿素含量的影响
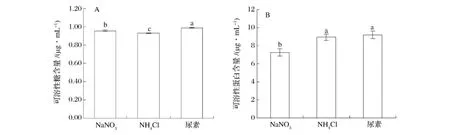
图5 不同氮源对三角褐指藻可溶性糖(A)和可溶性蛋白(B)含量的影响
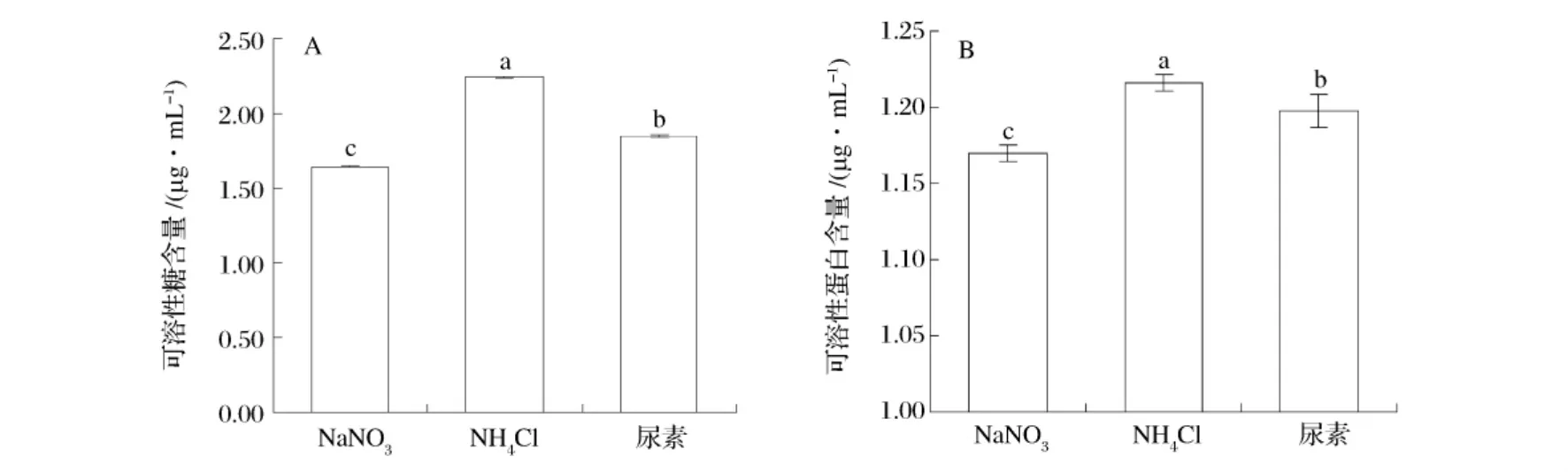
图6 不同氮源对扁藻可溶性糖(A)和可溶性蛋白(B)含量的影响
从图6可知,NH4Cl为氮源时,扁藻的可溶性糖和可溶性蛋白含量均达到最大,依次为尿素和NaNO3;其可溶性糖分别下降了17.6%和26.8%,可溶性蛋白分别下降了1.5%和3.8%。氮源对扁藻可溶性糖及可溶性蛋白含量的影响差异性均显著。
2.4 氮源对三角褐指藻和扁藻干重、总脂含量的影响
以尿素为氮源,三角褐指藻的干重达到了最大量,为 1.21 g/L,其次为 NaNO3,NH4Cl,其干重分别下降了5.0%和10.0%(图7A)。NH4Cl为氮源的时候,三角褐指藻的总脂达到了最大量,为47.5%,其次为NaNO3,尿素,分别下降了27.7%,36.2%,且差异性显著(图7B)。
NH4Cl为氮源的时候,扁藻的干重达到了最大量,为0.89 g/L,依次为尿素,NaNO3;其干重分别下降了21.3%和30.3%(图8A)。NaNO3为氮源的时候,扁藻的总脂达到了最大量为 38.5%,依次为 NH4Cl,尿素,但差异性不显著(图8B)。

图7 不同氮源对三角褐指藻干重(A)和总脂(B)的影响
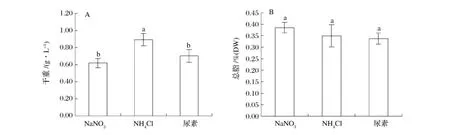
图8 不同氮源对扁藻干重(A)和总脂(B)的影响
2.5 氮源对三角褐指藻和扁藻脂肪酸组成与含量的影响
气相色谱数据分析表明,以尿素为氮源时,三角褐指藻的脂肪酸种类增多,但脂肪酸总量减少。3种氮源培养条件下,三角褐指藻的总单不饱和脂肪酸(TMUFA)含量均大于饱和脂肪酸(TSFA)和多不饱和脂肪酸含量(TPUFA)。NH4Cl为氮源时,三角褐指藻总脂肪酸的百分比达到最大,为39.59%,且TMUFA﹥TSFA﹥TPUFA,占总脂肪酸的百分比分别为:17.64%、12.10%、9.85%。以 NaNO3为氮源时,其总脂肪酸的百分比为21.57%,且TMUFA﹥TSFA﹥TPUFA,占总脂肪酸的11.59%、8.41%、1.57%。以尿素为氮源时,其总脂肪酸的百分比为15.28%,且TMUFA﹥TPUFA﹥TSFA,占总脂肪酸的百分比依次为12.69%、2.47%、0.12%。
NaNO3为氮源时,扁藻的脂肪酸种类及总量均增多,其总脂肪酸的百分比达到最大为20.82%,且TPUFA﹥TSFA﹥TMUFA,占总脂肪酸的百分比依次为10.41%、5.45%、4.96%。以NH4Cl为氮源时,其总脂肪酸的百分比为5.62%,且TSFA﹥TMUFA﹥TPUFA,占总脂肪酸的百分比依次为2.31%、2.29%、1.02%。以尿素为氮源时,其总脂肪酸的百分比为3.77%,且TMUFA﹥ TPUFA﹥ TSFA,占总脂肪酸的百分比依次为1.73%、1.39%、0.65%。氮源对不同微藻的脂肪酸组成影响不一致。
3 讨论
通常情况下微藻可以利用的氮源有铵盐、硝酸盐及尿素等,但在吸收速度与利用程度上却存在一定差异,且不同氮源对于微藻各项生理指标的影响也不同[9-10]。国内外关于氮源对微藻各项指标的影响意见并不一致,Ohmori[11]和 Guerrero[12]等先后报道了蓝藻、蓝绿藻对氨氮的吸收利用优于其它形式的氮源,认为微藻可以直接以NH+4作为合成氨基酸的原料;潘庭双等[13]发现,微绿球藻以尿素和 NaNO3作氮源效果最好,NH4Cl效果较差;王顺昌[14]等认为尿素对蛋白核小球藻生长、色素积累的效果优于氨态氮和硝酸态氮,硝酸态氮在中性脂肪积累上优于尿素氮和氨态氮。本实验表明:三角褐指藻以尿素为氮源时生长最快;扁藻以NH4Cl为氮源时生长最快。这是因为三角褐指藻细胞内具有尿素酶,使尿素可以更好的被吸收同化,且尿素不改变培养液的酸碱反应,可以保持pH值的稳定更利于微藻的生长;而扁藻细胞内可能不具有尿素酶。这说明不同微藻对不同形式氮盐喜好和利用能力存在差异。
微藻的色素积累受多种环境因素的影响,如光照、温度等,其中氮源也是影响色素积累的因素之一,当培养液中氮源不足时,会导致叶绿素含量的降低[15]。我们的研究表明,三角褐指藻以尿素为氮源时叶绿素积累量达到最大;扁藻以NH4Cl为氮源时叶绿素积累量达最大,且3种氮源对两种海洋微藻叶绿素积累的影响差异性显著。这与氮源对微藻生长的影响结果一致。
本试验结果表明,三角褐指藻以尿素为氮源时可溶性糖、可溶性蛋白含量达到最大,以NH4Cl为氮源时总脂含量达到最大。扁藻以NH4Cl为氮源时可溶性糖、可溶性蛋白含量达到最大;以NaNO3为氮源时总脂含量达到最大。由于糖、蛋白质对微藻生长至关重要,其要增殖必须积累糖类和蛋白质,相对而言总脂的合成量会降低。
[1] Bowler C,Allen A E,Badger J H,et al.The phaeodactylum genome reveals the evolutionary history of diatom genomes[J].Nature,2008,456(7 219):239 - 244[DOI].
[2] 王长海,刘赵普.海洋生化工程原理[M].北京:化学工业出版社,2011:10-13.
[3] 蒋霞敏,柳敏海,邢晨光,等.不同生态条件对绿色巴夫藻生长与脂肪酸组成的影响[J].水生生物学报,2007,31(1):88-93.
[4] 汤章城,魏家绵,陈因,等.现代植物生理学试验指南[M].北京:科学出版社,1999.
[5] 李合生.植物生理生化试验原理与技术[M].北京:高等教育出版社,2000:184-196.
[6] 蒋冰飞.环境因子对球等鞭金藻生长和脂肪酸合成的影响[D].大连:大连理工大学,2006.
[7] Lee J Y,Yoo C,Jun S Y,Ahn C Y,Oh H M.Comparison of several methods for effective lipid extraction from microalgae[J].Bioresource Technology,2010(11):75 -77.
[8] 程远月,郑爱榕,李文权,等.海洋胶体中的氮、磷和铁对微藻脂肪酸组成和含量的影响[J].厦门大学学报,2004,43(5):682 -687.
[9] 张诚,邹景忠.尖刺拟菱形藻吸收动力学以及氮磷限制下的增殖特征[J].海洋与湖沼,1997,28(6):599-603.
[10] 吕颂辉,陈翰林,何智强.氮磷等营养盐对尖刺拟菱形藻生长的影响[J].生态环境,2006,15(4):697-701.
[11] Ohmori M,Ohmori K,Strotman H.Inbibition of nitrate up take by ammonia in a blue-green alga,Anabaena cylindrica[J].Archives of Microbiology,1977(114):225-229.
[12] Guerrero M G,Vega J M,Losada M.The assimilatory nitrate reducing system and its regulation[J].Annual Review of Plant Physiology,1981(32):169-204.
[13] 潘庭双,胡贤江,侯冠军,等.氮对微绿球藻生长的影响[J].安徽农业科学,2001,29(4):548-555.
[14] 王顺昌,王陶,赵世光,等.不同氮源对蛋白核小球藻生长、色素和中性脂肪积累的影响[J].激光生物学报,2008,17(2):197 -201.
[15] 韦金河,汪廷,宁运旺,等.不同氮、碳源对蛋白核小球藻培养液pH值的影响[J].江苏农业学报,2004,20(1):63-64.
[16] Kolber Z S,Zehr J,Falkowski P G.Effects of growth irradiance and nitrogen limitation on photosynthetic energy conversionin photosystemII[J].Plant Physiol,1988,88:923-929.
