合成嗜热酸性淀粉酶的毕赤酵母表达*
2012-01-12柯涛熊蓝张乃群马向东惠丰立牛秋红杨果
柯涛,熊蓝,张乃群,马向东,惠丰立,牛秋红,杨果
1(南阳师范学院生命科学与技术学院,河南南阳,473061)2(湖北大学生命科学学院,湖北武汉,430062)
α-淀粉酶(1,4-α-D-葡萄糖苷葡萄糖苷水解酶,EC 3.2.1.1)为内切型淀粉酶,从淀粉内部水解1,4-α-D-葡萄糖苷键。广泛应用在淀粉糖品生产、发酵、纺织等行业。是目前用途最广的一种酶制剂[1]。
发酵工业中对淀粉原料的加工工艺广泛使用双酶法,α-淀粉酶需要与糖化酶配合使用,依次对淀粉原料进行液化和糖化处理。液化过程现广泛采用喷射液化,淀粉大颗粒经喷射液化器,在105~110℃的高温下胶化,而整个过程中pH值控制是另一个关键因素。淀粉糊的自然pH值为3.5~4.2,糖化酶的最适pH也在酸性范围(4.5~4.0),因此,超耐热酸性α-淀粉酶替代常用的芽孢杆菌中性淀粉酶应用到液化过程,可以避免pH的反复调节,同时可以降低能耗、提高转化率、简化工艺、减少环境污染,使产品产量和质量大大提高[2-4]。
对耐热淀粉酶的研究目前以嗜热古菌淀粉酶基因为研究热点,因为它们能在酸性环境、80~110℃的环境下生长良好,产生的耐热酶在高温和酸性条件下具有很好的稳定性,而细菌来源的淀粉酶无法满足pH的要求[5-6]。目前已发现来源于嗜热古菌的 α-淀粉酶基因已有30多个[7-8],但并不是所有基因都能符合现行工艺要求。其中最适温度在95℃以上,pH5.0以下且基因已经被克隆的酸性α-淀粉酶只有来自Pyrococcus furiosus的高温酸性淀粉酶基因得到深入的研究[9],国内对高温酸性淀粉酶的研究也大多集中在这个基因的表达上[10-11]。但现有基因还不能完全满足生产的要求,因此,进一步开发嗜热古菌淀粉酶基因资源是首要解决的问题。
Richardson等从环境微生物DNA文库中克隆到一系列可能来源于一种嗜热球菌属(Thermococcus)的高温酸性α-淀粉酶基因,并通过定向进化技术筛选到几个高温酸性α-淀粉酶的人工突变体,在荧光假单胞 菌 Pseudomonas fluorescens中 表达[3]。其 中BD5088基因最适pH 4.5,最适温度95℃,活性不依赖于Ca2+存在,是一种高温酸性α-淀粉酶,从热稳定性、最适pH和最适温度等酶学特性综合比较,其综合性质均优于其他突变体基因[12],具有较大的应用潜力。
为了能达到生产的目的,本研究将密码子优化改造后的人工合成耐热酸性α-淀粉酶基因BD5088在毕赤酵母中表达,获得重组产物PrBD5088,并比较其与前期研究中相同基因在大肠杆菌原核表达产物ErBD5088 的酶学性质差异[13]。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与质粒
pPIC9K质粒、大肠杆菌 DH5α、受体菌 Pichia pastoris GS115细胞为本实验室保存。
1.1.2 培养基
大肠杆菌的培养和转化使用LB培养基。酵母的培养、转化、筛选和诱导表达使用YPD、MD、BMGY及BMMY等培养基,见Invitrogen公司毕赤酵母操作手册。鉴定淀粉酶活性的培养基是在BMMY培养基的基础上添加1%淀粉和0.01%曲利苯兰[14]。
1.1.3 试剂
限制性内切酶、T4DNA连接酶、Pyrobest DNA聚合酶、回收试剂盒、抗生素、DNA marker、蛋白质分子量标准,及其他化学试剂均购自宝生物工程(大连)有限公司,PCR引物合成和测序由上海Sangon公司完成。
1.2 方法
1.2.1 分子克隆技术和表达产物的SDS-PAGE分析
参照文献[15]进行。
1.2.2 PCR引物合成和基因扩增
设计 引 物 P1、P2(5 '-GAATTCATTTGGTGGGACACGATTAGACA-3 ';5 '-GCGGCCGCACCAACACCACAGTAAGACCAAAC-3')扩增α-淀粉酶基因不含信号肽的结构基因。PCR扩增条件:94℃ 60 s,55℃ 60 s,72℃ 60 s,30 个循环。
1.2.3 重组质粒pPIC9K-BD5088的构建及转化
以质粒 pET-BD5088[13]为模板,以 P1、P2 为引物,进行PCR扩增,扩增产物经过EcoRI,NotI双酶切连接至pPIC9K。用PCR、Bgl II酶切鉴定是否有外源基因的插入。重组质粒用Sal I酶切,回收大片段,经电转化法转化到GS115中,涂MD平板,30℃培养。将用重组质粒转化的转化子定义为GS115/pPIC9KBD5088,同时用不含外源基因的pPIC9K质粒的转化反应做对照,将其转化子定义为GS115/pPIC9K(对照转化子)。
1.2.4 含BD5088基因的重组毕氏酵母菌株的筛选
挑取转化子单菌落到BMGY平板上培养48 h,然后再点接到含有1%淀粉的BMMY平板上,甲醇诱导(每块平板每24 h补加250 μL甲醇),通过单菌落在平板上产生的水解圈的大小来筛选重组毕赤酵母。
1.2.5 外源基因的诱导表达
将1株重组酵母转化子GS115/pPIC9K-BD5088和GS115/pPIC9K按高密度摇瓶方式培养,挑取待表达的重组毕赤酵母单菌落于BMGY液体培养基,30℃,280 r/min,摇床培养至对数期(OD600=2~6),转接1 mL培养液至100 mL BMGY液体培养基,30℃,280 r/min摇床培养至OD600达到20~30。室温4 000 r/min离心5 min,收集菌体,去上清,细胞沉淀全部转移至100 mL BMMY液体培养基中,25℃,280 r/min摇床培养。每隔24 h补加100%甲醇至终浓度为1%。每隔24 h取样1 mL分析表达水平,以确定最佳诱导时间。
1.2.6 重组蛋白的SDS-PAGE分析和淀粉酶的活性染色
发酵液离心后取上清液,分离胶浓度为12%的SDS-PAGE电泳分离诱导产物,在分离胶中含有0.2%的可溶性淀粉。并用BandScan软件分析重组蛋白表达量。电泳完毕后用酶活性测定缓冲液室温振荡洗胶1 h,更换新鲜缓冲液后37℃保温过夜,将胶放入稀碘液显色,在蓝紫色背景可显现酶蛋白降解淀粉形成的反白色条带。
1.2.7 α-淀粉酶活力测定方法
纯化后酶液用YOO改良法[16]测定酶活性。酶活性单位定义为在最适反应条件下,每分钟水解1 mg的淀粉所需的酶量。
1.2.8 α-淀粉酶酶学性质研究
分别在30~100℃下测定活性确定其作用的最适温度。分别在pH3.0~8.0的条件下测定酶活性,确定其作用的最适pH。向活性测定缓冲液中添加不同浓度的Ca2+、Cu2+和Zn2+,确定它们对活性的影响。分别在不同温度、pH5.6条件下测定酶活性,确定其作用的最适温度。将酶液在100℃条件下分别处理不同时间,冰浴后再测定残留酶活性,评价酶的热稳定性。所有数据均为3次重复数据。
2 结果与分析
2.1 重组质粒pPIC9K-BD5088的构建和鉴定
根据毕赤酵母的密码子偏好性,经密码子优化设计,用基因合成法合成了来源于极端嗜热古菌Thermococcus sp.中的超耐热酸性 α-淀粉酶的基因BD5088,构建到原核表达载体pET-30a(+),获得质粒 pET-BD5088[13]。以 pET-BD5088 为模板,通过PCR反应得到了1.3 kb左右的DNA片段,与酶切后的pPIC9k质粒进行连接,将连接产物转化大肠杆菌DH5α感受态细胞,碱法提取质粒。BglⅡ酶切质粒,产物约为1.8 kb和7.7 kb的两个片段(图1A),而对照质粒酶切后只有一条带。同时使用P1,P2引物进行PCR扩增,结果获得大小约为1.3 kb的产物(图1B),进一步的测序结果表明,BD5088基因已正确插入。获得的重组质粒命名为pPIC9K-BD5088。

(A)M:DNA Marker λ-EcoT14;1:pPIC9K 酶 切 产 物;2:pPIC9K-BD5088 酶切产物;(B)M:DNA Marker λ-EcoT14;1:pPIC9K-BD5088 PCR扩增产物
2.2 含BD5088基因的重组毕氏酵母的筛选
用SalⅠ酶切重组质粒pPIC9K-BD5088,使之线性化后转化毕赤酵母GS115,先涂于MD平板培养48 h,然后再转接到含有1%淀粉的BMMY平板上,甲醇诱导,部分菌落周围出现明显水解圈(图2)。

图2 BMMY淀粉平板鉴定菌落透明圈
2.3 酵母转化子基因组PCR鉴定
分别提取了以重组质粒pPIC9K-BD5088转化酵母得到的阳性转化子(GS115/pPIC9K-BD5088)的基因组、以 pPIC9K转化酵母得到的对照转化子(GS115/pPIC9K)的基因组、宿主菌毕赤酵母(GS115)的基因组。分别以这3个基因组为模板,用扩增该基因时使用的5’及3’引物进行PCR鉴定。结果以阳性转化子(GS115/pPIC9K-BD5088)基因组为模板的反应有1.3 kb左右的扩增产物出现,而以对照转化子(GS115/pPIC9k)基因组和酵母GS115基因组为模板的反应均无扩增产物出现,可以证明酵母阳性转化子(GS115/pPIC9K-BD5088)基因组中已整合了α-淀粉酶基因(见图3)。
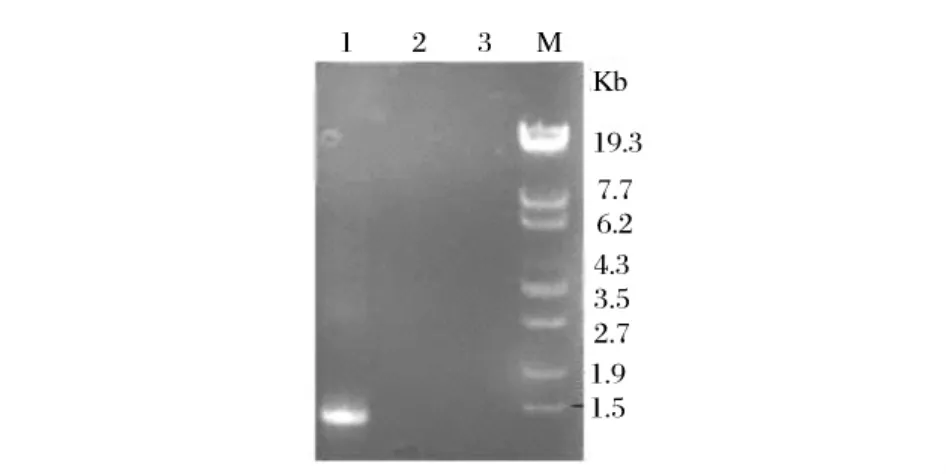
图3 酵母转化子基因组PCR鉴定
2.5 BD5088在毕氏酵母中的诱导表达和SDSPAGE分析
重组质粒与酵母细胞发生同源重组后可将外源基因整合到酵母染色体AOX1基因位点上去,该外源基因的表达受甲醇的严格调控和诱导。每隔24 h取样1 mL,测定ɑ-淀粉酶活性,结果表明,在诱导培养的前3 d~5 d内,单位发酵液中的酶活力随时间的增加基本上呈线性关系,在诱导后的第5 d分泌到培养液的酶活性最高(图4)。第6 d后开始下降。

图4 诱导时间与酶活性的关系曲线
将重组酵母GS115/pPIC9K-BD5088和对照转化子GS115/pPIC9K诱导培养6 d,收集上清液,用于SDS-PAGE分析表达水平(图5A)。用BandScan软件扫描分析表明其表达量可达到约200 mg/L。将大肠杆菌表达的ErBD5088产物与毕赤酵母表达的重组酶PrBD5088进行比较,发现PrBD5088分子量约为55~60 ku,大于实际分子量48 ku。该蛋白可能由于受到糖基化的修饰,所以其电泳表观分子量大于实际分子量。考虑到BD5088的肽链中不存在能够形成N-连接的任何潜在糖基化位点(Asn-X-Ser/Thr,X是任意氨基酸),推测毕赤酵母表达的PrBD5088为O-连接的糖基化蛋白。活性染色结果显示,与PrBD5088条带相应位置有一条亮带,表明表达的产物具有淀粉酶水解活性(图5B)。

(A)M:分子量标准;1:GS115/pPIC9K诱导表达后上清液;2~5:GS115/pPIC9K-BD5088诱导表达后上清液;(B)M:分子量标准;1:ErBD5088;2:PrBD5088;3:PrBD5088活性PAGE染色分析
2.6 PrBD5088酶学性质测定及其比较
在pH5.6的条件下,分别在30~100℃的条件下,测定PrBD5088的酶活力,如图6所示,该酶的最适反应温度为90℃,和ErBD5088相比,其最适反应温度提高10℃。在80~95℃之间PrBD5088相对酶活保持在90%以上,在60~98℃相对酶活可保持在70%以上,而ErBD5088为65~85℃。

图6 温度对重组淀粉酶PrBD5088和ErBD5088的影响
在90℃条件下,分别在pH3~8的条件下,测定PrBD5088的酶活力,如图7所示。该酶的最适pH为5.6,与 ErBD5088相同,但 PrBD5088的 pH范围更宽,在pH5.0~6.5,相对酶活在90%以上,在pH4.0~8.0,内酶活性保留50%以上,而ErBD5088则只在pH5.0~7.0能维持活性的50%以上。
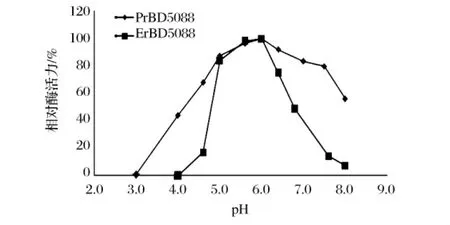
图7 pH值对淀粉酶BD5088的影响
在活性测定缓冲液中加入不同浓度的ZnCl2、CuSO4、CaCl2进行酶活性测定,结果表明:随着Cu2+浓度增加,PrBD5088活性逐渐得到抑制;Ca2+和Zn2+对维持rBD5088活性和稳定性会产生轻微促进作用(图8)。
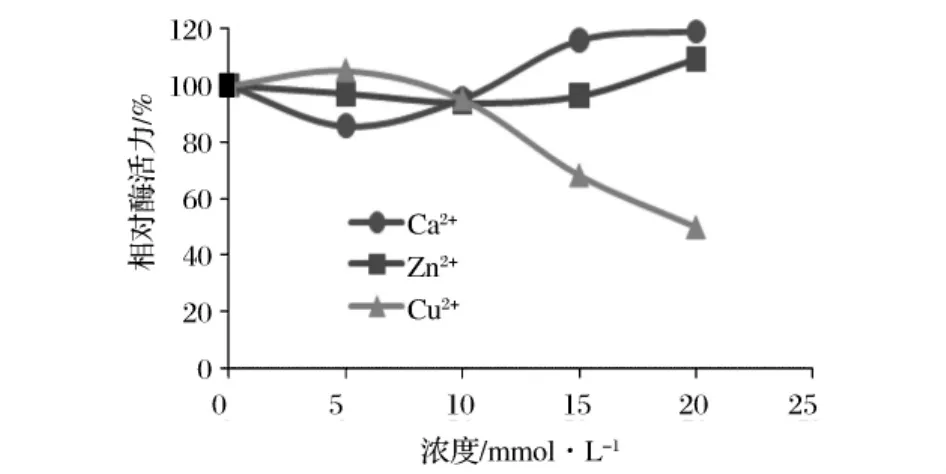
图8 金属离子对PrBD5088酶活力的影响
对超高温淀粉酶BD5088进行热稳定性分析,分别在100℃条件下,对酶加热 5、10、20、30、60 min,然后在90℃下测其酶活(图9),在100℃条件下加热60 min,酶活性仍可维持在原活性的80%以上,说明该酶有很好的热稳定性,并远高于 ErBD5088。ErBD5088相同条件下的半衰期只有20 min。

图9 重组淀粉酶PrBD5088和ErBD5088的热稳定性
糖基化作用一般会增加酶的热稳定性,本研究发现O-连接的糖基化对重组α-淀粉酶PrBD5088的热稳定性和最适作用温度有影响。与该基因在E.coli表达的α-淀粉酶BD5088相比,100℃条件下热稳定性有显著的提高。
3 讨论
来源于Thermococcus sp.的α-淀粉酶由于其具有的耐热及耐酸性质近来受到关注。由于极端嗜热菌的密码子偏好性与常温菌差别很大,其中含有的大量的稀有密码子,直接影响了这些蛋白在酵母菌中的表达水平。本研究利用人工合成方法,用毕赤酵母常用密码子替换原有稀有密码子,实现了密码子优化后的基因BD5088在毕氏酵母中的高效表达。该工程菌株表达产生的重组α-淀粉酶可以有效分泌到胞外,具有良好的热稳定性、耐热耐酸性,并远优于原核表达的重组酶,在酸性环境更加稳定。通过对酵母转化子表达产物上清液蛋白SDS-PAGE分析,表达产生的蛋白表观分子量超过理论分子量,原因可能是表达的外源蛋白经过糖基化修饰而造成分子量的增加[17]。因此本重组菌株可以为工业化生产提供有价值的参考。
另外,由于PrBD5088其热稳定性和活力均不需Ca2+的保护,所以在液化的过程中无需添加Ca2+,也不用在下游的工艺中去除Ca2+,可以简化生产工序,降低生产成本。
[1] Van der maarel M J,van der veen B,uitdehaag J C,et al.Properties and applications of starch-converting enzymes of the α-amylase family [J].J Biotechnol,2002,94(2):137-155.
[2] Suganuma T,fujita K,kitahara K.Some distinguishable properties between acid-stable and neutral types of α-amylases from acid-producing koji[J].J Biosci Bioeng,2007,104(5):353-362.
[3] Richardson T H,Tan X,Frey G,et al.A novel,high performance enzyme for starch liquefaction:discovery and optimization of a low pH,thermostable alpha-amylase[J].J Biol Chem,2002,277(29):26 501-26 507.
[4] Shaw A,Bott R,Day A G.Protein engineering of alphaamylase for low pH performance[J].Curr Opin Biotechnol,1999,10(4):349 -352.
[5] Vieille C,Zeikus G J. Hyperthermophilic enzymes:sources,uses,and molecular mechanisms for thermostability[J].Microbiol Mol Biol Rev,2001,65(1):1-43.
[6] Li W F,Zhou X X,Lu P.Structural features of thermozymes[J].Biotechnol Adv,2005,23(4):271 -281.
[7] http://www.cazy.org/GH13_archaea.html
[8] Lévêque E,Haye B,Belarbi A.Cloning and expression of an alpha-amylase encoding gene from the hyperthermophilic archaebacterium Thermococcus hydrothermalis and biochemical characterisation of the recombinant enzyme[J].FEMS Microbiol Lett,2000,186(1):67 -71.
[9] Laderman K A,Asada K,Uemori T,et al.Alpha-amylase from the hyperthermophilic archaebacterium Pyrococcus furiosus.Cloning and sequencing of the gene and expression in Escherichia coli[J].J Biol Chem,1993,268(32):24 402-24 407.
[10] 韦宇拓,汪嵘,杜丽琴,等.合成耐高温α-淀粉酶基因在巴斯德毕赤酵母中的分泌表达[J].中国生物工程杂志,2005,25(1):65-69.
[11] 郝帅,郭建强,李运敏,等.超耐热酸性α-淀粉酶基因在多型汉逊酵母中表达及与在毕赤酵母中表达的比较研究[J].菌物学报,2006,25(4):573-578.
[12] 袁铁铮,姚斌,罗会颖,等.一种高温酸性α-淀粉酶基因的高效表达和表达产物分析[J].高技术通讯,2005,15(11):63-68.
[13] 柯涛,熊兰,石晴芳,等.嗜热古菌高温酸性淀粉酶基因合成和大肠杆菌中的表达[J].食品与发酵工业,2008,34(10):30-33.
[14] 马向东,柯涛,熊兰,等.一种鉴定多糖水解酶类及其产生菌的新方法[J].微生物学报,2007,47(6):1 102-1 104.
[15] Smbrook J,Fritsch E F,Maniatis T.Molecular cloning:a laboratory manual(3nd ed) [M].New York:Cold Spring Harbor Laboratory Press,2001.
[16] Yoo Y J,Hong J,Hatch R T.Comparison of alpha-amylase activities from different assay methods[J].Biotechnol Bioeng,1987,30(1):147-151.
[17] Yang X,Ongusaha P P,Miles P D,et al.Phosphoinositide signalling links O-GlcNAc transferase to insulin resistance[J].Nature,2008,451(7 181):964-969.
