中高温大曲和曲房细菌群落的相关性*
2012-01-12王涛游玲赵东冯瑞章王松冯学愚张云
王涛,游玲,赵东,冯瑞章,王松,冯学愚,张云
1(宜宾学院生命科学与食品工程学院,四川 宜宾,644000)2(发酵资源与应用四川省高校重点实验室,四川宜宾,644000)3(五粮液股份公司,四川宜宾,644000)
在我国白酒行业中,浓香型白酒产量和收入均占到了行业收入的75%以上[1]。“以麦制大曲、用大曲酿酒”是我国浓香型白酒酿造工艺中的一项传统操作技术,浓香型白酒使用的大曲主要为中高温大曲,在浓香型大曲酒的生产中用量一般为投粮量的20%~30%,它不仅为浓香型白酒发酵提供多种复合酶系、部分发酵菌种,还提供一些香味物质及香味物质的前体物质和部分发酵原料[2]。所以大曲中的微生物区系、酶系和各种物质在很大程度上决定了浓香型白酒的风味、口感及品质,也反映了大曲内在质量与大曲酒品质间存在极为密切的关系,所谓“曲者,酒之骨也”[3]。
中高温大曲的生产是以小麦为原料,自然接种,生料制坯,低温培菌,高温转化,入库贮存。由于中高温大曲在曲房中生产,因此曲房环境中的微生物群落与大曲微生物群落组成有着直接的关系。自20世纪70年代以来,国内利用经典微生物和免培养(cultureindependent)的方法对中高温大曲和曲房中的细菌群落进行了研究[4-6]。尽管这些研究在认识中高温大曲细菌群落起到了较大的作用,但对中高温大曲和制曲环境中的微生物群落较为系统的信息提供不足。
宜宾是我国浓香型大曲的主要产地,以“五粮液”为代表的宜宾多粮浓香型白酒在全国的浓香型白酒产业中占有重要地位。对宜宾中高温大曲生产中涉及的细菌开展较为系统的研究,对于探讨中高温大曲的发酵机理、改进生产工艺、稳定或提高优质大曲的产量具有重要意义。同时,这些微生物也是一类重要的生物资源,具有较为广泛潜在应用价值。
1 材料与方法
1.1 样品采集
选取宜宾6家规模以上多粮浓香型白酒生产企业采样,采样时间为2008年3~4月。曲房空气样点采样采用自然沉降法,取样平板暴露在空气中5 min;大曲样品为各企业自制中高温小麦大曲(使用曲),每个企业3块以上大曲。
1.2 培养基
采用改良牛肉膏蛋白胨培养基(NA)分离细菌、改良的高氏I号培养基分离放线菌。每1 000 mL培养基含100 mL大曲的无菌水浸提液及50 000 U制霉菌素。大曲的无菌水浸提液制备方法为曲药100 g混合后加入500 mL水,充分搅拌混匀,115℃灭菌30 min后无菌纱布过滤。
1.3 方法
1.3.1 分离
大曲整块破碎后,过30目筛(各企业的样品单独分离)。按照10倍梯度稀释的方法,每个稀释梯度涂布20个平板,30℃培养。定期观察分离平板,挑取单菌落划线纯化于常规NA或高氏I号斜面上。根据菌落的颜色、大小、突起特征、边缘特征、表面光滑与否和透明度等肉眼可辩的特征去除冗余。在分离过程中,在分离平板中加入了曲药的水浸液,尽量模拟了曲药生产相关细菌的生活环境,保证了其尽可能地被分离到。
1.3.2 DNA提取与PCR扩增
根据文献[7]方法适当修改,提取菌株基因组DNA、扩增出16S rRNA基因片段。引物27f:5'-AGAGTTTGATCTGGCTCAG-3'和1541 r:5'-AAGGAGGTGATC CAGCCGCA -3'[8]。扩增产物送上海生物工程技术服务有限公司(Sangon)纯化并测序,测序长度700-900 bp,序列GenBank序列号见图1。
1.3.3 系统发育分析
所得序列用EzTaxon server 2.0[9]在线进行相似性分析。用ClustalX按照最大同源性的原则进行比对,采用 Kimura-2[10]计算序列相似值,并用 BioEdit 5.0.9进行检验;采用Mega 4.0进行系统进化树的构建、编辑与保存。对聚在一条直线的菌株,通过ClustalX比对确定其序列相似度>99.50%后,合并成一个类群。
1.3.4 细菌酿造性能评价
细菌采用NA培养基活化24~36 h制成菌悬液(浓度108个/mL),典型丝状放线菌采用ISP2培养基平板活化48~72 h。
水解淀粉能力测定参照文献[11]中的方法适当修改进行;纤维素利用能力测定参照文献[12]进行;7%乙醇耐受能力检测、pH 4.5酸耐受能力检测参照文献[13]中的方法适当修改进行。
2 结果与分析
2.1 中高温大曲和曲房中细菌的分离
对分离得到的大量菌株通过表观特征去除冗余后,得到217株纯培养物,其中曲房中分离得到170株,大曲47株。
2.2 系统发育分析
2.2.1 曲房和曲药可培养细菌的多样性
对217株细菌的16S rRNA基因进行测序,共得到217条有效序列,经序列比对、相似性分析和系统发育分析(表1,图1)发现宜宾中高温大曲及曲房中细菌体现出较为丰富的系统发育多样性。217株细菌中有1株菌(H7B-55,分离自大曲)与数据库中近缘类群典型菌株(Bacillus horneckiae 1P01SCT)序列相似性低于97%(96.58%),可能代表新分类单位[14];其余216株与分属于16个属的52个种的典型菌株序列相似性大于97%。

表1 纯培养菌株16SrRNA基因序列的相似性分析

续表1
从中高温大曲中分离得到47株菌,除1株代表潜在新分类单位外,其余菌株分属于6个属,与14个种的典型菌株相似性大于97%。其中,属于Bacillus属的菌株有35株,占大曲分离菌株总数的77.78%,占据了绝对优势。其余各属数量较少,除Staphylococcus和 Enterobacter分别有 5株和 3株外,Arthrobacter、Exiguobacterium、Lysinibacillus均分别只有 1株菌。
从曲房分离得到的170株在16个属中均有分布,其中分属于Bacillus和Streptomyces的菌株分别有89株、37株,各占曲房空气中分离出菌株总数的52.32%、21.76%。该2属为此次分离得到的曲房空气的优势属,属于该2属的菌株共有126株,占曲房分离细菌总数的74.06%。除此2属外,属于Staphylococcus的菌株有16株、Lysinibacillus8株,其余各属菌株均在5株以下,还有7个属的均只有1株菌。
2.2.2 曲房和曲药可培养细菌群落的相似性比较
无论从得到菌株的数量还是菌株分类单位,曲房中细菌的数量都要远高于中高温大曲。从属一级分类单位来看,大曲中分离到的属在曲房中均能够被发现。但从16S rRNA基因序列的相似性分析(表1)和菌株系统发育分析(图1)来看,尽管大曲与曲房绝大多数菌株系统发育关系极为接近,但大曲中分离出的潜在新分类单位菌株H7B-55(序列号HQ832936)与所有曲房中分离出的菌株亲缘关系均较远(图1)。同时,在曲房中占据一定优势地位的Streptomyces属的菌株却在大曲中没有被分离到。

图1 曲房和大曲细菌的系统发育分析
2.3 细菌的酿造性能评价
217株菌的纤维素分解能力、淀粉水解能力、乙醇耐受和低pH耐受能力初步分析的结果如表2。
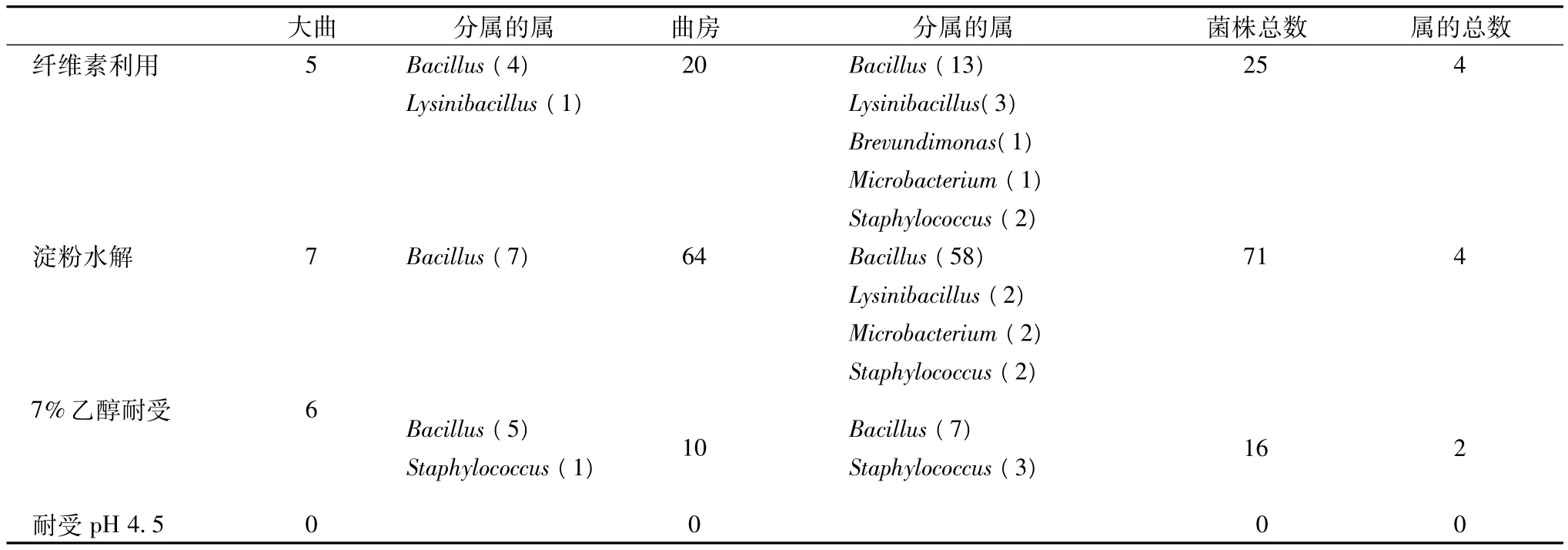
表2 细菌的酿造性能初步评价
从表2可以看出,此次分离的细菌中没有能够耐受pH 4.5的菌株。而具有纤维素分解能力、淀粉水解能力和耐受7%乙醇的菌株分别有25株、71株和16株,分别占菌株总数的11.52%、32.72%和7.37%。而且这些菌株以Bacillus属的菌株为主,能够利用纤维素的25株菌中就有17株属于该属;具备淀粉水解能力的71株菌中,该属也占到65株;耐受乙醇的16株菌中,该属也占到了12株。此外,曲房中分离得到的170株细菌中,具有淀粉水解能力的菌株达64株,占曲房菌株数的37.65%,达到了相当的比例。
无论从菌株分类单位和具体的菌株来看,大曲和曲房中具备上述3种能力之一的菌株具有高度的一致性。大曲中具有纤维素利用能力的5株菌在系统发育树(图1)上,属于类群1的有2株(序列号JF322937、JF322965),类群6、类群7和类群10各有1株(序列号分别为 HQ238926、JF322969和HQ238921),而在同样的类群中均有具有纤维素利用能力的曲房细菌(类群1:HQ238751、HQ238754;类群6:JF322990、JF322963;类群 7:HQ238830;类群10:HQ238759、HQ238829、HQ238761)。而具有淀粉水解能力的7株大曲细菌,在系统发育树上分属于类群1(HQ238925,JF322937)、类群 6(HQ238926)、类群 7(JF322976)和类群 8(JF322940,HQ238935,JF322973),而曲房中属于该4个类群的细菌具有淀粉水解能力的菌株总数达到了32株(具体菌株序列号未列出)。同样,大曲中属于Staphylococcus的1株菌位于发育树上类群2中(HQ238730),而在该类群中可以找到2株耐受乙醇的曲房细菌(HQ238737,HQ238810);其余属于Bacillus的5株大曲耐受乙醇菌株也分别与曲房耐受乙醇菌株在系统发育树上聚在不同的类群(类群1:大曲JF322937、JF322989,曲房 HQ238751、HQ238791、HQ238793;类群 5:大曲HQ238933-934, 曲 房 HQ238859、 HQ238758,JF32292;类群7:大曲 JF322976,曲房 F322929;类群8:大曲JF322960,曲房JF32292)。由于在系统发育树上,能够聚在1个类群(在树上表现为同一条直线)上的菌株的序列的相似性均在99.50%以上(经过验证),所以大曲中具备3种能力之一的菌株都能能够在曲房环境中发现与其亲缘关系极为接近(或相同)的菌株。
此外,通过菌株部分酿造性能分析,发现有些菌株具备2种以上的酿造特性,如分离自大曲的1044号菌株(序列号 JF322937)同时具备纤维素利用、淀粉水解和7% 乙醇耐受能力;分离自曲房的GB-112菌株(序列号 HQ238751)和大曲的 J9B-7(序列号JF322976)分别同时具备纤维素分解、耐受乙醇能力和淀粉水解、耐受乙醇能力。这些菌株有待于进一步的研究,以探讨它们在制曲及酿酒中应用的可能性。
3 讨论
尽管从曲房中分离得到的菌株分属于16个属,但属于Bacillus和Streptomyces属的菌株占到了74.06%。Bacillus属的菌株可产生抗逆性极强的芽孢,Streptomyces为典型丝状、产孢放线菌,它们产生芽孢或孢子可以使其种群耐受环境的不断的变化,从而得以长期延续,使大曲生产区域的细菌群落保持相对的稳定性。同时,曲房中分离到了相当比例的具有淀粉水解能力和纤维素分解能力的细菌,也表明经过长期的大曲生产,曲房中的细菌群落与大曲的生产是密切相关的。
本研究从大曲中分离得到了分属于6个属的47株菌,经系统发育分析,发现其中Bacillus属为绝对优势属,这与张明春[15]等、孟镇[6]等的研究结果是一致的。但胡佳等[16]和高亦豹等[4]在利用免培养方法研究大曲中细菌区系时均没有检测到Bacillus的存在。而本研究发现Staphylococcus为大曲中的次优势属(5株菌),这又与高亦豹等[4]的研究结果一致。同时,比较孟镇[6]、胡佳[16]和高亦豹[4]等的研究,发现他们的研究结果差异较大。出现上述情况的原因,除了因为大曲是开放式生产、自然接种,原料、环境、工艺对大曲微生物区系均有直接影响而导致不同的大曲微生物区系差异化较大外,还与纯培养和免培养研究手段自身的缺陷有关[17]。所以,在现在的技术手段下,欲充分阐明中高温大曲中的细菌群落,应大面积、长时间的采样,采用多种方法对大曲微生物进行解析。本研究中,大曲中Bacillus属的细菌占据了绝对优势,而且该属细菌也是其他传统固态发酵工业中的常见细菌,如在泰国北部的传统发酵木薯食品中该属菌株占到了总菌数的一半以上[18],也是印度、意大利等地的传统豆类发酵食品中的优势菌株[19]。Staphylococcus属细菌也曾在多种传统发酵食品中被分离到,如香肠、鱼酱等[20-21]。
尽管是广泛的采样样品,大曲中分离得到的细菌无论是数量还是多样性都要远低于曲房,这与中高温大曲的生产实际及本次采集的样品为使用曲的实际情况是吻合的。中高温曲,从制曲到后熟成为使用曲要经历至少3个月的时间,而且在制曲过程中还要经历一个高温阶段(65℃左右),这些均导致大曲中细菌数量和多样性减少。在曲房中分离到了较多的Streptomyces属的菌株(37株),但在大曲中却没有被分离到,而且目前已有多篇文献报道了从中高温大曲中检测到了Streptomyces属的菌株。加之目前国内对典型丝状放线菌在白酒酿造过程中的作用的报道极少,所以有必要系统开展典型丝状放线菌在大曲及白酒酿造中的作用的研究。
从中高温大曲中分离得到细菌所属的属一级分类单位在曲房中均可以找到。更为重要的是,大曲中具备乙醇耐受、纤维素分解、淀粉水解能力的菌株,都能够在曲房中找到与之16S rDNA序列近乎100%相似的菌株,这充分表明大曲中细菌群落与生产环境细菌群落有直接关系。同时,本次分离采用的是使用曲,使用曲中分离到能够耐受较高浓度乙醇的细菌,表明这些细菌很可能参与糟醅发酵。所以,在大曲(使用曲)中分离到一定数量(6株)来自于曲房空气且能够耐受较高乙醇浓度的菌株,在相当程度上证明优质白酒的生产与生产环境有密切的关系。
H7B-55(序列号HQ832936)在系统发育树上(图1)处于单独的一簇,与此次分离到的其他细菌具有较远的亲缘关系。同时,由于这株菌与目前GenBank数据库中所有模式菌株序列相似性均小于97%,推测这株菌很可能来自于制曲小麦的内生细菌。由于中高温大曲是生料制曲,原料(小麦)中的内生菌必然会对大曲微生物区系产生影响,而在以往关于大曲微生物区系的研究中,研究者们通常没有考虑到这一问题。而在国外已有关于混菌固态发酵过程中,原材料(植物)内生菌区系会对发酵微生物区系产生影响的报道[22]。所以以后系统研究大曲微生物区系时必须充分考虑原材料内生菌区系对大曲质量的影响。
本研究首次较为系统地研究了宜宾中高温大曲及其生产场所空气的细菌群落,获得了大量的纯培养菌株。并从中高温大曲生产工艺和浓香型白酒酿造的角度对大曲和生产场所的细菌群落相关性进行了探讨,对于最终阐明大曲的发酵机理、统一中高温大曲质量标准提供了支撑,还获得了大量的潜在微生物资源。
[1] 庾莉萍.金融危机下的白酒行业[J].中国酒,2009(2):63-65.
[2] 胡承,邬捷锋,沈才洪,等.浓香型(泸型)大曲的研究及其应用[J].酿酒科技,2004(1):33-36.
[3] 崔如生,孔祥玉,毛坤,等.不同品种包包曲对白酒生产的影响[J].酿酒科技,2009(1):81-83.
[4] 高亦豹,王海燕,徐岩.利用PCR-DGGE未培养技术对中国白酒高温和中温大曲细菌群落结构的分析[J].微生物学通报,2010,37(7):999-1004.
[5] 刘俊红,王福梅,周俊勇.白酒酿造中不同时期曲块优势菌株的测定[J].中国酿造,2009(7):155-156.
[6] 孟镇,熊正河,钟其顶,等.应用PCR-DGGE技术解析白酒大曲细菌群落结构[J].食品与发酵工业,2010,36(10):159-162.
[7] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:353-358.
[8] Rainey FA,Naomi WR,Kroppenstedt RM,et al.The genus Nocardiopsis represents a phylogenetically coherent taxon and a distinct actinomycete lineage:proposal of Nocardiopsaceae fam.Nov[J].International Journal of Systematic and Evolutionary Microbiology,1996,46(4):1088-1092.
[9] Chun J,Lee JH,Jung Y,et al.EzTaxon:a web-based tool for the identification of prokaryotes based on 16S ribosomal RNA gene sequences[J].International Journal of Systematic and Evolutionary Microbiology,2007,57(10):2 259-2 261.
[10] Kimura M.A simple method for estimating evolutionary rates of base substitutions through comparative studies of nucleotide sequences[J].Journal of Molecular Evolution,1980,16(2):111-120.
[11] 翁庆北,赵维娜,万晴姣.习酒酒曲中产淀粉酶细菌分离及性质研究[J].酿酒科技,2006(1):21-26.
[12] 夏服宝,孙宪迅,刘德超,等.发酵秸杆生产耐高温纤维素酶工艺条件的研究[J].中国酿造,2006(3):18-20.
[13] 刘从艾,穆文斌,徐怀玉,等.大曲酵母菌及窖泥生香菌耐酸能力的研究[J].酿酒,1999(1):47-50.
[14] Stackebrandt E,Ebers J.Taxonomic paramenters revisited:tarnished gold standard[J].Microbiology Today,2006,33(4):152-155.
[15] 张明春,曹敬华,向苇,等.白云边酿酒大曲微生物分析研究[J].酿酒科技,2010(2):65-67.
[16] 胡佳,邓斌,张文学,等.浓香型白酒曲药中细菌组成及系统学分析[J].酿酒科技,2007(5):17-195.
[17] Daniela S P,Cláudia I,Edmar C-Souza,et al.Molecular approaches:advantages and artifacts in assessing bacterial diversity[J].Journal of Industrial Microbiology and Biotechnology,2007,34(7):463-473.
[18] Panuwan Chantawannakula,Anchalee Oncharoena,Khanungkan Klanbuta,et al.Characterization of proteases of Bacillus subtilis strain 38 isolated from traditionally fermented soybean in Northern Thailand[J].Science Asia,2002,28(4):241-245.
[19] Jeyaram K,Mohendro Singh W,Premarani T,et al.Molecular identification of dominant microflora associated with ‘Hawaijar’ ——A traditional fermented soybean[Glycine max(L.)]food of Manipur,India[J].International Journal of Food Microbiology,2008,122(3):259-268.
[20] Lucilla Iacumina,Giuseppe Comia,Carlo Cantonib,et al.Ecology and dynamics of coagulase-negative cocci isolated from naturally fermented Italian sausages[J].Systematic and Applied Microbiology,2006,29(6):480-486.
[21] Gounadaki A S,Skandamis P N,Drosinos E H,et al.Microbial ecology of food contact surfaces and products of small-scale facilities producing traditional sausages[J].Food Microbiology,2008,25(2):313-323.
[22] Avila C L,Bravo Martins C E,Schwan R F.Identification and characterization of yeasts in sugarcane silages[J].Journal of Applied Microbiology,2010,109(5):1 677-1 686.
