纯中药制剂复聪汤对庆大霉素致聋豚鼠耳蜗毛细胞修复再生的实验研究△
2012-01-12李胜利朱宏亮刘全征王玮刘琦史士合刘艳平王福田李宪德
李胜利 朱宏亮 刘全征 王玮 刘琦 史士合 刘艳平 王福田 李宪德
有研究表明,豚鼠庆大霉素(gentamyci,GM)中毒后耳蜗毛细胞具有一定程度的再生修复能力[1]。刘冰等[2]证明GM耳中毒后豚鼠存活4周者耳蜗毛细胞微绒毛密集, 但不规则, 未发现不成熟的小纤毛束。沈啸洪等[3]给豚鼠肌肉注射卡那霉素造成耳聋模型后,用中药补肾聪耳片治疗后多数毛细胞听毛排列整齐, 极少数听毛倒伏紊乱, 扭曲变形, 缺损明显减少, 基底膜恢复完整, 亦可见到绒纤毛, 表明其听毛细胞有修复现象。侯建平等[4]的实验结果表明茯苓可减轻豚鼠卡那霉素中毒性耳损害。倪月秋[5]采用GM 致聋制作动物模型,然后用中药川芎嗪( tmtramethylpyrazine,TMP) 进行干预,结果发现川芎嗪对豚鼠耳蜗受损毛细胞有修复作用。崔城等[6]同样发现川芎嗪对庆大霉素中毒耳蜗毛细胞和血管纹具有保护作用。而徐绍勤等[7]用中药复聪片对庆大霉素耳中毒豚鼠治疗20天后发现其可促使受损毛细胞形态及功能在一定程度上恢复。钟渠等[8]用聪耳合剂治疗感音神经性聋,结果治疗组(两个疗程共30天)总有效率(82.36%)明显高于对照组(59.38%),说明聪耳合剂治疗感音神经性聋安全有效。倪月秋[5]认为中药在治疗感音性聋方面取得了很大成就,并指出中药对人类内耳毛细胞再生影响的研究将会取得突破性的进展,从而为治疗感音神经性聋开辟一条崭新的道路。
本课题组研制的纯中药制剂复聪汤Ⅰ号口服液和复聪汤Ⅱ号滴耳液,秉承祖国医药的传统,在口服全身治疗的同时,外耳道局部进行药浴治疗,在部分动物和聋儿治疗获得一定疗效后,进行了本实验研究,发现该纯中药制剂可使庆大霉素致聋动物的听功能部分恢复,对耳蜗受损的毛细胞有一定的修复再生作用,现报告如下。
1 材料与方法
1.1实验动物分组及造模方法 选用健康青年杂色豚鼠73只(西安交通大学实验动物中心),耳廓反射正常,体重250~300 g,雌雄各半。动物分为庆大霉素致聋组(GM组)53只和正常对照组20只。两组动物用戊巴比妥钠80 mg/kg麻醉,进行ABR和DPOAE检测。GM组按80 mg·kg-1·d-1肌肉注射庆大霉素(山东鲁抗辰欣药业有限公司,2 ml,8万单位),连续注射30天,期间因中毒严重死亡动物8只,剩余的45只动物在击掌耳廓反应减弱或消失情况下,检测ABR反应阈在60 dB SPL以上、DPOAE幅值明显下降后,再分为致聋后中药治疗组(25只)和致聋后对照组(20只)。正常对照组给予肌肉注射同样剂量及疗程的生理盐水。
在连续治疗30、60和90天后,分别检测中药治疗组和致聋后对照组动物的ABR、DPOAE,然后于各时间点分别取6只动物麻醉后处死,右侧耳蜗行硝酸银染色耳蜗铺片,左侧耳蜗用2.5%戊二醛固定后行扫描电镜观察。
1.2豚鼠致聋后治疗方法 根据《中药药理研究方法学》中的方法[9],按成人量(mg/kg)换算成动物剂量的倍数简表,换算豚鼠为4.5倍的剂量(mg/kg),计算出豚鼠的口服用药剂量约为10 ml。中药“复聪汤Ⅰ号”的主要成分为:桃仁、穿山甲、红花、川芎、黄芪、莱菔子、乌药、木香等水煎剂;“复聪汤Ⅱ号”的主要成分为:冰片、茯苓、桂圆和麝香等的水提取液。致聋后中药治疗组从致聋成功后开始每天口服复聪汤Ⅰ号10 ml,并予复聪汤Ⅱ号外耳道药浴两次,连续30、60和90天。致聋后对照组每天口服相同剂量的生理盐水并外耳道每天滴生理盐水两次,疗程同中药治疗组。
1.3ABR和DPOAE检测方法 检测仪器为美国Inteligent Hearing Smart3听觉诱发电位-耳声发射仪。ABR检测:动物麻醉后,用针电极插入颅顶作为记录电极,同侧为参考电极,对侧接地。刺激率19.1次/毫秒,高通300 Hz,低通3 000 Hz,平均叠加256~512次。DPOAE检测:两个初始音强度分别为L1=L2=70 dB SPL的纯音信号,f1/ f2=1.22,f1、f2的几何均数的范围位于0.5~8.0 kHz。测量不同刺激强度时DPOAE的幅值,以反应幅值高出本底噪声3 dB作为DPOAE引出,确定检出率。上述测试均叠加100次。
1.4耳蜗铺片及观察方法 动物在麻醉状态下,快速断头,迅速取出右侧听泡,分离出耳蜗,在解剖显微镜下(OLYMPUS,TOKYO,297261),用纤细钢针在耳蜗尖顶钻一小孔,将前庭膜挑破,再挑破圆窗膜和卵圆窗膜,并在耳蜗底回骨隆起处钻一小孔,吸取0.5%的硝酸银溶液从蜗尖的小孔和两窗及底回的小孔反复灌入用双蒸水洗涤数次,再灌入10%的福尔马林固定液。标本在日光下曝光2~4小时后,解剖显微镜下分离基底膜并铺片,光镜下从耳蜗基底部的沟回开始,逐个视野向顶回对正常存活毛细胞计数(正常外毛细胞呈明显完整的“V”形),同时计数出消失的毛细胞数和严重变性的毛细胞数(严重变性的毛细胞为表皮板肿胀凸起,呈“疱疹”样,未见静纤毛束)。
1.5扫描电镜观察方法 将取材的左侧耳蜗样品用缓冲液洗净,在解剖显微镜下(OLYMPUS,TOKYO,297261)用纤细钢针在耳蜗顶部打一小孔,一定要挑破前庭膜,再挑破圆窗膜和卵圆窗膜,并去除镫骨及足板,用细滴管将2.5%戊二醛固定液从蜗尖小孔和圆窗卵圆窗反复滴灌3~5次,将样品浸泡在固定液中,置于4 ℃冰箱中4小时。置于0.1 M PBS缓冲液中,在解剖显微镜下行耳蜗各回骨壁钻孔,使耳蜗各回与固定液相通,再浸泡于固定液中4小时。用0.1 M PBS漂洗三次后,用1% OsO4后固定2小时。用0.1 M PBS漂洗20~30分钟。梯度乙醇脱水,乙醇与乙酸异戊酯1:1的混合液10~20分钟;纯乙酸异戊酯10~20分钟。临界点干燥后,即可取出样品。将样品置于解剖显微镜下,去除覆盖于观察部位的骨质和膜性结构,清洁样品后,将样品用双面胶带固定于样品台上,离子溅射镀膜。扫描电镜观察在S-2700 Scanning Election Microscope HITACHI下进行。
1.6统计学方法 采用Microsoft Office Excel 录入数据,所有数据用SPSS10.0 for Window软件进行t检验。
2 结果
2.1DPOAE检测结果 实验前所有动物DPOAE幅值正常(5.7~30.8 dB SPL),GM致聋后,在中高频率区(1 005~8 000 Hz)DPOAE幅值明显降低(P<0.05),中药治疗30天后DPOAE幅值上升明显,尤其在GM损害严重的中高频区(1 000~4 000 Hz);中药治疗60天后,中高频区DPOAE幅值上升但不显著;中药治疗90天后,高频区幅值上升明显,与GM致聋后和治疗30天时相比,差异有显著统计学意义(P<0.01),与实验前相比差异无统计学意义(P>0.05),说明中药治疗90天使GM致聋豚鼠耳蜗的DPOAE幅值基本恢复正常(表1)。
致聋后对照组豚鼠DPOAE幅值明显下降,生理盐水治疗30、60和90天后,低中频率区(500~1 500 Hz)DPOAE幅值逐步恢复,而中频到高频段(2 800~8 000 Hz)DPOAE幅值仍在逐步下降,到90天时下降更为明显,说明GM致聋后随恢复时间延长豚鼠低中频区DPOAE幅值可有部分恢复,而高频区持续下降(表2)。
正常对照组30、60和90天时DPOAE幅值逐渐下降,但差异无统计学意义(P>0.05)(表3)。
2.2ABR检测结果 实验前各组的ABR平均阈值为20~25 dB SPL,GM致聋后ABR阈值上升到40~80 dB SPL,平均为 50 dB SPL左右,与实验前相比,差异有显著统计学意义(P<0.05)。中药治疗30、60和90天后,治疗组总体ABR的平均阈值由30 dB SPL左右逐渐下降到 25 dB SPL左右,较致聋后明显下降(P<0.01),较实验前差异无统计学意义(P>0.05)。治疗后30、60和90天时自身比较差异无统计学意义。致聋后对照组生理盐水治疗30、60和90天后,总体的ABR平均阈值与治疗前比较差异无统计学意义,基本维持在GM致聋后的50 dB SPL左右水平(表4)。
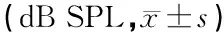
表1 GM致聋后中药治疗组实验前、致聋后及中药治疗30、60和90天DPOAE各频率幅值
注:*与实验前比较,P<0.05;**与治疗30天比较,P<0.01
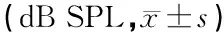
表2 GM致聋后对照组实验前、致聋后及生理盐水治疗30、60和90天DPOAE各频率幅值
注:*与实验前比较,P<0.05
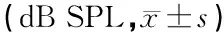
表3 正常对照组实验前及自然恢复30、60和90天DPOAE各频率幅值
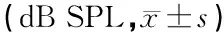
表4 实验前后致聋后中药治疗组、致聋后对照组ABR反应阈
注:*与同组其他各时间点比较,P<0.05;**与实验前及治疗后30、60、90天比较,P<0.05
正常对照组在30、60和90天时ABR反应阈仅有小幅上升,但与实验前比较差异无统计学意义(P>0.05)。
2.3耳蜗铺片观察结果 庆大霉素致聋后,豚鼠耳蜗基底回(第一回)的内外毛细胞基本损失,第二回亦有40%~80%的外毛细胞损失,第三回及第四回有一半的外毛细胞损失。中药治疗30天后,耳蜗基底回的毛细胞数目明显增多,接近正常数的一半(图1a);第三回仅有散在的毛细胞缺失,毛细胞缺失部位出现许多增生的支持细胞(图1b、c)。而致聋后对照组耳蜗基底回毛细胞几乎全部消失(图1d),耳蜗第三、四回也有80%的毛细胞消失,同时出现许多正在损害的变性细胞(图1e、f)。

图1 庆大霉素致聋后中药治疗30天及致聋后对照组豚鼠耳蜗毛细胞损害及增殖修复情况

图2 庆大霉素致聋后中药治疗60天及致聋后对照组豚鼠耳蜗毛细胞损害和增殖情况

图3 庆大霉素致聋后中药治疗90天及致聋后对照组豚鼠耳蜗毛细胞损害及修复情况
中药治疗60天后,耳蜗第一回毛细胞缺失减少,存活的细胞密度增加(图2a),耳蜗第二回和第三回的增殖细胞出现较多,同时存活的毛细胞亦增多(图2b、c)。而致聋后对照组耳蜗第一回和第二回毛细胞基本消失,Corti器仅由移行上皮代替(图2d、e),第三回仍有大量的毛细胞缺失,在缺失处未见增殖细胞出现(图2f)。
中药治疗90天后,耳蜗毛细胞的增殖数目明显增多,许多处于中间状态的细胞,其特点是表皮板浓染,在显微镜微调下可以见到完整的静纤毛束(图3a~c),基本可以肯定这些中间细胞是修复和再生的毛细胞。致聋后对照组可见到第一、二回耳蜗毛细胞基本消失,仅存留个别毛细胞(图3d、e),第三回的第一排外毛细胞基本消失,第二、三排毛细胞变性(图3f)。
2.4耳蜗毛细胞计数结果 致聋后中药治疗组治疗90天后,可见耳蜗基底回约50%以上的外毛细胞正常存活,约占耳蜗观察数的66.67%(2/3),第二和第三回的存留毛细胞中还存在许多处于中间状态的毛细胞,表现为表皮板染色较正常毛细胞深,可能是由于微绒毛着色的缘故,但其上的静纤毛束存在和完整,完全不同于修复的毛细胞(修复的毛细胞最大特点是表皮板仍肿胀凸起)。而致聋后对照组耳蜗基底回平均仅20%左右的外毛细胞存活,大多数耳蜗基底回内外毛细胞完全缺失,Corti器基本萎缩消失,并由大量的移行上皮覆盖,约占耳蜗观察数的66.67%,且严重变性的毛细胞较多(图4)。说明治疗组有毛细胞修复和再生。两组动物的第三回和顶回的存活毛细胞差异较小,因为庆大霉素主要损害耳蜗的基底回。
2.5扫描电镜观察结果 致聋后中药治疗30天56号豚鼠的耳蜗第二回扫描电镜观察显示,毛细胞消失处的支持细胞增殖,表面微绒毛出现,在微绒毛的中间出现较粗的纤毛(图5a、c)是再生毛细胞的早期表现。在耳蜗第三回的外毛细胞消失处,扫描电镜可以清楚的看到具有小束样的纤毛束,其周围生长着许多微绒毛(图5b、d),这是正在发育成熟的再生毛细胞。
致聋后对照组30天,耳蜗毛细胞损害处有空洞和瘢痕出现,存留的外毛细胞有胞浆外溢、纤毛散乱和融合,并且消失的毛细胞较多(图6)。
致聋后对照组90天耳蜗扫描电镜观察,可见耳蜗第一回毛细胞基本消失,第二、三回的外毛细胞消失较多,在毛细胞消失部位,可以看到支持细胞增殖,但表面的微绒毛较少,未见到新生的纤毛样凸起(图7)。
致聋后中药治疗组90天后,在57号豚鼠的耳蜗顶回可以看到成熟的再生毛细胞,其最大特点是静纤毛束完整,表皮板上覆盖着微绒毛,这与邻近的存留毛细胞具有光滑的表皮板形成明显差异(图8a、d)。在耳蜗第三回的毛细胞间亦出现小束样的纤毛束(图8b、e),而耳蜗第二回的毛细胞消失部位仅出现正在增殖生长的支持细胞,其表面亦覆盖着微绒毛(图8c、f)。
毛细胞再生增殖早期、中期和成熟的过程见图9。

图4 庆大霉素致聋后中药治疗90天豚鼠耳蜗外毛细胞正常存活的百分数与致聋后对照组比较
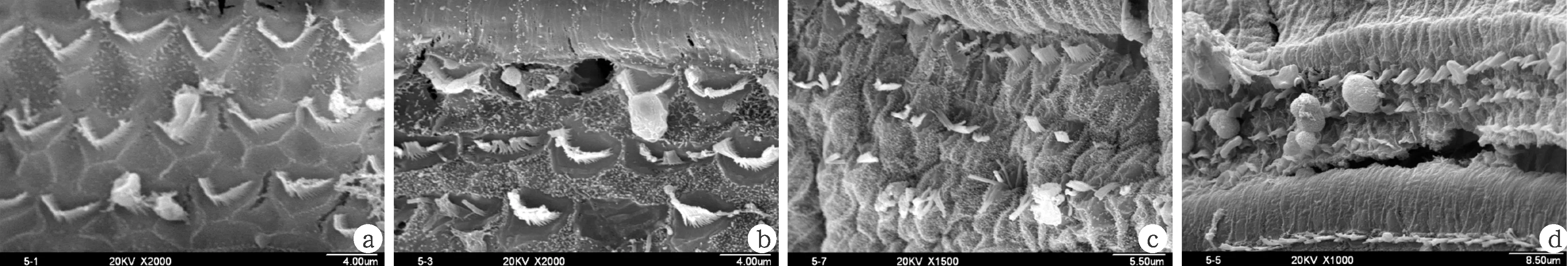
图6 庆大霉素致聋后30天致聋后对照组耳蜗毛细胞损害的扫描电镜观察

图7 庆大霉素致聋后对照组豚鼠90天后耳蜗毛细胞增殖与修复的扫描电镜观察

图8 57号豚鼠庆大霉素致聋后治疗90天耳蜗毛细胞再生扫描电镜观察

图9 庆大霉素致聋后中药治疗90天耳蜗支持细胞增殖为新生毛细胞前期表现的扫描电镜观察
3 讨论
倪月秋[1]的实验结果表明, GM 耳中毒后1天动物耳蜗第二回外毛细胞纤毛产生融合、扭曲、倒伏、缺失或残缺不全等病理现象, 内毛细胞静纤毛外侧有囊状突出物,推测该囊状突出物可能源于内毛细胞, 因为一般在毛细胞代谢紊乱和坏死之前, 通常可见细胞内容物自表皮板排出, 其原因可能与溶酶体的异溶和自溶功能有关;豚鼠GM中毒后30天,耳蜗第三回外毛细胞可见纤维的纤毛束,明显不同于原有的静纤毛,提示GM中毒后耳蜗毛细胞具有一定程度的再生修复能力。本实验中同样观察到GM致聋后豚鼠耳蜗毛细胞的病理改变,致聋后治疗组亦见到Corti器上纤细的纤毛束,在扫描电镜观察下,这些纤细和较小的纤毛束明显不同于存留的毛细胞,并且可以看到单根的纤毛和成小束的纤毛束。而本实验中GM致聋后对照组30天后豚鼠ABR反应阈虽有所恢复, 但与正常对照组相比差异显著 , 同时耳蜗第二回外毛细胞静纤毛融合、缺失、倒伏等病理改变减弱, 明显不同于刚受损的毛细胞, 内毛细胞静纤毛与正常对照组相比未见明显差异, 第三回外毛细胞可见纤细的纤毛束, 明显不同于原有的静纤毛, 提示GM 中毒后耳蜗毛细胞具有一定程度的再生修复能力。
刘冰等[2]在GM 耳中毒后豚鼠耳蜗毛细胞损伤与再生的实验中证明存活4周者微绒毛密集, 但不规则, 未发现不成熟的小纤毛束。本实验中GM致聋后治疗组中药治疗后,毛细胞缺失处的支持细胞表面微绒毛密集,早期的微绒毛虽然密集,但长度较短(治疗30天),中期时(治疗60天)微绒毛密度更大且长度更长,在治疗后期时(治疗90天)基本呈现出小纤毛束的雏形。
沈啸洪等[3]给豚鼠肌肉注射卡那霉素致聋后,治疗组用中药补肾聪耳片治疗10天,结果,未经治疗的对照组耳蜗螺旋器毛细胞损害严重, 以外毛细胞为甚, 内毛细胞损害较轻, 外毛细胞第一回听毛损害较重, 第二回次之, 第三回较轻, 表现排列紊乱, 听毛倒伏, 扭曲变形, 指向不同方向, 严重者有听毛脱落、缺损, 甚至大片脱落, 基底膜亦有不同程度损坏, 未见到修复现象;而治疗组多数毛细胞听毛排列整齐, 极少数听毛倒伏紊乱、 扭曲变形, 缺损比对照组明显减少, 基底膜恢复完整, 亦可见到绒纤毛, 表明听毛细胞有修复现象。而本研究中致聋后治疗组60和90天的绒纤毛细胞更多和更全面,并且发现了再生成熟的毛细胞(图9),同时动物DPOAE和ABR均有恢复,说明中药制剂复聪汤能促进耳蜗毛细胞修复和再生。
侯建平等[4]的实验中,耳蜗铺片显示单用卡那霉素后动物外毛细胞损害较严重, 耳蜗底回外毛细胞缺失率为57. 5%, 而服用茯苓治疗10天后动物耳蜗底回外毛细胞缺失率为39. 6%,说明茯苓可减轻卡那霉素中毒性耳蜗损害。本研究中,致聋后治疗组豚鼠的耳蜗基底回约50%以上的外毛细胞正常存活,占耳蜗观察数的66.67%(2/3),耳蜗第二和第三回的存留毛细胞中,还存在许多处于中间状态的毛细胞,而致聋后对照组耳蜗基底回平均仅20%左右的外毛细胞存活,大多数耳蜗基底回内外毛细胞完全缺失,Corti器基本萎缩消失,并由大量的移行上皮覆盖,约占耳蜗观察数的66.67%,并且严重变性的毛细胞较多。
无论鸟类耳蜗还是哺乳类动物的前庭器感觉上皮,再生毛细胞的显著特征表现在表皮板上的纤毛和细胞体:首先是表皮板上早期生长出动纤毛和微绒毛,丛生的微绒毛逐渐长高,并逐步出现阶梯样层次结构,此时的动纤毛已消失,而表皮板和静纤毛束最终发育完善,生长成正常的毛细胞[10,11];第二是看到细胞体的出现和发育完善。新生毛细胞的特点是表皮板中央生长着动纤毛,动纤毛周围生长着微绒毛,微绒毛的肌动蛋白微丝增粗而长成静纤毛束[12]。
某些再生毛细胞的形态特征主要是具有独特的毛细胞特征(静纤毛) (stereocilia) 并具有支持细胞的表型(伸长的细胞体与基底膜相连)。当然,这种存在方式并不能证明它是直接转化分化的。诸如此类中间状态(intermediate)的细胞可见于牛蛙[13,14]、鸡[15]和豚鼠[16]。这些形态目前已证明是有丝分裂的毛细胞[17]。庆大霉素损害后,非典型细胞具有顶部特化的微绒毛,类似于早期分化的静纤毛短暂出现于中毒损伤的耳蜗顶端,但最终分化为毛细胞。Daudet等[18]应用COPIED ABSTR电子显微镜 、组织化学和激光共聚焦显微镜,观察丁胺卡那霉素损害大鼠耳蜗Corti 器,用BrdU( 5-bromo-2-deoxyuridine)免疫细胞化学方法确定有无有丝分裂过程参与非典型细胞的形成过程 。形态学和分子学资料证明非典型细胞并不是复原的毛细胞,而是未成熟的毛细胞和支持细胞,增殖细胞区域出现的非典型细胞,并非是通过细胞有丝分裂过程而来的。 结合以前研究结果,他们支持非典型细胞是通过某些支持细胞在毛细胞退行性改变期直接转化形成的假设[19]。本研究显示致聋后治疗组豚鼠耳蜗亦发现许多处于中间状态的细胞,故支持非典型的中间细胞是再生和修复的毛细胞的表现。
本研究选择的中药复聪汤Ⅰ号、复聪汤Ⅱ号具有滋补肝肾、活血化瘀、益气开窍、疏通经络、改善耳蜗内循环之功效,还可能具有促使听觉毛细胞再生之功效。从文中结果看,致聋后中药治疗组使用复聪汤Ⅰ号和复聪汤Ⅱ号治疗30到90天后,耳蜗受损的毛细胞有一定程度的修复和再生,虽然再生毛细胞的数目较少,在治疗动物中的出现率不是很高,但动物的DPOAE幅值及ABR反应阈值均有一定恢复,表明复聪汤确实可在一定程度上促使哺乳类动物耳蜗毛细胞的修复和再生,并改善损害后的听功能。该中药制剂的其它机理和毒副作用尚需进一步深入研究。
毛细胞再生的研究从鱼类、鸟纲类到哺乳动物类[10~12,20],许多学者在形态功能、机制探讨等方面作了大量的工作,但到目前为止内耳毛细胞发育再生的确切机制仍不十分清楚。再生毛细胞的生理功能如何,如何与周围的支持细胞形成正确的组织结构,如何刺激成年哺乳动物内耳中的干细胞发育成具有正常生理功能的毛细胞,能否找到毛细胞分化和发育过程中起重要作用的基因和相关信号分子等问题还需要努力解决,今后的研究重点将会侧重于毛细胞再生的机制及如何促进再生等研究方向。
4 参考文献
1 倪月秋,汤浩,崔城.庆大霉素中毒后豚鼠耳蜗毛细胞的再生[J].中国病理生理杂志,2004, 20:536.
2 刘冰,李西秦,吴润身,等. 庆大霉素耳中毒后豚鼠椭圆囊斑和耳蜗毛细胞损伤与再生的观察[J]. 中华耳鼻咽喉科杂志, 1998, 33:184.
3 沈啸洪,林文森.补肾聪耳片对卡那霉素致聋豚鼠听毛细胞修复研究[J].天津医药, 2004,32:38.
4 候建平, 刘耀春, 刘桂英.茯苓与豚鼠卡那霉素耳中毒[J].中医药研究,1997,13:45.
5 倪月秋.中药对氨基糖苷类抗生素致聋耳蜗毛细胞再生修复影响的研究进展[J].沈阳医学院学报,2010 ,12 :193.
6 崔城,汤浩,李煜兴,等.川芎嗪对庆大霉素耳中毒耳蜗外毛细胞和血管纹的保护作用[J].听力学及言语疾病杂志,2002,10:258.
7 徐绍勤,殴阳林,曾省三,等.复聪片对豚鼠庆大霉素耳中毒的防治作用[J].中药新药与临床药理,1999,10:341.
8 钟渠,郑桃晓,冯志荣,等.聪耳合剂治疗感音神经性耳聋随机对照研究[J].中华中医药学刊,2011,29:1 752.
9 陈奇,主编.中药药理研究方法学[M].第二版.北京:人民卫生出版社,1993.1 167~1 170.
10 李胜利,朱宏亮,白秦生.庆大霉素和卡那霉素耳中毒后雏鸡耳蜗毛细胞再生[J].中华耳鼻咽喉科杂志,1997,29:89.
11 李胜利,朱宏亮,白秦生.氨基糖甙类抗生素损害鸡耳蜗后前庭毛细胞再生及耳石体修复[J].临床耳鼻咽喉科杂志,1994,8:102.
12 李胜利,张正民,张少强,等.蝙蝠耳蜗毛细胞损害后支持细胞转分化为再生毛细胞研究[J].中华耳科学杂志,2010, 8:335.
13 Baird RA, Burton MD, Fashena DS, et al. Hair cell recovery in mitotically blocked cultures of the bullfrog saccule[J]. Proceedings of the National Academy of Sciences of the United States of America,2000,97:11 722.
14 Steyger PS, Burton M, Hawkins JR, et al. Calbindin and parvalbumin are early markers of non-mitotically regenerating hair cells in the bullfrog vestibular otolith organs[J]. Int J Dev Neurosci,1997,15:417.
15 Hirose K, Westrum LE, Stone JS, et al. Dynamic studies of ototoxicity in mature avian auditory epithelium[J]. Annals of the New York Academy of Sciences,1999,884:389.
16 Li L, Forge A. Morphological evidence for supporting cell to hair cell conversion in the mammalian utricular macula[J]. Int J Dev Neurosci,1997,15:433.
17 Stone JS, Rubel EW. Cellular studies of auditory hair cell regeneration in birds[J]. Proceedings of the National Academy of Sciences of the United States of America,2000a,97:11 714.
18 Daudet N, Vago P, Ripoll C, et al. Characterizaton of atypical cells in the juvenile rat organ of corti after aminoglycoside ototoxity[J]. The Journal of Comparative Neurology ,1998,401:145.
19 Cafaro J, Lee GS, Stone JS. Atoh1 expression defines activated progenitors and differentiating hair cells during avian hair cell regeneration[J]. Dev Dyn,2007,236:156.
20 李胜利,朱宏亮.庆大霉素耳中毒后毛细胞再生的超微结构和功能恢复[J].西安医科大学学报,1997,18:381.
