固定化脂肪酶催化合成癸二酸二(2-乙基己基)酯
2012-01-10王诗路赵国明邹慧斌
王诗路,赵国明,刘 辉,邹慧斌,咸 漠
(1.中国科学院青岛生物能源与过程研究所,山东 青岛 266101;2.中国科学院研究生院,北京 100049)
固定化脂肪酶催化合成癸二酸二(2-乙基己基)酯
王诗路1,2,赵国明1,刘 辉1,邹慧斌1,咸 漠1
(1.中国科学院青岛生物能源与过程研究所,山东 青岛 266101;2.中国科学院研究生院,北京 100049)
在有机溶剂中,分别采用固定化脂肪酶Lipozyme TL IM,Lipozyme RM IM和Novozym 435催化癸二酸和2-乙基己醇合成癸二酸二(2-乙基己基)酯,考察了溶剂、反应温度、反应时间、酶量和底物比等对产率的影响。结果表明:反应温度40 ℃,癸二酸400 mg,2-乙基己醇0.96 mL(2-乙基己醇和癸二酸物质的量之比3),环己烷15 mL,在600 PLU固定化脂肪酶催化条件下反应24 h,Lipozyme TL IM催化产率可达96.94%,Lipozyme RM IM催化产率可达96.23%,Novozym 435催化产率可达84.65%。在上述反应条件下,使用6次后,这3种固定化脂肪酶仍保持较高的催化活性。
固定化脂肪酶 癸二酸二(2-乙基己基)酯 有机溶剂 环己烷
癸二酸二(2-乙基己基)酯是优良的耐寒增塑剂,还可用作喷气发动机的润滑油[1]。工业上,癸二酸二(2-乙基己基)酯是在减压条件下通过硫酸催化癸二酸和2-乙基己醇酯化合成,但该法反应选择性差、副反应多、产品色泽深, 对设备和管道腐蚀严重[2]。目前也有将杂多酸类催化剂应用于酯化[3-5],但由于杂多酸价格较高、比表面积较小、易溶于水等极性有机溶剂,因此需要将其负载到多孔固体载体上[6]。而固载后存在杂多酸的溶脱等问题[7],导致其工业化应用受到限制。与上述酸类酯化催化剂相比,固定化脂肪酶具有反应条件温和、性能稳定、催化高效专一、便于回收等优点,拥有良好的工业化应用前景[8]。李伟等[9]在无溶剂体系中用固定化脂肪酶Novozym 435催化1,2-丙二醇和月桂酸酯化,酯化率可达91.89%,使用6次后,月桂酸酯化率仍可达70%以上。马娅等[10]在有机溶剂中用固定化Candidasp 99-125催化己酸乙酯合成,己酸转化率可达96%,脂肪酶使用3次后,己酸转化率仍可达到75%以上。目前,国内外关于酶法合成癸二酸二(2-乙基己基)酯的系统研究报道较少,因此本研究考察在有机溶剂体系中,固定化脂肪酶Lipozyme TL IM,Lipozyme RM IM和Novozym 435催化癸二酸二(2-乙基己基)酯合成的影响因素以及酶的重复使用性能,以期寻求较佳的催化工艺条件。
1 实验部分
1.1 固定化脂肪酶酶活测定
采用酯合成原理测固定化脂肪酶活性[11]。酶活单位为60 ℃条件下,每分钟生成1毫摩尔丙基月桂酸脂所需的量为一个单位,用PLU表示。本实验所用的3种固定化脂肪酶均出自同一批次,各酶酶活均一。经检测,Lipozyme TL IM和Lipozyme RM IM酶活均是6 000 PLU/g,Novozym 435酶活是7 200 PLU/g。
1.2 癸二酸二(2-乙基己基)酯合成
称取400 mg癸二酸和一定量2-乙基己醇于100 mL具塞锥形瓶中,加入适量的固定化脂肪酶(按照酶活计),再加入15 mL溶剂,置于转速为150 r/min 的恒温水浴振荡器中反应。一定时间后取出反应溶液,与无水乙醇按照体积比60∶40混溶,过滤,之后测滤液总体积,低温静置保存。每组实验做3个平行样,结果取其平均值。
1.3 癸二酸二(2-乙基己基)酯产率测定
采用Varian 450-GC气相色谱仪分析上述滤液,采用Agilent CP-Wax 58 FFAP柱(25 m×0.25 mm×0.2 μm)毛细管气相色谱柱以及FID检测器。色谱分析条件:进样量1 μL,载气N2,载气流速2 mL/min,分流比50∶1,进样器温度300 ℃,检测器温度320 ℃。柱温程序:0~1 min,120 ℃;1~5.3 min,120~250 ℃,升温速率30 ℃/min;5.3~13.3 min,250 ℃。采用外标法计算癸二酸二(2-乙基己基)酯的含量。依据癸二酸二(2-乙基己基)酯标准品确定其保留时间是6.8 min。标准品的峰面积(Y)为纵坐标,浓度(X,单位mg/mL)为横坐标绘制标准曲线,得出回归方程Y=2 649.6X,其R2=0.998 4。根据回归方程计算癸二酸二(2-乙基己基)酯产率。
2 结果与讨论
2.1 溶剂的影响
有机溶剂性质对于非水酶催化活性的影响,常用有机溶剂和水的分配系数(logP)表达溶剂性质的参数,logP值越大,溶剂的疏水性越强;logP值越小,溶剂的亲水性越强[12]。在40 ℃,癸二酸400 mg,2-乙基己醇0.96 mL(醇酸物质的量之比3),溶剂15 mL,固定化脂肪酶600 PLU的条件下反应24 h,考察反应溶剂logP值对癸二酸二(2-乙基己基)酯产率的影响,结果见表1。Novozym 435的耐受有机溶剂极性范围最广,在所选的8种有机溶剂中,均可以催化生成癸二酸二(2-乙基己基)酯,其中最低产率为45.90%,最高产率为85.80%。Lipozyme TL IM 和Lipozyme RM IM耐受有机溶剂极性范围不如Novozym 435,但是在logP为3.04~6.42的5种有机溶剂中,产率分别都高于相同溶剂中Novozym 435催化的产率。总体而言,随着logP值逐渐增大,溶剂的疏水性增强,3种固定化脂肪酶催化癸二酸二(2-乙基己基)酯的产率均呈现先升后降的趋势。具体来说,在logP为3.46~5.87的3种有机溶剂中,Lipozyme RM IM催化产率均在95%以上;在logP为3.46~4.17的2种有机溶剂中,Lipozyme TL IM催化产率均在96%以上,Novozym 435催化产率均在84%以上。由此可见,环己烷(logP为3.46)和正庚烷(logP为4.17)均适用于作为3种固定化脂肪酶的反应溶剂。在后续实验中,选择环己烷作为反应溶剂。

表1 反应溶剂对癸二酸二(2-乙基己基)酯产率的影响Table 1 Effects of solvents on yield of bis(2-ethylhexyl) sebacate
2.2 反应温度的影响
癸二酸400 mg,2-乙基己醇0.96 mL(醇酸物质的量之比3),环己烷15 mL,在600 PLU固定化脂肪酶催化条件下反应24 h,考察反应温度对癸二酸二(2-乙基己基)酯产率的影响,结果见图1。由图1可知:这3种固定化脂肪酶随温度的变化趋势基本相同。反应温度为30 ℃时,产率为最低值。反应温度从30 ℃上升至40 ℃,产率升高;从40 ℃上升至60 ℃,产率呈下降趋势;从60 ℃升至70 ℃,产率回升。产率随温度的非线性变化,可能是本合成反应是非均相可逆的平行串联反应这一特性决定的。非均相可逆的平行串联反应属于非常复杂的复合反应,目标产物的产率和反应条件参数并不一定呈线性变化。Lipozyme TL IM 和Lipozyme RM IM催化反应的最高产率出现在40 ℃时,而Novozym 435催化反应的最高产率出现在70 ℃时。基于高温对酶具有破坏性影响和节省能源的考虑[13],本实验适宜的反应温度为40 ℃。
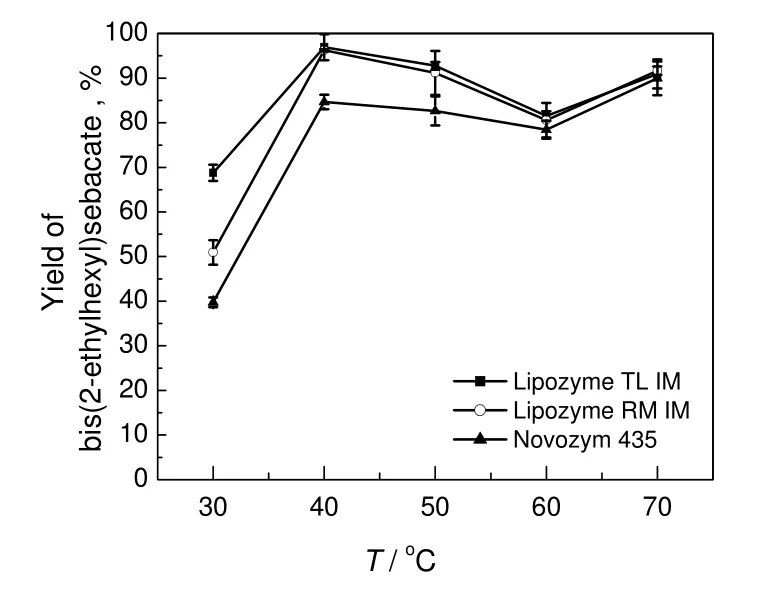
图1 反应温度对癸二酸二(2-乙基己基)酯产率的影响Fig.1 Effect of reaction temperature on yield of bis(2-ethylhexyl) sebacate
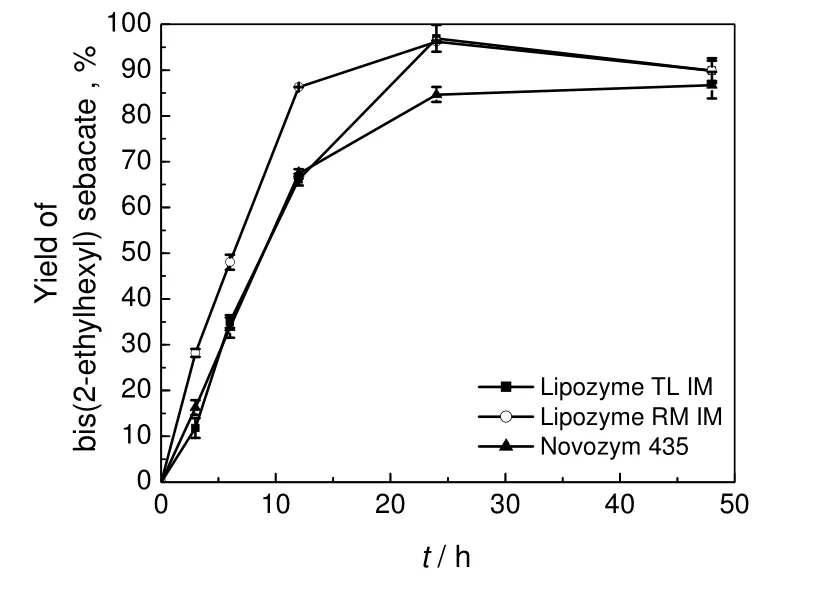
图2 癸二酸二(2-乙基己基)酯产率随时间的变化Fig.2 The change of bis(2-ethylhexyl) sebacate yield with reaction time
2.3 反应随时间的变化情况
反应温度40 ℃,癸二酸400 mg,2-乙基己醇0.96 mL(醇酸物质的量之比3),环己烷15 mL,在600 PLU固定化脂肪酶催化条件下反应,考察癸二酸二(2-乙基己基)酯产率随时间的变化情况,结果见图2。由图2可知,这3种固定化脂肪酶随时间变化的趋势基本相同。反应时间从0到12 h,产率呈近线性增长;从12 h到24 h,Lipozyme TL IM 和Lipozyme RM IM催化反应的产率上升至最高值。因此,在此实验条件下,反应24 h比较合适。Novozym 435催化反应产率在24 h之后缓慢上升,从24 h到48 h,反应时间增加一倍,产率仅增加约2%。综合考虑,既要保持较高的反应产率,又要维持适当的反应效率,Novozym 435催化反应适宜的反应时间为24 h较合适。
2.4 酶量的影响
反应温度40 ℃,癸二酸400 mg,2-乙基己醇0.96 mL(醇酸物质的量之比3),环己烷15 mL,在固定化脂肪酶催化条件下反应24 h,考察酶量对癸二酸二(2-乙基己基)酯产率的影响,结果见图3。由图3可知:酶量从0增加到600 PLU,产率均呈近线性增长趋势;酶量从600增加到1 000 PLU,Lipozyme TL IM 和Lipozyme RM IM催化产率先略有下降,后趋于平稳;Novozym 435催化产率先大幅下降,后快速回升。由于反应体系内的水含量相对比较稳定,随着酶量增加,分配到酶分子的水就会相对减少,导致酶活受到影响,从而使产率下降[14]。据推测,除了水含量会直接影响酶活外,Novozym 435的固定化载体(聚丙烯酸树脂)对溶液微环境变化很敏感,结果导致Novozym 435催化产率随着时间的推移呈现出更复杂的变化。当酶量为600 PLU时,固定化脂肪酶的产率均最高。因此,在此实验条件下,合适的酶量为600 PLU。
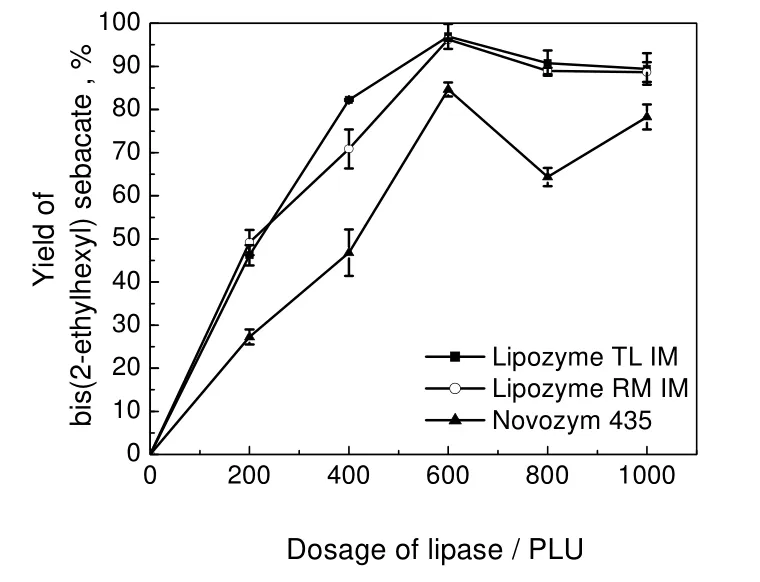
图3 酶量对癸二酸二(2-乙基己基)酯产率的影响Fig.3 Effects of lipase dosage on yield of bis(2-ethylhexyl) sebacate
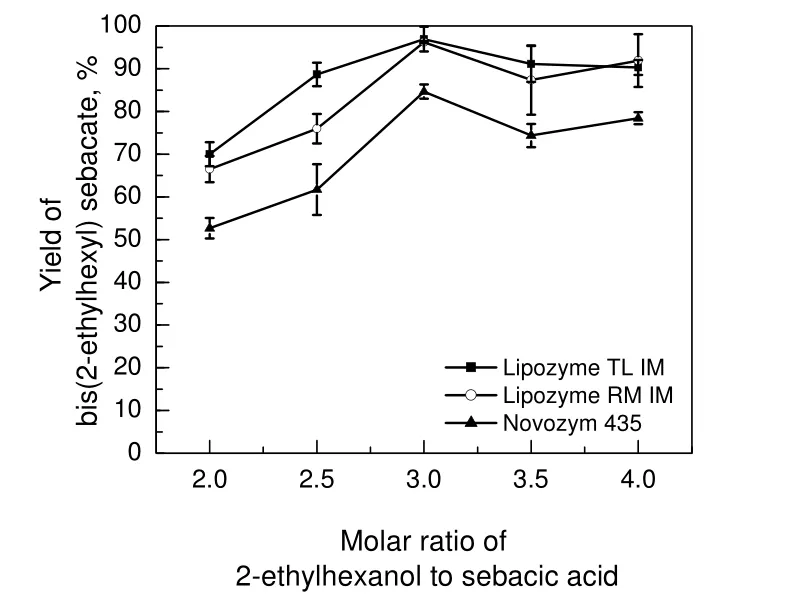
图4 2-乙基己醇和癸二酸物质的量之比对癸二酸二(2-乙基己基)酯产率的影响Fig.4 Effects of molar ratio of 2-ethylhexanol to sebacic acid on yield of bis(2-ethylhexyl) sebacate
2.5 底物比的影响
反应温度40 ℃,癸二酸400 mg,一定量的2-乙基己醇,环己烷15 mL,在600 PLU固定化脂肪酶催化条件下反应24 h,考察底物比对癸二酸二(2-乙基己基)酯产率的影响,结果见图4。由图4可知:Lipozyme RM IM和Novozym 435变化趋势基本一致;当2-乙基己醇和癸二酸物质的量之比从2增加到3,这3种固定化脂肪酶催化产率均呈上升趋势;2-乙基己醇和癸二酸物质的量之比从3增加到4,Lipozyme RM IM和Novozym 435催化产率先降后升,Lipozyme TL IM催化产率则先是略微下降,之后维持在90%左右。当2-乙基己醇和癸二酸物质的量之比为3时,固定化脂肪酶的产率均为最高。因此,在此实验条件下,2-乙基己醇和癸二酸合适的物质的量之比为3。
2.6 固定化脂肪酶的重复使用性
在反应温度40 ℃,癸二酸400 mg,2-乙基己醇0.96 mL(醇酸物质的量之比3),环己烷15 mL,在600 PLU固定化脂肪酶催化条件下反应24 h。反应结束后取样检测,并将固定化酶晾干,以备下一批反应时使用,结果见图5。由图5可知,除第1批反应之后,3种固定化脂肪酶催化癸二酸二(2-乙基己基)酯产率有明显下降之外,从第2批直到第6批,产率都维持在较稳定水平。经过多次重复使用,这3种固定化脂肪酶都能保持较高的催化活性,说明它们在本反应体系中具有良好的稳定性。

图5 固定化脂肪酶的重复使用性Fig.5 Reusability of immobilized lipase
3 结 论
分别采用不同的固定化脂肪酶催化癸二酸二(2-乙基己基)酯合成,在优化的实验条件下,均可以获得较高的产率,其中采用Lipozyme TL IM和Lipozyme RM IM,最高产率可达96%以上,采用Novozym 435,催化产率可达84.65%。这3种固定化脂肪酶使用6次后,均能保持较高产率和较好的催化稳定性。
[1]陈立军, 陈丽琼, 张欣宇, 等. 耐寒增塑剂的应用及发展[J]. 塑料科技, 2007, 35(4): 76-79.Chen Lijun, Chen Liqiong, Zhang Xinyu, et al. Application and development of frost resisting plasticizer[J]. Plastics Science and Technology,2007, 35(4): 76-79.
[2]王树清, 高 崇. 耐寒增塑剂癸二酸二正己酯合成新工艺[J]. 塑料助剂, 2004, (3): 7-9.Wang Shuqing, Gao Chong. Study on synthesis of the cold-resistant plasticizer dihexyl Sebacate[J]. Plastic Additives, 2004, (3): 7-9.
[3]Verhoef M J, Kooyman P J, Peters J A, et al. A study on the stability of MCM-41-supported heteropoly acids under liquid-and gas-phase esterification conditions [J]. Microporous and Mesoporous Materials, 1999, 27: 365-371.
[4]Kozhevnikov I V. Catalysis by heteropoly acids and multicomponent polyoxometalates in liquid-phase reactions[J]. Chemical Reviews, 1998,98 (1): 171-198.
[5]Alsalme A, Kozhevnikova E F, Kozhevnikov I V. Heteropoly acids as catalysts for liquid-phase esterification and transesterification[J]. Applied Catalysis A: General, 2008, 349: 170-176.
[6]王广健, 刘广卿, 杨振兴, 等. Keggin杂多酸负载型催化剂研究及在有机合成中的应用[J]. 有机化学, 2009, 29(7): 1039-1047.Wang Guangjian, Liu Guangqing, Yang Zhenxing, et al. Catalysts loaded with Keggin heteropolyacids and their application to organic synthesis [J]. Chinese Journal of Organic Chemistry, 2009, 29(7): 1039-1047.
[7]Kukovecz Á, Balogi Z, Kónya Z, et al. Synthesis, characterization and catalytic applications of sol-gel derived silica-phosphotungstic acid composites [J]. Applied Catalysis A: General, 2002, 228: 83-94.
[8]Knežević Z D, Šiler-Marinković S S, Mojović L V. Immobilized lipases as practical catalysts [J]. APTEFF, 2004, 35: 151-164.
[9]李 伟, 张 凯, 李宏永, 等. 无溶剂体系固定化脂肪酶催化合成1(2)-丙二醇月桂酸单酯[J]. 中国油脂, 2010, 35(12): 44-47.Li Wei, Zhang Kai, Li Hongyong, et al. Immobilized lipase-catalyzed synthesis of propylene glycol monolaurate in a solvent-free system [J].China Oils and Fats, 2010, 35(12): 44-47.
[10]马 娅, 刘军峰, 邓 利, 等. 固定化脂肪酶Candida sp 99-125催化合成己酸乙酯[J]. 化学反应工程与工艺, 2011, 27(4): 369-373.Ma Ya, Liu Junfeng, Deng Li, et al. Synthesis of ethyl hexanoate over immobilized lipase Candida sp 99-125[J]. Chemical Reaction Engineering and Technology, 2011, 27(4): 369-373.
[11]Yoo I S, Park S J, Yoon H H. Enzymatic synthesis of sugar fatty acid esters [J]. Journal of Industrial and Engineering Chemistry, 2007, 13(1): 1-6.
[12]王乐乐, 白 姝, 孙 彦. 双组分混合有机溶剂中脂肪酶催化反应的热力学分析[J]. 过程工程学报, 2005, 5(6): 605-608.Wang Lele, Bai Shu, Sun Yan. Thermodynamic analysis of lipase-catalysed esterification in binary organic solvent mixtures[J]. Chinese Journal of Process Engineering, 2005, 5(6): 605-608.
[13]Hernández-Martín E, Otero C. Different enzyme requirements for the synthesis of biodiesel: Novozym 435 and Lipozyme TL IM [J].Bioresource Technology, 2008, 99(2): 277-286.
[14]Noureddini H, Harmeier S E. Enzymatic glycerolysis of soybean oil[J]. Journal of the American Oil Chemists' Society, 1998, 75(10):1359-1365.
Synthesis of Bis(2-Ethylhexyl) Sebacate Catalyzed by Immobilized Lipase
Wang Shilu1,2, Zhao Guoming1, Liu Hui1, Zou Huibin1, Xian Mo1
(1. Qingdao Institute of Bioenergy and Bioprocess Technology, Chinese Academy of Sciences, Qingdao 266101, China;2. Graduate University of Chinese Academy of Science, Beijing 100049, China)
Bis(2-ethylhexyl) sebacate was synthesized from sebacic acid and 2-ethylhexanol using different immobilized lipases, namely Lipozyme TL IM, Lipozyme RM IM and Novozym 435, in an organic solution. The effects of solvents, reaction temperature and time, lipase dosage to substrate ratio, on the product yield were investigated. The results showed that the favored synthesis conditions were: reaction temperature of 40 ℃,sebacic acid of 400 mg and 2-ethylhexanol of 0.96 mL (molar ratio of 2-ethylhexanol to sebacic acid was 3),cyclohexane of 15 mL, reaction time of 24 h with 600 PLU lipase. Under above synthesis conditions, the product yield was up to 96.94% with Lipozyme TL IM catalyst, 96.23% with Lipozyme RM IM catalyst, and 84.65%with Novozym 435 catalyst. Moreover, these three kinds of immobilized lipase still maintain high catalytic activities after being used 6 times.
immobilized lipase; bis(2-ethylhexyl) sebacate; organic solvent; cyclohexane
TQ645 文献标识码:A
1001—7631 ( 2012 ) 04—0330—05
2012-07-16;
2012-08-20
王诗路(1984—),女,博士研究生;咸漠(1967—),男,研究员,博士生导师,通讯联系人。E-mail: xianmo@qibebt.ac.cn
国家自然科学基金青年科学基金项目(21106170,21206185);中国科学院创新促进会首批会员专项经费(Y11A031105);山东省自然科学基金(ZR2011CQ049)
