转录因子Ets-1在2型糖尿病肾病中的表达及其意义
2012-01-06沈京群刘殿阁陈涵枝丁弘汪湜周建东
沈京群,刘殿阁,陈涵枝,丁弘,汪湜,周建东
(1.哈尔滨医科大学附属第一医院肾内科,黑龙江哈尔滨 150001;2.东南大学附属中大医院肾内科,江苏 南京 210009)
糖尿病肾病(DN)是糖尿病(DM)慢性微血管病重要并发症,是导致终末期肾衰的主要原因,病理特征为细胞外基质(ECM)在肾小球内过度积聚,这主要是由于ECM自身代谢紊乱所致[1]。Ets-1作为原癌基因,具有多种生物学功能,与编码蛋白酶的启动基因相互作用,增加基质金属蛋白酶-1(MMP-1)、MMP-2及尿纤溶酶原激活物(u-PA)基因启动活性,在诸多纤维化事件基质重塑中起重要作用[2-4]。本研究通过免疫组化,观察2型 DN肾组织内Ets-1、MMP-2、TIMP-2、α-平滑肌肌动蛋白(α-SMA)、波形蛋白(vimentin)及IV型胶原(ColⅣ)的表达,并探讨在2型DN基质重塑中的作用。
1 资料与方法
1. 1 一般资料
研究对象来自东南大学附属中大医院2004年1月至2009年12月成人病例45例,均经肾穿刺活检组织病理及免疫荧光证实,大部分病例行电镜检查。DN组按美国糖尿病学会2007年版的糖尿病诊疗标准选自同期肾穿刺活检证实DN 25例,其中男15例,女10例;年龄35~67岁,平均(41.72±7.02)岁。轻微病变性肾病(MCD)组按WHO(1982年及改良的1995年)肾小球疾病组织学分型方案选自同期肾穿刺活检证实MCD 20例,其中男12例,女8例;年龄18~46岁,平均(38.65±7.78)岁。两组在性别和年龄上无显著差异。排除标准:(1)1型DM、心力衰竭、发热、肿瘤、近期使用过影响肾功能的药物及免疫抑制剂者;(2)近期有手术和创伤史以及自身免疫性疾病;(3)3个月内患有心肌梗死、脑卒中、不稳定心绞痛等严重心脑血管疾病;(4)怀孕或哺乳期妇女。
1. 2 方法
1.2.1 肾脏病理组织学检查 肾组织石蜡切片(4 μm),进行 HE、PAS、PAM 和 Masson 染色,光镜下观察组织病理学变化。
1.2.2 免疫组化 采用SP法[5-6]。石蜡切片常规脱蜡水化后,用10%山羊血清或10%兔血清封闭,分别滴加适当稀释的第一抗体,4℃过夜。滴加生物素标记的第二抗体,再加辣根过氧化物酶(HRP)标记链霉素亲合素,联苯胺(DAB)显色。第一抗体如下:Ets-1(美国Santa Cruz公司),MMP-2和 TIMP-2(Chemicon公司),α-SMA(Dako公司),Vimentin抗体(Dako公司),ColⅣ(Chemicon公司)。应用Image Pro Plus 6.0图像分析软件半定量分析,分别对肾小球及肾小管间质各种抗原蛋白的表达量进行统计分析,计算染色阳性部位(棕色染色区域)相对IOD(累积光密度)。
1.2.3 免疫组化双重染色 碱性磷酸酶(AP)、辣根过氧化物酶(HRP)不同显色完成[5-6]。切片用抗Ets-1或α-SMA单克隆抗体孵化,然后用生物素标识的第二抗体和AP标记的抗生物素卵白素分别孵化,用BCIP/NBT显色,呈紫黑色。染有Ets-1或α-SMA的切片用HRP标记的抗生物素卵白素进行复染MMP-2或ColⅣ,用AEC/H2O2显色,呈深红色。
1. 3 统计学处理
数据均以¯x±s表示,用SPSS 13.0软件处理,方差齐时采用t检验,方差不齐时采用t'检验,P<0.05表示差异有统计学意义。
2 结 果
2. 1 肾脏组织病理改变
MCD组仅见肾小球系膜区扩展,未见基底膜增厚,肾小管及肾间质大致正常。DN组可见肾小球内渗出性病变、肾小球基底膜弥漫增厚及系膜细胞及系膜基质弥漫性增生,可见肾小管上皮细胞肿胀、间质内炎症细胞浸润及纤维化形成。
2. 2 免疫组化表达
两组肾内 Ets-1、MMP-2、TIMP-2、α-SMA、Vimentin及ColⅣ免疫组化半定量分析结果见表1。
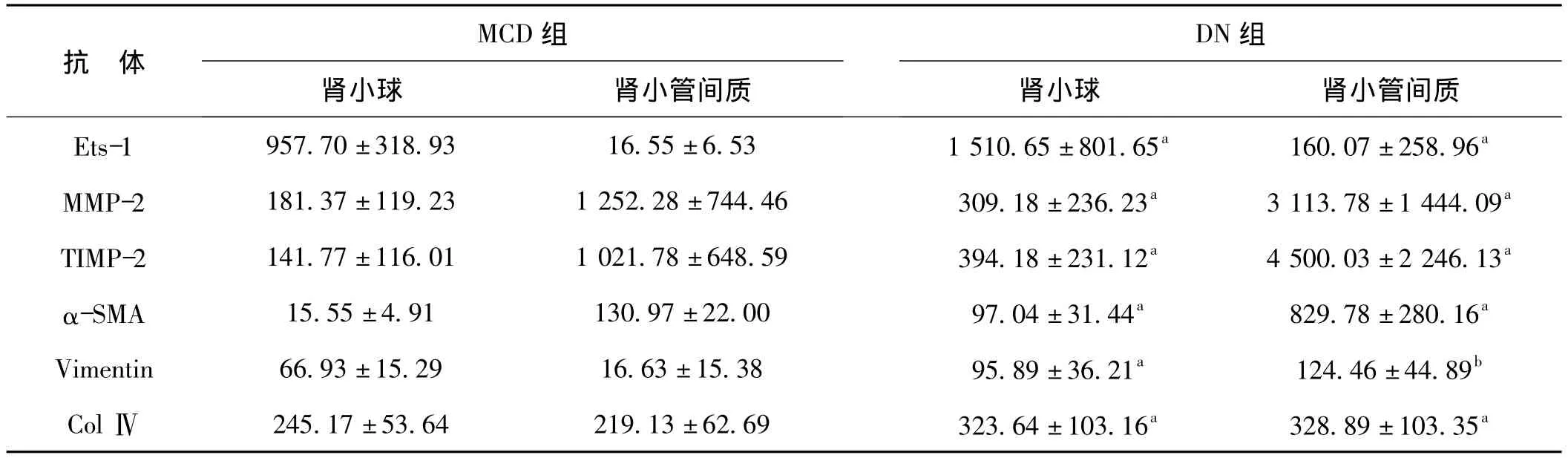
表1 Ets-1、MMP-2、TIMP-2、α-SM、vimentin及ColⅣ免疫组化半定量分析(x¯±s)
MCD组肾内Ets-1微量表达(图1A)。与MCD组比较,DN组肾小球及肾小管间质细胞核内Ets-1表达明显增加(图1B),差异有统计学意义(P<0.05)。MCD组肾内MMP-2弱阳性表达(图2A)。同MCD组比较,DN组肾内可见MMP-2增加性表达(图2B,P<0.05)。与MCD组(图3A)相比,DN组肾内TIMP-2表达显著性增加(图3B,P<0.05)。DN组肾小球及肾小管间质内MMP-2/TIMP-2比值显著性降低,差异具有统计学意义(0.57±0.31 vs 1.43±1.20,0.82±0.40 vs 1.64±1.55,均P<0.05)。MCD组肾内血管壁强阳性表达外,肾小球及肾小管间质轻微表达(图4A)。与MCD组比较,DN组肾内α-SMA表达显著性增加(图4B,P<0.05)。MCD组Vimentin主要在肾小球内阳性表达(图5A)。同 MCD组相比,DN组Vimentin在肾小球表达明显增加(图5A,P<0.05),而Vimentin在肾小管间质内的表达显著性增加(图5A,P<0.01)。MCD组ColⅣ在肾小球基底膜及肾小管基底膜均有明确表达(图6A)。与MCD组比较,DN组ColⅣ在肾小球及肾小管间质内表达显著性增加(图6B,P <0.01)。
2. 3 免疫组化双重染色
免疫双染显示,DN组大多数表型发生变化的α-SMA阳性(黑色)肾小球系膜细胞、肾小管间质细胞同时具有ColⅣ的阳性表达(红色)(图7A),在增生硬化的肾小球系膜细胞及病变的肾小管间质处ColⅣ表达阳性细胞(红色)内亦有α-SMA阳性表达(黑色)(图7A)。增生硬化的肾小球及病变的肾小管间质内Ets-1表达阳性细胞(黑色)亦可见MMP-2阳性表达(红色)(图7B),在增生硬化的肾小球及病变的肾小管间质区Ets-1细胞(黑色)具有MMP-2阳性表达(红色)(图7B)。
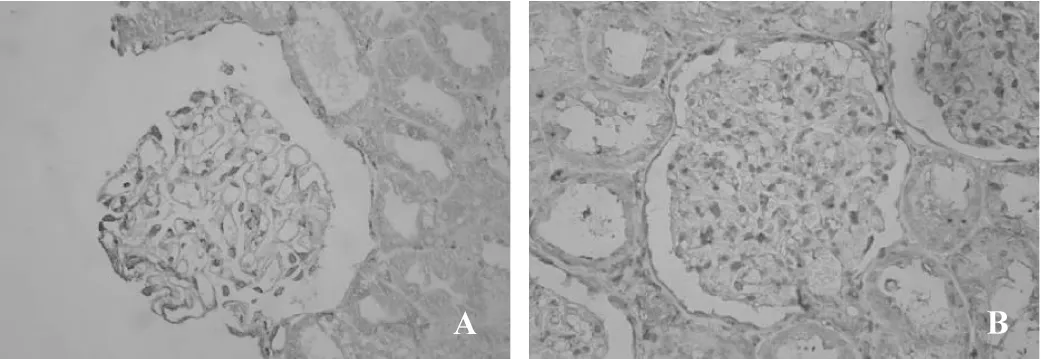
图1 Ets-1免疫组化表达(SP×200)
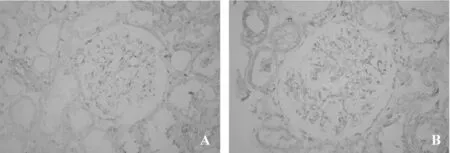
图2 MMP-2免疫组化表达(SP×200)
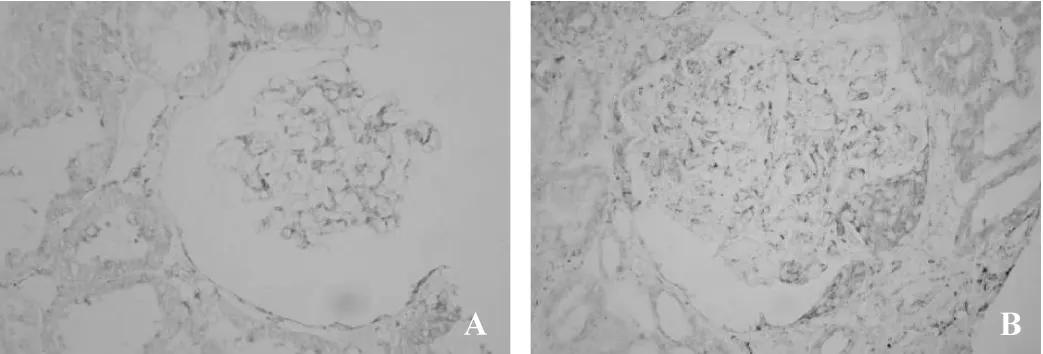
图3 TIMP-2免疫组化表达(SP×200)
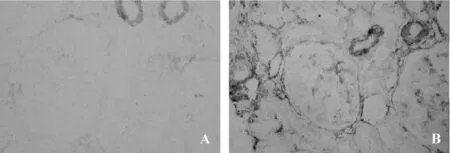
图4 α-SMA免疫组化表达(SP×200)
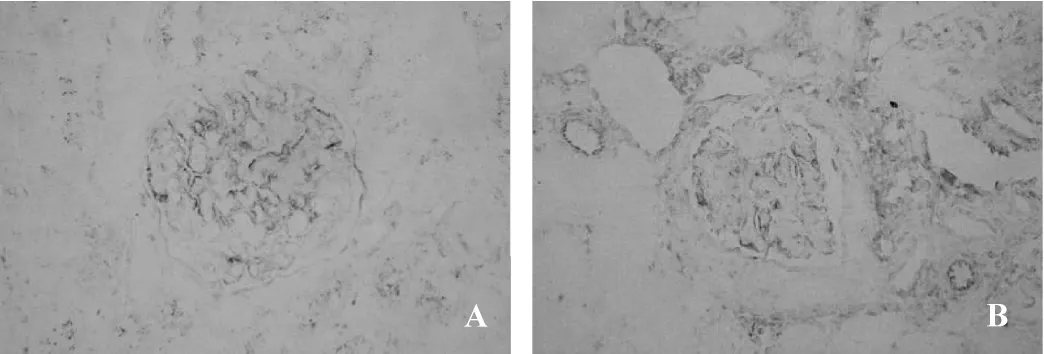
图5 vimentin免疫组化表达(SP×200)
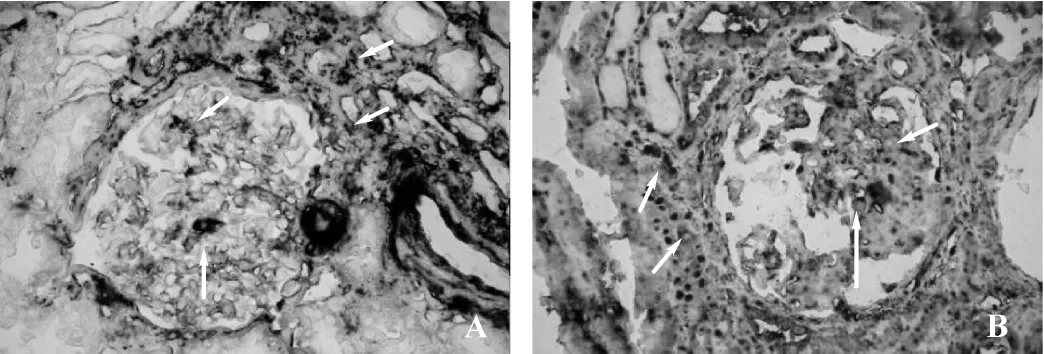
图7 免疫组化双重染色(×200)
3 讨 论
DN是DM微血管病变的常见并发症之一,也是2型DM患者的首位死因。DN肾组织早期病理改变为肾小球肥大、ECM聚集、基底膜增厚,晚期出现弥漫性肾小球硬化及肾小管间质纤维化,导致肾功能衰竭[7]。因此探讨DN的发病机制及寻找防治DN的有效方法,已成为当前临床医学研究的重要课题。
Ets-1是转录因子ets家族成员之一,与v-est原癌基因高度同源性。Ets-1蛋白通过DNA连接区域结合中央GGA的核心序列 (PEA3),在AP-1位点与CFos/c-Jun复合物相互作用,从而激活特定的启动因子表达[8],包括 MMP-1、2、3、9,u-PA,TIMP-1 及 TIMP-2,表明Ets-1原癌基因在MMPs调控中起关键性作用。
MMPs是一组能特异地降解ECM成分的锌(Zn2+)依赖的酶家族,由结缔组织细胞、内皮细胞、单核巨噬细胞、中性粒细胞、肾小球固有细胞、肾小管上皮细胞、肿瘤细胞等合成与分泌,并有特异性的天然抑制剂TIMPs抑制其活性[9]。MMPs能降解几乎所有的ECM成分。MMP-2为明胶酶的一种,它主要定位于肾小球,是ColⅣ的主要降解酶。TIMPs是MMPs的特异性组织抑制物,与活化型MMPs高亲和,以1∶1比例非共价键结合形成 MMP-TIMP复合体,从而阻断MMPs与底物的结合和活化,对MMPs有不同程度的抑制作用,作为肾内调节MMPs活性的主要物质而参与ECM代谢的调节过程[10]。生理状态下,MMPs/TIMPs处于一种动态平衡中,维持ECM正常代谢;在病理状态时该平衡状态被打破,造成ECM的代谢紊乱。TIMP-2是一种非糖化的由194个氨基酸组成的蛋白质,其分子量为21 kD,可特异性抑制MMP-2的活性而导致ECM积聚[11]。
本研究表明,2型DN肾内Ets-1原癌基因明显增高,同时,MMP-2的表达亦增加。但是,TIMP-2表达增加更为明显,引起MMP-2/TIMP-2比值显著性下降,ECM降解少于合成,最终导致胶原过度沉积。因此,有理由推测:Ets-1表达增高可能通过上调MMP-2的表达,进而使ECM降解增加。但是,尚不足以克服因TIMP-2表达显著上调而导致ECM合成大于降解,引起2型DN肾小球硬化及肾小管间质纤维化发生。免疫双染显示,DN组肾小球固有细胞及肾小管间质细胞内Ets-1增加性表达,往往同时伴有MMP-2阳性表达,表明Ets-1可能是上调MMP-2表达的客观形态学依据,进一步证实了Ets-1与MMP-2/TIMP-2系统平衡的密切关系。免疫双染表明多数α-SMA阳性的肾小球固有细胞及肾小管间质细胞同时具有ColⅣ阳性表达,提示α-SMA阳性的肌成纤维细胞分泌胶原成分,导致ECM过度沉积。
本研究首次探讨了Ets-1在2型DN中的表达及基质重塑过程的重要影响,但是有关Ets-1的调节机制尚不明确。研究已表明,DM发生进展过程中高血糖状态往往伴随复杂性炎症反应,同时DN时存在肾组织缺血、缺氧,后者又加重炎症反应,诸多炎症介质与Ets-1的表达有关。例如,AngⅡ参与的MAPK信号通路的ERK1/2、p38和JNK能将外部刺激传到核内,激活转录调节因子包括Ets家族,引起下游基因表达的时空变化[12],Ets-1在肾小球系膜细胞培养中的表达上调可以有效阻止TGF-β诱导的Ⅰ型胶原产生,并能拮抗TGF-β的表达,也提示Ets-1可能通过作用TGF-β受体在 TGF-β参与的 Smad及 RhoA Rhokinase、MAPK信号转导通路中起重要作用[13]。此外,低氧血症、酸中毒及微环境营养不良等诱导多种细胞因子和生长因子的分泌,均能上调Ets-1的活性。因此,有理由推测本研究中Ets-1表达上调可能与以上因素有一定关系。总之,Ets-1转录因子可能通过调节MMP-2/TIMP-2系统平衡而影响ECM代谢,在2型DN基质重塑过程中起重要作用。
[1]KANWAR Y S,WADA J,SUN L,et al.Diabetic Nephropathy:Mechanisms of Renal Disease Progression[J].Exp Bio Med,2008,233:4-11.
[2]SUMIMOE A,MATSUZAKI A,HATTORI H,et al.Expression of matrix metalloproteinase(MMP)and tissue inhibitor of MMP(TIMP)genes in blasts of infant acute lymphoblastic leukemia with organ involvement[J].Luek Res,2007,31:1437-1440.
[3]NAKAMURA Y,ESNAULT S,MAEDA T,et al.Ets-1 regulates TNF γ induced matrix metalloproteinase-9 and tenascin expression in primary bronchial fibroblasts[J].J Immunol,2004,172:1945-1952.
[4]陈涵枝,刘殿阁,丁弘,等.Ets-1在大鼠顺铂相关性肾病基质重塑中的作用[J].现代医学,2008,36(5):301-305.
[5]刘殿阁,张庆娟,宫壮,等.热休克蛋白47在大鼠糖尿病肾病中的作用[J].中华病理学杂志,2007,36(9):627-628.
[6]LIU D,RAZZAQUE M S,NAZNEEN A,et al.Role of heat shock protein 47 on tubulointerstitium in experimental radiation nephropathy[J].Pathol Int,2002,52(5-6):340-347.
[7]LI H,CHEN B K,SHAH,et al.Socioeconomic correlates of inpatient spending for patients with type 2 diabetes mellitus in china:evidence from hangzhou[J].Exp Clin Endocrinol Diabetes,2012,120(1):35-44.
[8]BAILLAT D,LAITEM C,LEPRIVIER G,et al.Ets-1 binds cooperatively to the palindromic Ets-binding sites in the p53 promoter[J].Biochem Biophys Res Commun,2009,378:213-217.
[9]HINSBERGH V W M,KOOLWIJK P.Endothelial sprouting and angiogenesis:matrix metalloproteinases in the lead[J].Cardiovasc Res,2008,78:203-212.
[10]LEE M H,ATKINSON S,MURPHY G.Identification of the extracellular matrix(ECM)binding motifs of tissue inhibitor of metalloproteinases(TIMP)-3 and effective transfer to TIMP-1[J].J Biol Chem,2007,282(9):6887-6898.
[11]沈京群,刘殿阁.转录因子Ets在肾脏细胞外基质重塑中的作用[J].东南大学学报:医学版,2010,29(2):224-227.
[12]VALLEDOR A F,ESTER S T,ARPA L,et al.Selective roles of MAPKs during the macrophage response to IFN-γ[J].J Immunol,2008,180:4523-4529.
[13]MIZUI M,ISAKA Y,TAKABATAKE Y,et al.Transcription factor Ets-1 is essential for mesangial matrix remodeling[J].Kidney Int,2006,70:298-305.
