川芎嗪对大鼠心肌再灌注损伤保护机制的实验研究
2012-01-06吕磊孟庆欣徐军宫剑滨承燕江时森
吕磊,孟庆欣,徐军,宫剑滨,承燕,江时森
(1.南京大学医学院 临床学院,江苏南京 210002;2.南京军区南京总医院心血管内科,江苏 南京 210002;3.南京军区南京总医院超声诊断科,江苏南京 210002)
血运重建术已经成为缩小急性心肌梗死后最终梗塞面积,保存左室功能,改善临床预后的最有效的方法,但同时也能导致严重的缺血再灌注(ischemia reperfusion,IR)损伤。如何减轻心肌IR损伤一直是冠心病防治中亟待解决的重要问题[1]。近年研究发现,再灌注时磷脂酰肌醇-3激酶 (phosphatidylinositol-3-OH kinase,PI3K)/蛋白激酶B(Akt)的激活是心肌保护的重要机制之一,能通过激活下游靶目标,促进心肌细 胞 存 活 和 缩 小 梗 死 面 积[2]。川 芎 嗪(tetramethylpyrazine,TMP)是中药川芎的有效单体成分,具有抗血小板聚集、扩张小动脉、改善微循环及活血化淤等作用,在心血管疾病中有重要的应用前景。本研究拟探讨川芎嗪对在体大鼠心肌IR的保护作用和量效关系及其可能作用机制,为临床防治心肌IR损伤提供理论基础。
1 材料与方法
1. 1 实验动物
健康雄性SD大鼠56只,体质量250~280 g,由南京军区南京总医院实验动物中心提供。
1. 2 药物和试剂
川芎嗪(中国药品生物制品检定所),渥曼青霉素、三苯基氯化四氮唑(TTC)(Sigma-Aldrich公司),抗Akt、抗磷酸化Akt(serine 473)、抗内皮型一氧化氮合酶(eNOS)、抗磷酸化eNOS(serine 1177)多克隆抗体(CST公司),辣根过氧化酶羊抗兔IgG抗体(Sigma公司),蛋白酶和磷酸酶抑制剂混合物(Thermo Scientific公司),超氧化物歧化酶(SOD)、丙二醛(MDA)试剂盒(南京建成生物工程公司)。
1. 3 实验仪器
小动物呼吸机TKR200C型(江西省特立麻醉呼吸设备公司),美国 Polytron MR2100匀浆器,美国 BIORAD电泳仪,日立7600型全自动生化分析仪。
1. 4 实验方法
1.4.1实验分组 大鼠随机分成6组。(1)假手术组(n=6):开胸,只穿线不结扎冠状动脉;(2)IR组(n=10):开胸结扎冠状动脉前降支35 min,再灌注120 min,建立IR损伤模型;(3)川芎嗪低剂量组(TMP-L组,n=10):结扎前降支前5 min静脉给予川芎嗪5 mg·kg-1,余同IR组;(4)川芎嗪中剂量组(TMP-M组,n=10):川芎嗪10 mg·kg-1,余同TMP-L组;(5)川芎嗪高剂量组(TMP-H 组,n=10):川芎嗪30 mg·kg-1,余同 TMP-L组。(6)川芎嗪+渥曼青霉素组(TMP+Wort组,n=10):缺血前5 min静脉给予川芎嗪10 mg·kg-1,再灌前15 min 给予 PI3K 抑制剂渥曼青霉素15 μg·kg-1,余同IR组。
1.4.2 在体大鼠IR模型的建立和标本采集 氯胺酮(150 mg·kg-1)腹腔注射麻醉,同时给予肝素(500 IU·kg-1),仰卧位固定,记录Ⅱ导联心电图。颈部正中切口气管切开接小动物呼吸机机械通气(潮气量8 ml·kg-1,频率60 次·min-1)。胸骨左缘3-4 肋间开胸,暴露心脏,打开心包,于左心耳与肺动脉圆锥之间左心耳下方3 mm处前降支贯穿6-0无损伤缝线,结扎前降支。结扎后心电图Ⅱ导联提示J点明显抬高,QRS波增宽以及结扎线以下左室前壁出现紫绀为结扎成功。持续缺血35 min后剪断结扎线再灌注120 min。抽取大鼠右房血,3 000 r·min-1离心 5 min,留取上清检测心肌酶。每组4只行左室心肌梗死面积测定,余留取左室缺血区心肌约150 mg,快速液氮冷冻,随后移入-80℃冰箱冻存待检。
1.4.3 心肌梗死面积的测定(伊文蓝/TTC双染色法) 在120 min再灌注结束时于原结扎点重新结扎前降支,尾静脉注入2%伊文蓝2 ml,心外膜蓝染后获取心脏,-20℃冰冻30 min,将心脏从心尖至心底横向均匀切片,生理盐水冲洗干净,将心肌片放在1%TTC磷酸盐缓冲液中,37℃孵化20 min染色,此时蓝色为非缺血区心肌,灰白色为梗死心肌,砖红色和灰白色为缺血区心肌。10%甲醛中固定过夜,数码相机拍照,Image J绘图软件(美国NIH)测定左室梗死面积,梗死心肌范围用梗死面积/缺血面积百分比表示。
1.4.4 SOD活性和MDA含量的测定 再灌注结束后,将心脏组织制备心肌匀浆上清液。按试剂盒要求,黄嘌呤氧化酶法检测SOD活性,硫代巴比妥酸(TBA)显色法测定MDA含量。
1.4.5 Western blotting 测定心肌组织中磷酸化 Akt、Akt、磷酸化eNOS和eNOS含量 应用裂解液(含蛋白酶和磷酸酶抑制剂)提取心肌标本总蛋白,考马斯亮蓝测定蛋白浓度。加样总蛋白40 μg,以上样缓冲液等体积稀释,室温下聚丙烯酰胺凝胶电泳,蛋白质电转至聚偏二氟乙烯膜,室温下脱脂奶粉缓冲液封闭,将PVDF膜用相应一抗(磷酸化 Akt、Akt、磷酸化 eNOS、eNOS,1∶1 000稀释)封闭,4℃过夜。加入辣根过氧化酶标记的二抗(1∶5 000稀释)封闭液中,室温孵育2 h,行发光检查并曝光分析,采用Bio-Rad公司的Gel Doc2000凝胶图像专用软件分析目标条带的积分吸光度值(IA=平均吸光度×面积),分别以磷酸化Akt/Akt、磷酸化 eNOS/eNOS值反映 Akt、eNOS的相对活化水平。
1. 5 统计学处理
数据以¯x±s表示,应用SPSS 13.0软件进行分析。各组间比较采用单因素方差分析,组间两两比较采用SNK检验,P<0.05为差异具有统计学意义。
2 结 果
2. 1 心肌酶结果
再灌注结束时,IR组血清CK-MB、LDH含量分别为(7 355.8 ±870.5)U·L-1和(1 667.4 ±147.8)U·L-1。川芎嗪各组CK-MB及LDH均低于IR组(均P<0.05),加用渥曼青霉素后,大鼠血清 CK-MB及LDH水平明显增高(TMP+Wort组与TMP-M组相比较,P <0.05),见表1。
表1 各组大鼠心肌损伤标志物及氧化应激水平(n=6,¯x±s)Tab 1 The levels of enzymatic dynamics and oxidative stress of myocardium(n=6,)
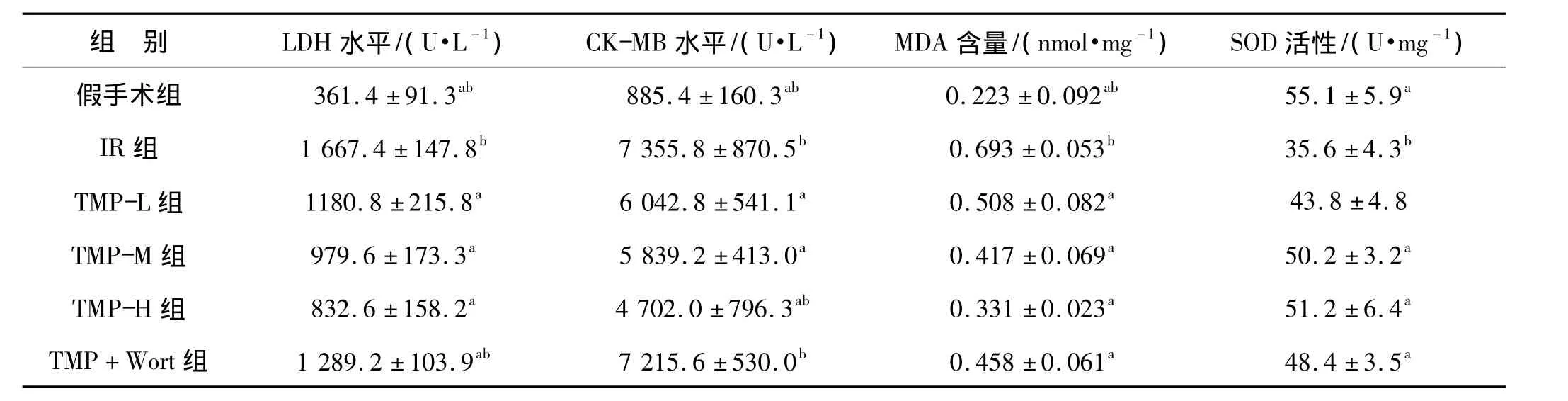
表1 各组大鼠心肌损伤标志物及氧化应激水平(n=6,¯x±s)Tab 1 The levels of enzymatic dynamics and oxidative stress of myocardium(n=6,)
与 IR 组比较,a P <0.05;与 TMP-M 组比较,b P <0.05
(U·mg-1)5.9a 4.3b 4.8 3.2a TMP-H 组 832.6 ±158.2a 4 702.0 ±796.3ab 0.331 ±0.023a 51.2 ±6.4a TMP+Wort组 1 289.2 ±103.9ab 7 215.6 ±530.0b 0.458 ±0.061a 48.4 ±3.5a
2. 2 心肌梗死面积测定结果
假手术组未见明显缺血及梗死区,IR组大鼠心肌梗死面积为(50.4±4.6)%;中、高剂量川芎嗪预处理能减少心肌梗死面积[分别为(38.7±4.5)%和(36.3±4.3)%,与(50.4 ±4.6)% 相比较,均 P < 0.05];TMP-L组和TMP+Wort组大鼠心肌梗死面积分别为(46.9 ±3.1)%和(49.8 ±4.7)% ,与 IR 组相比,差异均无统计学意义(P>0.05)。
2. 3 各组心肌SOD活性、MDA含量
川芎嗪中、高剂量组与IR组相比,心肌SOD活性增加,MDA含量降低(P<0.05),川芎嗪低剂量组与IR组的SOD活性无明显差异(P>0.05),见表1。
2. 4 各组大鼠心肌组织中磷酸化 Akt和磷酸化eNOS的蛋白表达结果
与IR组相比,川芎嗪中、高剂量组磷酸化Akt蛋白表达明显增高[分别为1.61 ±0.18、1.65 ±0.18,与0.79±0.10(IR 组)相比较,均 P <0.05],川芎嗪各组的磷酸化eNOS蛋白表达亦明显增高[低、中、高组分别为 1.69 ±0.41、1.87 ±0.33、3.21 ±0.62,与0.94±0.22(IR 组)相比较,均 P <0.05]。渥曼青霉素能显著抑制TMP所致的Akt和eNOS磷酸化(TMP+Wort组的磷酸化 Akt为 0.54 ±0.15,磷酸化eNOS为0.53±0.14,与 IR 组相比较,均 P >0.05)。见图1。
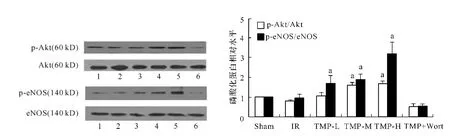
图1 心肌组织中磷酸化Akt(p-Akt)和磷酸化eNOS(p-eNOS)的蛋白表达结果Fig 1 Western blotting analysis of Akt and eNOS phosphorylation in rat cardiac tissue
3 讨 论
心肌缺血再灌注损伤仍是目前亟待解决的问题[1]。缺血再灌注时心肌缺血首先可导致心肌酶漏出、收缩偶联障碍,进一步则可导致不可逆的细胞损伤和死亡。CK-MB是临床诊断急性心肌梗死应用最广泛的酶,由于CK-MB主要存在于心肌内,对心肌坏死的检出较为特异,是心肌损伤的特异和敏感指标,对判断心肌梗死的扩展、早期心肌梗死、估计心肌梗死的范围等有重要意义。本研究结果表明,在体大鼠缺血再灌注损伤模型中,川芎嗪组大鼠心肌梗死面积、心肌CK-MB和LDH水平低于IR组,中剂量及高剂量组尤为明显,说明川芎嗪可以减轻心肌细胞膜的损伤,降低心肌酶的释放,减少心肌梗死面积。
氧自由基生成是心肌再灌注损伤的主要病理机制之一,再灌注过程中大量氧自由基和活性氧的产生可以直接损伤心肌细胞,导致细胞结构、功能改变,引起细胞损伤与死亡[3]。SOD是一类广泛存在于生物体内的金属酶,是内源性氧自由基清除剂,可清除生物体内在利用氧过程中产生的超氧离子,其值间接反映机体清除氧自由基的能力。MDA是生物膜发生脂质过氧化反应的重要产物,能较好反映组织脂质过氧化程度,是衡量氧自由基对细胞损害的标志之一[4]。既往研究表明,在脑缺血再灌注损伤[5-6]及肾小管[7]缺血再灌注损伤模型中,川芎嗪均有抗氧化作用。在本实验中,与IR组相比,川芎嗪中、高剂量组SOD活性增加而MDA含量降低,表明川芎嗪能有效减轻氧化应激水平,清除氧自由基,减轻脂质过氧化,保护线粒体结构和功能。这与文献报道[8-10]一致。上述结果分别从酶学、宏观病理、氧化应激指标等方面说明川芎嗪对IR损伤心肌有保护作用。本研究还发现,低剂量川芎嗪(5 mg·kg-1)大鼠心肌梗死面积较IR组差异无统计学意义,而中、高剂量川芎嗪(分别为10 mg·kg-1和30 mg·kg-1)预处理能显著减少心肌梗死面积,中、高剂量川芎嗪组氧化指标较低剂量组也有改善,提示川芎嗪对心肌IR损伤的保护作用与剂量相关。
PI3K是生长因子超家族信号传导过程中的重要分子,可被多种细胞因子和理化因素激活。PI3K下游有多种效应分子,Akt处于这一通路的中心环节,是PI3K下游直接和最主要的靶酶。Akt通路主要负责由PI3K始动的生物信息的传导,在细胞代谢、细胞周期调控和细胞生长凋亡等多种生物学过程中发挥着重要作用,降低缺血再灌注损伤的发病率及死亡率[11-12]。PI3K/Akt是近年来研究较多的信号通路,是再灌注挽救激酶信号通路的重要组成部分[3]。在再灌注初期,各种心肌保护手段能主动募集PI3K/Akt信号转导通路。多项研究表明,缺血预适应和缺血后处理等机械干预和药物干预(如他汀、腺苷、心房钠尿肽等)均能在再灌时激活PI3K/Akt信号通路,促进心肌细胞存活和缩小梗死面积[13]。本研究表明,川芎嗪中、高剂量组上调了磷酸化Akt的表达,但PI3K抑制剂渥曼青霉素能消除TMP所致的Akt的磷酸化,提示TMP激活了PI3K/Akt信号通路。
PI3K/Akt信号通路涉及多种细胞内信号转导介质和效应蛋白。其中,eNOS是PI3K/Akt信号通路的下游靶点之一[14]。Akt的活化使eNOS的表达上调,eNOS丝氨酸1177位点的磷酸化导致其活性增加,最终通过减少线粒体通透性转换孔的开放,改善线粒体能量的生成,保持线粒体外膜的稳定性,从而减少凋亡和保存心肌[15]。近年研究发现,川芎嗪能逆转高葡萄糖所致内皮细胞磷酸化eNOS的下调,增加一氧化氮含量,保护内皮细胞[8]。本研究中,川芎嗪各组均上调了磷酸化eNOS的表达,PI3K抑制剂渥曼青霉素能消除TMP所致的eNOS的磷酸化,表明TMP所致的eNOS的激活是通过PI3K/Akt信号通路产生的。而TMP+Wort组心梗面积较IR组无明显差异,提示渥曼青霉素能减弱TMP的心肌保护作用。因此,本实验证实,川芎嗪对心肌缺血再灌注损伤的保护作用可能与PI3K/Akt-eNOS信号通路的激活有关,并通过依次激活下游靶目标,从而发挥心肌保护作用。
PI3K/Akt的下游靶点还包括B细胞淋巴瘤/白细胞2(Bcl-2)家族、糖原合成酶激酶3β(GSK-3β)、天冬氨酸蛋白酶9(caspase-9)、70 kD核糖体蛋白s6激酶(p70S6K)等[16],这些靶酶是否参与川芎嗪对在体大鼠心肌再灌注损伤的保护作用,尚待进一步研究。
[1] HAUSENLOY D J,YELLON D M.Time to take myocardial reperfusion injury seriously[J].N Engl J Med,2008,359(5):518-520.
[2]MULLONKAL C J,TOLEDO-PEREYRA L H.Akt in ischemia and reperfusion[J].J Invest Surg,2007,20(3):195-203.
[3]YELLON D M,HAUSENLOY D J.Myocardial reperfusion injury[J].N Engl J Med,2007,357(11):1121-1135.
[4]徐俊华,刘志勇,谢鹏.左西孟旦后处理对兔心肌缺血再灌注损伤的保护作用[J].现代医学,2009,37(3):200-204.
[5]FAN L,WANG K,SHI Z,et al.Tetramethylpyrazine protects spinal cord and reduces inflammation in a rat model of spinal cord ischemia-reperfusion injury[J].J Vasc Surg,2011,54(1):192-200.
[6]LIANG Y,YANG Q H,YU X D,et al.Additive effect of tetramethylpyrazine and deferoxamine in the treatment of spinal cord injury caused by aortic cross-clamping in rats[J].Spinal Cord,2011,49(2):302-306.
[7]FENG L,KE N,CHENG F,et al.The protective mechanism of ligustrazine against renal ischemia/reperfusion injury[J].J Surg Res,2011,166(2):298-305.
[8] KANG Y,HU M,ZHU Y,et al.Antioxidative effect of the herbal remedy Qin Huo Yi Hao and its active component tetramethylpyrazine on high glucose-treated endothelial cells[J].Life Sci,2009,84:428-436.
[9]李岚,姚玉宇,马根山,等.川芎嗪对体外血管内皮祖细胞氧化损伤的保护作用[J].东南大学学报:医学版,2009,28(3):180-184.
[10]LI S Y,JIA Y H,SUN W G,et al.Stabilization of mitochondrial function by tetramethylpyrazine protects against kainateinduced oxidative lesions in the rat hippocampus[J].Free Radic Biol Med,2010,48(4):597-608.
[11]MIYAMOTO S,RUBIO M,SUSSMAN M A.Nuclear and mitochondrial signalling Akts in cardiomyocytes[J].Cardiovasc Res,2009,82(2):272-285.
[12]许朝,姜藻.LY294002对胃癌细胞SGC7901增殖及相关调控因子的影响[J].现代医学,2010,38(3):230-234.
[13]吕磊,江时森.再灌注损伤挽救激酶信号通路在心肌再灌注损伤保护中的研究进展[J].医学研究生学报,2010,23(12):1309-1313.
[14]FULTON D,GRATTON J P,MCCABE T J,et al.Regulation of endothelium-derived nitric oxide production by the protein kinase Akt[J].Nature,1999,399(6736):597-601.
[15]BALAKUMAR P,KATHURIA S,TANEJA G,et al.Is targeting eNOS a key mechanistic insight of cardiovascular defensive potentials of statins?[J].J Mol Cell Cardiol,2012,52(1):83-92.
[16]VIGNERON F,DOS SANTOS P,LEMOINE S,et al.GSK-3beta at the crossroads in the signalling of heart preconditioning:implication of mTOR and Wnt pathways[J].Cardiovasc Res,2011,90(1):49-56.versible protein-protein conjugation[J].Biochem J,1978,173(6):723-737.
[8]曲秋莲,张英鸽.纳米技术和材料在医学上应用的现状与展望[J].东南大学学报:医学版,2011,30(1):157-163.
[9]HAUN J B,DEVARAJ N K,HILDERBRAND S A,et al.Bioorthogonal chemistry amplifies nanoparticle binding and enhances the sensitivity of cell detection[J].Nat Nanotechnol,2010,5(9):660-665.
[10]SHI M,LU J,SHOICHET M S.Organic nanoscale drug carriers coupled with ligands for targeted drug delivery in cancer[J].J Mater Chem,2009,19:5485-5498.
[11] BRANNON-PEPPAS L,BLANCHETTE J O.Nanoparticle and targeted systems for cancer therapy[J].Adv Drug Deliv Rev,2004,56(11):1649-1659.
[12]王子妤,王丽,张东生.纳米雄黄脂质体的制备﹑特性检测和体外抗肿瘤细胞作用的研究[J].东南大学学报:医学版,2009,28(3):175-179.
[13]SHI M,HO K,KEATING A,et al.Doxorubicin-conjugated immuno-nanoparticles for intracellular anticancer drug delivery[J].Adv Funct Mater,2009,19:1689-1696.
[14]MAHMOUDIAN J,JEDDI-TEHRANI M,RABBANI H,et al.Conjugation of R-phycoerythrin to polyclonal antibody and F(ab')2 fragment of a polyclonal antibody by two different methods[J].Avicenna J Med Biotechnol,2010,2(2):87-91.
